杨梅叶原飞燕草素对胰脂肪酶和磷脂酶A1的影响
2018-06-19周晓舟陈士国叶兴乾
周晓舟,陈士国,叶兴乾
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
原花色素具有多酚类物质普遍具有的抗氧化性等活性[1-8],在保健品与化妆品领域的应用已较为普遍[9-14],而在治疗疾病方面,对心血管疾病[15-16]、糖尿病[17]、癌症[18-19]、肥胖[20-21]、精神疾病[22-23]等也有不少相关报道。Yang Haihua等[24]的研究表明杨梅的树叶含有丰富的原花色素,其类型基本为原飞燕草素,而原飞燕草素因为其棓酸酯化结构而具有更强大的抗氧化等生物活性[25]。在本课题组之前的研究中[26],通过大孔树脂对杨梅叶原飞燕草素进行了有效提纯,得到了原飞燕草素质量分数为53%的杨梅叶提取物,随后利用此提取物进行了对肥胖治疗的初步研究。其中,衡量肥胖治疗效果的一个经常采用的标准,也是检验某类物质能否抑制人体从外界摄入脂肪的检测对象,就是胰脂肪酶或者磷脂酶的活性[27]。
脂肪酶全称为甘油三酯基水解酶,是一种特殊的酯基水解酶。其中主要来自于胰腺的胰脂肪酶是胰腺分泌的多种消化酶之一,也是人体从外界摄入脂肪的必要消化酶之一,可水解50%~70%的膳食脂肪。脂肪酶的作用是将外界摄入的脂肪进行分解,分解得到的甘油和脂肪酸被人体小肠吸收后,在肝脏重新合成能够被人体利用的脂肪[28]。
磷脂酶是磷脂酶A1、A2、B、C、D等亚型的统称,是能够水解体内以及外界摄入磷脂的一类脂质水解酶,在动植物体内广泛存在,其中磷脂酶A1主要存在于细胞溶酶体内,能够催化甘油磷脂的第一位酯键断裂,产生脂肪酸,是催化分解产生脂肪酸的重要途径之一。磷脂是生物膜的重要组成部分,人类通过食物的摄入从外界摄取的磷脂是人体内磷脂组成的重要来源,同时通过磷脂酶的水解作用得到的甘油和脂肪酸也是人体重新合成脂肪的重要来源[29]。我们所食用的食物,除了甘油三酯,还存在大量的各种生物膜,因此人体摄入的脂肪总量非常大。
人体通过食物摄入的脂肪,在胰脂肪酶和磷脂酶A1的作用下,分解成大量的能够被利用的甘油和脂肪酸。而一旦抑制了脂肪酶或者磷脂酶A1的活性,就能够抑制人体对食物中的脂肪以及磷脂的分解,从而使得人体摄入的脂肪减少,达到抑制肥胖的目的[30]。
本实验采用奥利司他(Orlistat)以及文献[26]中提到的杨梅叶粉末(leaf powder of Chinese bayberry,LCB)、杨梅叶含糖提取物(non-desugarized prodelphinidins extract,NDPE)和杨梅叶去糖提取物(desugarized prodelphinidins extract,DPE)作为研究对象,构建了肥胖大鼠模型,针对胰脂肪酶和磷脂酶A1进行了体内外活性抑制能力的比较,并对抑制能力较好的提取物进行了进一步的分析,包括测定其半抑制浓度(half maximal inhibitory concentration,IC50)和抑制类别,为评价其作为减肥产品的潜力和进一步研究提供依据。
1 材料与方法
1.1 材料与试剂
Orlistat标准品 阿拉丁试剂有限公司;LCB、NDPE、DPE其原飞燕草素质量分数经测定分别为4.3%、26.0%、53.0%。
大豆浓缩磷脂、4-甲基伞形酮油酸酯(4-methylumbelliferyl oleate,4-MUO)标准品和三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)阿拉丁试剂有限公司;猪胰腺脂肪酶、人磷脂酶A1上海劲马生物科技有限公司;聚乙烯醇(polyvinyl alcohol,PVA)、乙醇和盐酸均为分析纯。
1.2 仪器与设备
荧光酶标仪 美国Thermo Fisher公司;916Ti-Touch自动滴定仪 瑞士万通公司;KDS-12电热恒温水浴锅嘉兴市中新医疗仪器有限公司;TD5K台式低速离心机长沙东旺实验仪器有限公司。
1.3 方法
1.3.1 动物实验
1.3.1.1 饲料配制

表1 实验动物饲料成分表Table 1 Feed ingredients of experimental animals g/kg
大鼠饲料自行配制,具体成分如表1所示,其中矿物质混合物及维生素复合物均参照AIN-93配方。高脂饲料由79%(质量分数,下同)普通饲料,20%猪油和1%胆固醇组成。普通饲料与高脂饲料在经过辐照处理后,压模成短棍状便于饲喂。
1.3.1.2 大鼠造模
选用雄性SD大鼠,按体质量随机分为6 组:NF组、HF组、Orlistat组、LCB组、NDPE组和DPE组,每组8 只,共48 只。考虑到造膜成功性,需大鼠60 只。将60 只实验大鼠放入钢丝笼内饲喂,每笼4 只,自由摄食和饮水,每周记录食量,连续喂养4 周。正常组按普通饲料喂食,模型组和治疗组都按HF饲料喂食,室温(23±2)℃,12 h明暗交替,4 周后测定体质量,造模成功的标准为超过同时饲喂的正常大鼠体质量的10%。
1.3.1.3 干预实验
筛选造模成功的大鼠,分别安排不同饲料继续饲喂。正常组仍为NF组饲料,模型组为HF组饲料,干预组分别为Orlistat组、LCB组、NDPE组、DPE组饲料。室温(23±2)℃,12 h明暗交替,每隔一周称取一次体质量,经约4 周喂食,结束实验。
1.3.2 酶活力的测定
胰脂肪酶活力测定参考文献[10],有所改动。分别取1 mg的Orlistat、LCB、NDPE以及DPE溶解到10 mL缓冲溶液中,作为抑制剂参与抑制胰脂肪酶分解脂质的反应。相同环境下,在96 孔板中按顺序添加25 μL抑制剂、10 μL底物4-MUO、40 μL Tris-HCl缓冲液、25 μL胰脂肪酶开始反应,所有反应物均使用Tris-HCl缓冲液配制成一定质量浓度的溶液。空白对照用25 μL的Tris-HCl缓冲液替代抑制剂,在25 ℃环境下培养一定时间后,添加100 μL pH 4.2的柠檬酸缓冲液用以使反应停止。体内酶活力测定时,大鼠经过颈部脱臼处死,立即解剖后截取相同质量的大鼠小肠段,溶于相应的缓冲溶液中,然后进行荧光强度的测定。
胰脂肪酶活力以由荧光强度计算出的抑制率作为参考标准,按公式(1)进行计算。

式中:Y0为空白对照的荧光强度;Ym为无抑制剂添加组的荧光强度;Yn为不同抑制剂添加组的荧光强度。
磷脂酶A1活力检测参考文献[10],有所改动。将4 g的底物大豆浓缩磷脂、0.5 g PVA溶于100 mL pH 7.0的磷酸盐缓冲液中,离心机1 000 r/min均质3 min,得到底物溶液。取4 个100 mL高型烧杯,2 个作为空白瓶,2 个作为样品瓶,各加底物溶液25 mL,再于空白瓶中加入95%乙醇15 mL,水浴预热5 min,然后在各瓶中加入磷脂酶A1液的稀释液1 mL(用磷酸盐缓冲液稀释),立即混匀计时,在水浴中反应一定时间,于样品瓶中立即补加95%乙醇15 mL终止反应,于自动滴定仪下用NaOH标准溶液滴定(按GB/T 601—2002《化学试剂 标准滴定溶液的制备》配制和标定,NaOH浓度为0.5 mol/L),计算标准碱液平均消耗量。
磷脂酶活力定义为:在特定条件下1 min水解磷脂产生1 μmol游离脂肪酸所需的酶量即为一个磷脂酶活力单位(U)。对于液体酶制剂,其酶活力表示为每克酶液所测得的磷脂酶活力单位,即U/g。按公式(2)进行计算。
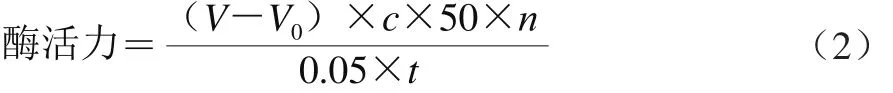
式中:V为滴定样品时消耗的NaOH标准溶液体积/mL;V0为滴定空白时消耗的NaOH标准溶液体积/mL;c为NaOH标准溶液的浓度/(mol/L);50为1.00 mL 0.05 mol/L NaOH标准溶液相当于脂肪酸50 μmoL;n为酶液样品的稀释倍数;t为测定酶活力时的反应时间/min。
为方便进行比较,磷脂酶的酶活力转化为抑制剂对磷脂酶的抑制率来表示。按公式(3)进行计算。

式中:V为滴定样品时消耗的NaOH标准溶液体积/mL;V0为滴定空白时消耗的NaOH标准溶液体积/mL。
1.3.3 抑制类型的判定
由于待测样品的区别在于杨梅叶原花色素质量浓度的高低,为了更好说明杨梅叶原花色素与抑制胰脂肪酶和磷脂酶A1活性的构效关系,根据现有样品中杨梅叶原花色素的质量浓度,选择其中质量浓度较高的DPE组作为主要研究对象,测定其IC50并判定其抑制类型。
根据酶促反应的机制,需基于米氏常数(Km)和最大反应速率(vmax)的测定来鉴别抑制剂抑制类别。Km表示的是酶促反应速率达到vmax一半时的底物浓度,它能够表示酶和底物的亲和程度,是酶的特征常数之一。vmax表示的是酶完全被底物饱和时的反应速率。根据酶促反应动力学测定绘图:在竞争性抑制的酶促反应过程中,当抑制强度增大时,直观地表现为抑制剂浓度的增大,Km值变大,vmax值不变;在非竞争性抑制的酶促反应过程中,当抑制强度增大时,直观地表现为抑制剂浓度的增大,Km值不变,vmax值减小。而抑制常数(Ki)被称为酶-抑制剂复合物解离常数,是表现抑制剂与酶亲和度的一个指标,Ki值越小代表抑制剂与酶的结合越稳定,从而说明其抑制能力越强。
选取不同的DPE质量浓度(0.005、0.010、0.015、0.020、0.025 mg/mL),分别在反应1底物浓度[S1](1 mmol/L)和反应2底物浓度[S2](2 mmol/L)条件下测定每分钟反应消耗底物的量,即反应速率v,然后以DPE质量浓度为横坐标,反应速率v的倒数1/v为纵坐标做散点图,绘制Dixon图,得到Ki值。
选取不同的底物质量浓度[S](0.005、0.010、0.020、0.040、0.080 mg/mL),分别在有DPE(质量浓度为0.012 4 mg/mL)或无DPE的情况下测定反应速率v。以[S]的倒数1/[S]为横坐标,v的倒数1/v为纵坐标做散点图,绘制Lineweaver-Burk图,得到Km值,检验酶与抑制剂的结合稳定性,并判定抑制类型。
1.4 数据处理
2 结果与分析
2.1 体质量变化
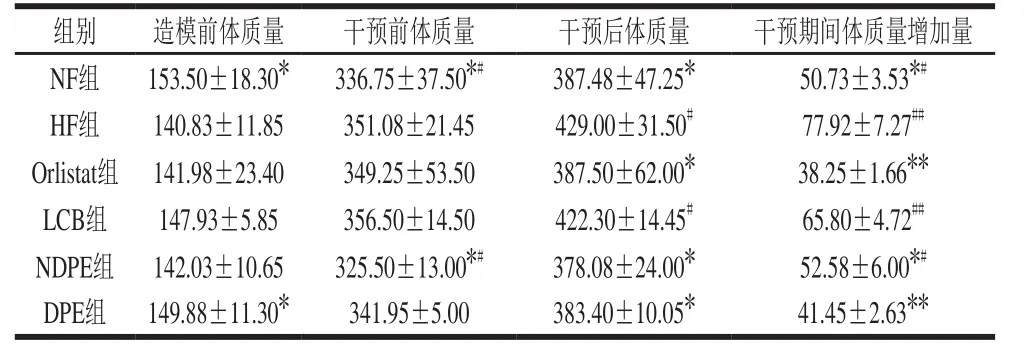
表2 不同抑制剂对大鼠体质量的影响(n=8)Table 2 Effect of different inhibitors on body weight in SD rats (n= 8)g
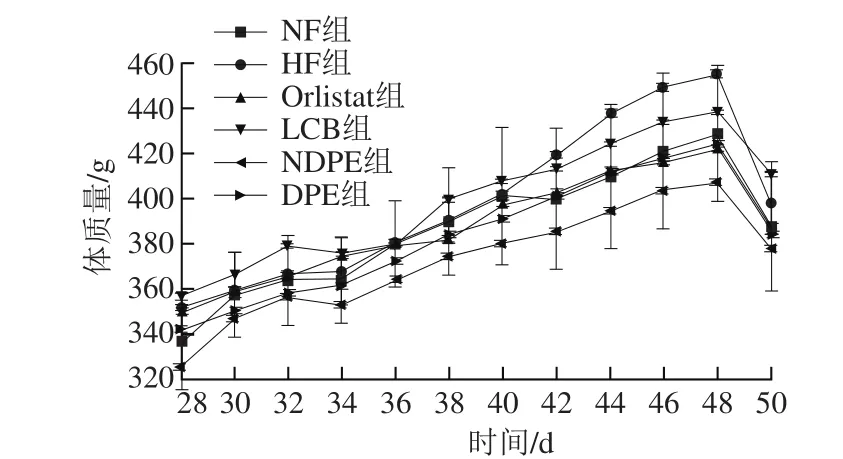
图1 抑制剂干预实验后SD大鼠体质量变化情况Fig. 1 Body weight changes of SD rats after intervention with inhibitors
大鼠初始体质量在140~150 g,造模成功的大鼠体质量在325~356 g,高于普通饲料喂养的SD大鼠至少10%,具体变化见表2。不同组SD大鼠抑制剂干预实验后体质量变化情况如图1。其中在50 d时体质量下降是由解剖前一夜的空腹处理导致的。相对于高脂组,其他组体质量增长均较缓,但都呈现一个逐渐增长的态势。从图1中可以看出最终体质量由大到小分别为HF组、LCB组、NF组、DPE组、Orlistat组、NDPE组,但由于初始体质量的不同,体质量增长量的大小和最终体质量排序有差异。
2.2 脂肪酶活力变化
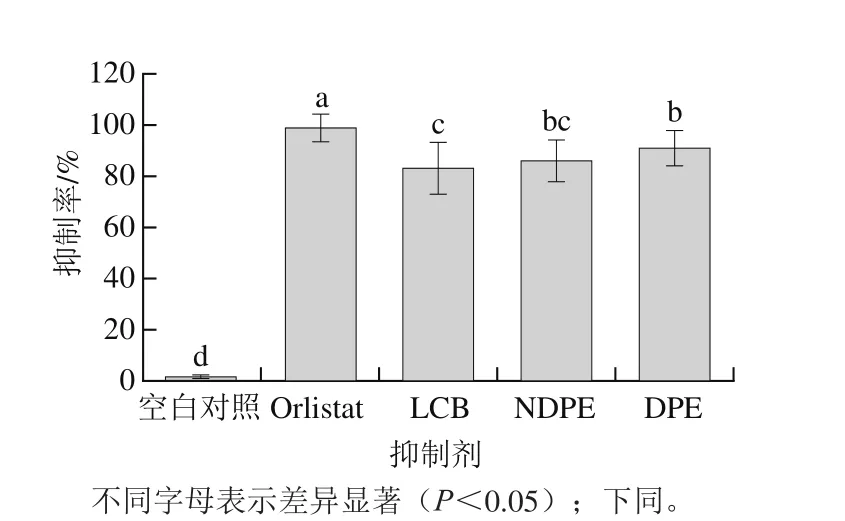
图2 不同抑制剂对胰脂肪酶的抑制率Fig. 2 Inhibition percentage of different inhibitors against pancreatic lipase
如图2所示,由荧光强度计算得到的抑制率显示:空白对照的抑制率为1.5%,基本没有抑制作用;Orlistat的抑制率最大,达到了99.0%,且与其他抑制剂的差异显著;LCB与NDPE差异不显著,分别为83.2%和86.1%,与DPE差异显著;DPE的抑制率为90.9%,与NDPE之间差异不显著。
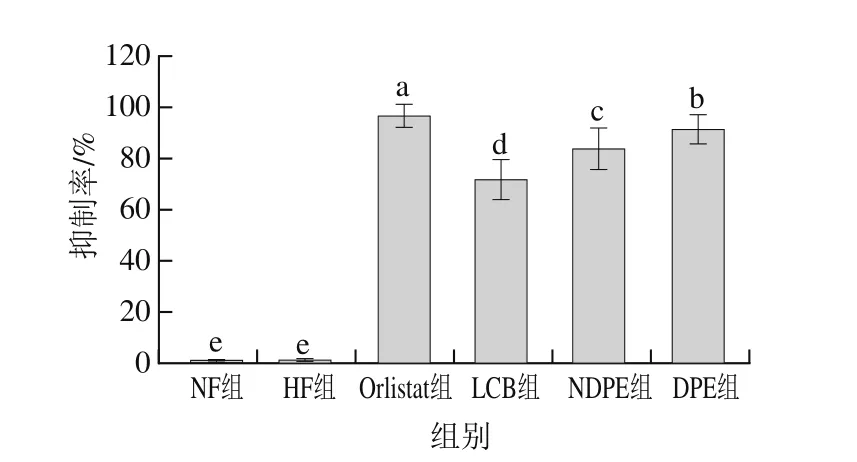
图3 不同抑制剂对SD大鼠小肠胰脂肪酶活性的抑制率Fig. 3 Inhibition percentage of different inhibitors against pancreatic lipase in the small intestine of SD rats
由图3可知,不同干预组之间的差异显著,且干预组与NF组、HF组间差异显著。NF组和HF组的抑制率分别为0.6%和1.0%,基本没有抑制作用,而Orlistat组的抑制率最大,达到了96.5%,其次是DPE组、NDPE组和LCB组,分别为91.4%、83.9%和71.8%。其结果和体外酶活力测定结果相似。
2.3 磷脂酶A1活力变化
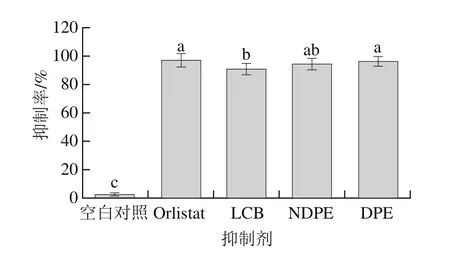
图4 不同抑制剂对磷脂酶A1的抑制率Fig. 4 Inhibition percentage of different inhibitors against phospholipase A1
由图4所示,以消耗的NaOH标准溶液体积计算得到抑制率,不同干预组与空白对照之间差异显著,空白对照的抑制率为2.7%,基本没有抑制效果。Orlistat与LCB的差异显著(分别为97.1%和90.9%),NDPE、DPE的差异不显著(分别为94.5%和96.7%)。LCB与NDPE之间差异不显著,与DPE差异性显著。

图5 不同抑制剂对SD大鼠小肠磷脂酶A1活性的抑制率Fig. 5 Inhibition percentage of different inhibitors against phospholipase A1 in the small intestine of SD rats
由图5可知,不同干预组之间的差异显著,且干预组与NF组、HF组间差异显著。NF组和HF组的抑制率分别为8.6%和2.7%,基本没有抑制作用,而Orlistat组的抑制率最大,达到了97.2%,其次是DPE组、NDPE组和LCB组,分别为87.7%、77.3%和64.4%。其结果和体外酶活力测定结果相似。
2.4 IC50变化
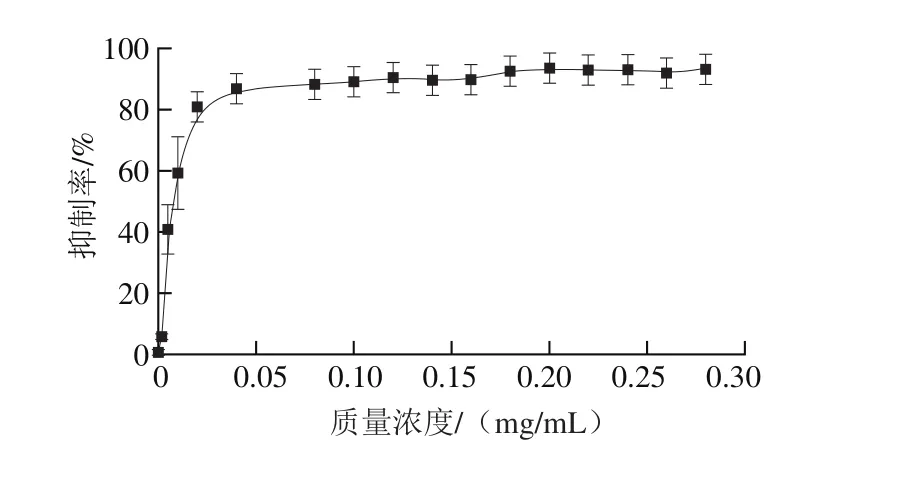
图6 DPE溶液质量浓度对胰脂肪酶活性抑制的影响Fig. 6 Effect of DPE concentration on the activity of pancreatic lipase
设定底物浓度1 mmol/L,DPE溶液对酶促反应的抑制效果以抑制率来表示。由图6可以看出,DPE溶液质量浓度从0 mg/mL到0.05 mg/mL增加时,抑制能力在逐渐增强,在质量浓度达到0.05 mg/mL以后,抑制能力达到最大进而保持不变,得到DPE溶液对胰脂肪酶的IC50为0.01 mg/mL。同样的方法对DPE溶液对磷脂酶A1活性抑制的影响作用作图,如图7所示,可知其IC50为0.06 mg/mL。
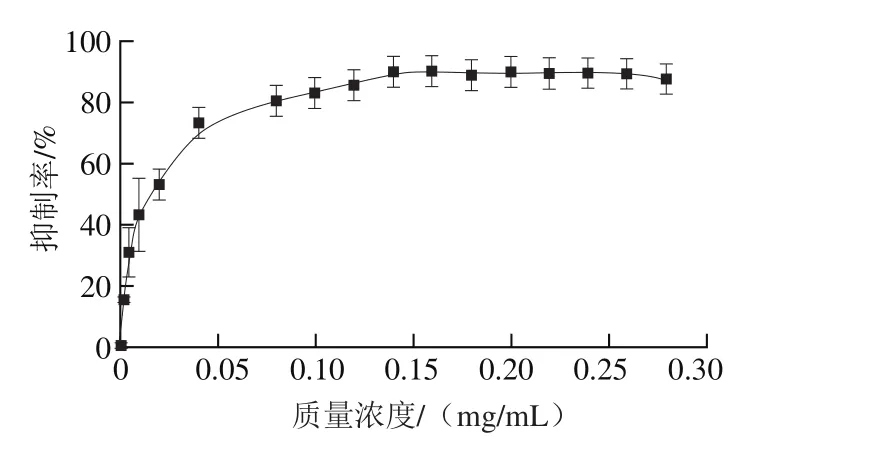
图7 DPE溶液质量浓度对磷脂酶A1活性抑制的影响Fig. 7 Effect of DPE concentration on the activity of phospholipase A1
2.5 抑制类型

图8 DPE对胰脂肪酶反应Dixon图Fig. 8 Dixon plot of the inhibition of DPE against pancreatic lipase
图8显示的是DPE对胰脂肪酶反应的Dixon图,在[S1]为1 mmol/L和[S2]为2 mmol/L情况下所做的散点分别连线相交于第三象限的一点,该点的横坐标为-0.028,即Ki值为0.028 mg/mL,表明DPE与酶的结合很稳定,其抑制作用属于竞争性抑制+反竞争性抑制的混合抑制类型。

图9 DPE对磷脂酶A1反应Dixon图Fig. 9 Dixon plot of the inhibition of DPE against phospholipase A1
图9显示的是DPE对磷脂酶A1反应的Dixon图,在[S1]为1 mmol/L和[S2]为2 mmol/L情况下所做的散点分别连线相交于横坐标左侧一点,该点的横坐标为-0.069,即Ki值为0.069 mg/mL,表明DPE与酶的结合很稳定,其抑制类型属于竞争性抑制。
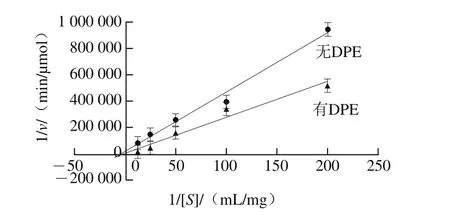
图10 DPE对胰脂肪酶反应Lineweaver-Burk图Fig. 10 Lineweaver-Burk plot of pancreatic lipase inhibition by DPE
如图10所示,无DPE散点图连线与纵坐标的交点为6 812,有DPE散点图连线与纵坐标的交点为3 572,说明其vmax分别为6 812 μmol/min和3 572 μmol/min,而有DPE散点图连线交于横坐标上-4.1,得到Km值为0.25 mg/mL。

图11 DPE对磷脂酶A1反应的Lineweaver-Burk图Fig. 11 Lineweaver-Burk plot of phospholipase A1 inhibition by DPE
如图11所示,无DPE和有DPE散点图连线交于纵坐标上同一点4 871,有DPE散点图连线交于横坐标上-11.1,得到Km值为0.09 mg/mL。
3 结 论
通过对LCB、NDPE、DPE以及Orlistat对胰脂肪酶和磷脂酶A1体外活性的影响做比较,得知DPE具有较好的抑制2 种酶活力的能力,其活性抑制能力稍低于Orlistat,在体外抑制磷脂酶A1的能力上甚至几乎与Orlistat相同。通过对截取SD大鼠小肠进行的肠道酶活力检验发现,杨梅叶原飞燕草素抑制体内胰脂肪酶和磷脂酶A1活性的能力与体外实验表现基本一致。测定了DPE对胰脂肪酶的IC50为0.01 mg/mL,其抑制类型根据Dixon图判断为竞争性抑制+反竞争性抑制的混合抑制类型,根据Lineweaver-Burk图发现vmax与Km值均发生变化,DPE参与反应的Km值为0.25 mg/mL。测定了DPE对磷脂酶A1的IC50为0.06 mg/mL,其抑制类型根据Dixon图判断为竞争性抑制,根据Lineweaver-Burk图发现vmax值不变,DPE参与反应的Km值为0.09 mg/mL。DPE分别通过抑制胰脂肪酶和磷脂酶A1的活性影响脂肪的代谢,抑制能力能够与Orlistat媲美。
[1] 孙丽华, 江月仙, 王巧懿. 天然抗氧化剂原花青素的保健功能及其应用[J]. 食品研究与开发, 2004, 25(2): 109-110. DOI:10.3969/j.issn.1005-6521.2004.02.043.
[2] 石碧, 杜晓. 植物原花色素研究利用进展与发展趋势[J]. 四川大学学报(工程科学版), 2006, 38(5): 16-24. DOI:10.3969/j.issn.1009-3087.2006.05.003.
[3] 陆茵, 孙志广, 赵万洲, 等. 原花青素抗促癌物诱发H2O2释放及脂质过氧化[J]. 中国药理学通报, 2001, 17(5): 562-565. DOI:10.3321/j.issn:1001-1978.2001.05.024.
[4] 屈景年, 曾文良, 陈辉, 等. 葡萄籽原花色素的提取、改性及抗氧化性研究[J]. 衡阳师范学院学报, 2010, 31(3): 48-51. DOI:10.3969/j.issn.1673-0313.2010.03.013.
[5] 钟瑞敏, 张振明, 王羽梅, 等. 杨梅树叶、皮、根部精油成分及其抗氧化活性物质[J]. 林产化学与工业, 2006, 26(1): 1-5. DOI:10.3321/j.issn:0253-2417.2006.01.001.
[6] ADEDAPO A A, JIMOH F O, KODURU S, et al. Antibacterial and antioxidant properties of the methanol extracts of the leaves and stems of Calpurnia aurea[J]. BMC Complementary and Alternative Medicine, 2008, 8: 53. DOI:10.1186/1472-6882-8-53.
[7] GUNARATNE A, WU K, LI D, et al. Antioxidant activity and nutritional quality of traditional red-grained rice varieties containing proanthocyanidins[J]. Food Chemistry, 2013, 138(2/3): 1153-1161.DOI:10.1016/j.foodchem.2012.11.129.
[8] LEE Y A, KIM Y J, CHO E J, et al. Ameliorative effects of proanthocyanidin on oxidative stress and inflammation in streptozotocin-induced diabetic rats[J]. Journal of Agricultural and Food Chemistry, 2007, 55(23): 9395-9400. DOI:10.1021/jf071523u.
[9] 张冰若, 劳业兴, 苏薇薇. 原花青素的研究现状及开发前景[J]. 中药材, 2003, 26(12): 905-908. DOI:10.3321/j.issn:1001-4454.2003.12.026.
[10] 杨玉红, 张慧霞. 葡萄原花青素的生物学活性的简介[J]. 生物学通报, 2008, 43(9): 16-18. DOI:10.3969/j.issn.0006-3193.2008.09.007.
[11] 周素娟. 葡萄籽提取物原花青素的研究概况及其在我国保健食品中的应用[J]. 中国食品卫生杂志, 2007, 19(3): 284-286.DOI:10.3969/j.issn.1004-8456.2007.03.029.
[12] 张华, 曾桥. 原花青素功能及应用进展[J]. 安徽农业科学, 2011,39(9): 5349-5350. DOI:10.3969/j.issn.0517-6611.2011.09.115.
[13] 崔介君, 孙培龙, 马新. 原花青素的研究进展[J]. 食品科技, 2003(2):92-95. DOI:10.3969/j.issn.1005-9989.2003.02.034.
[14] 孙传范. 原花青素的研究进展[J]. 食品与机械, 2010, 26(4): 146-148.DOI:10.3969/j.issn.1003-5788.2010.04.042.
[15] 凌智群, 谢笔钧, 江涛, 等. 莲房原花青素对大鼠实验性心肌缺血的保护作用[J]. 中国药理学通报, 2001, 17(6): 687-690. DOI:10.3321/j.issn:1001-1978.2001.06.024.
[16] 张小郁, 李文广, 高明堂, 等. 葡萄籽中原花青素对心肌细胞的保护作用[J]. 中药药理与临床, 2001, 17(6): 14-16. DOI:10.3969/j.issn.1001-859X.2001.06.008.
[17] TOMARU M, TAKANO H, OSAKABE N, et al. Dietary supplementation with cacao liquor proanthocyanidins prevents elevation of blood glucose levels in diabetic obese mice[J]. Nutrition,2007, 23(4): 351-355. DOI:10.1016/j.nut.2007.01.007.
[18] 赵万洲, 陆茵, 闫新琦, 等. 葡萄籽原花青素抗促癌作用的实验研究[J]. 中草药, 2000, 31(12): 917-920. DOI:10.3321/j.issn:0253-2670.2000.12.023.
[19] DAYCEM K, RABBIAA M S, JALLOUL B, et al. Composition and anti-oxidant, anti-cancer and anti-inflammatory activities of Artemisia herba-alba, Ruta chalpensis L. and Peganum harmala L.[J].Food and Chemical Toxicology, 2013, 55: 202-208. DOI:10.1016/j.fct.2013.01.004.
[20] WU C H, YANG M Y, CHAN K C, et al. Improvement in high-fat diet-induced obesity and body fat accumulation by a nelumbo nucifera leaf flavonoid-rich extract in mice[J]. Journal of Agricultural and Food Chemistry, 2010, 58(11): 7075-7081. DOI:10.1021/jf101415v.
[21] KANAMOTO Y, YAMASHITA Y, NANBA F, et al. A black soybean seed coat extract prevents obesity and glucose intolerance by upregulating uncoupling proteins and down-regulating inflammatory cytokines in high-fat diet-fed mice[J]. Journal of Agricultural and Food Chemistry, 2011, 59(16): 8985-8993. DOI:10.1021/jf201471p.
[22] 黄巧珍, 赵东海, 裘观荣, 等. 杨梅叶总黄酮类化合物抗抑郁活性研究[J]. 时珍国医国药, 2013, 24(1): 49-50. DOI:10.3969/j.issn.1008-0805.2013.01.022.
[23] UCHIDA S, HIRAI K, HATANAKA J, et al. Antinociceptive effects of St. John’s wort, Harpagophytum procumbens extract and grape seed proanthocyanidins extract in mice[J]. Biological & Pharmaceutical Bulletin, 2008, 31(2): 240-245. DOI:10.1248/bpb.31.240.
[24] YANG Haihua, YE Xingqian, LIU Donghong, et al. Characterization of unusual proanthocyanidins in leaves of bayberry (Myrica rubra Sieb. et Zucc.)[J]. Journal of Agricultural and Food Chemistry, 2011,59(5): 1622-1629. DOI:10.1021/jf103918v.
[25] LAI Y F, LAWRENCE J P. Prodelphinidin polymers: definition of structural units[J]. Journal of the Chemical Society, Perkin Transactions 1, 1978(10): 1186-1190. DOI:10.1039/P19780001186.
[26] 周晓舟, 曹玉敏, 孙玉敬, 等. 大孔树脂对杨梅叶原花色素的纯化去糖研究[J]. 离子交换与吸附, 2016, 32(2): 154-163. DOI:10.16026/j.cnki.iea.2016020154.
[27] KOGA K, HISAMURA M, KANETAKA T, et al. Proanthocyanidin oligomers isolated from Salacia reticulata leaves potently inhibit pancreatic lipase activity[J]. Journal of Food Science, 2013, 78(1):105-111. DOI:10.1111/1750-3841.12001.
[28] 郭诤, 张根旺. 脂肪酶的结构特征和化学修饰[J]. 中国油脂, 2003,28(7): 5-7. DOI:10.3321/j.issn:1003-7969.2003.07.001.
[29] 李脉, 杨继国, 杨博. 磷脂酶A1酶活测定方法的研究[J]. 现代食品科技, 2007, 23(8): 80-82. DOI:10.3969/j.issn.1673-9078.2007.08.025.
[30] PARK S H, HUH T L, KIM S Y, et al. Antiobesity effect of Gynostemma pentaphyllum extract (actiponin): a randomized, doubleblind, placebo-controlled trial[J]. Obesity, 2014, 22(1): 63-71.DOI:10.1002/oby.20539.
