野阳合花色苷提取物的抗氧化活性
2018-06-19苟安娜潘新雨柏丁丁黄毅娜
苟安娜,潘新雨,柏丁丁,钟 凯,冉 云,黄毅娜,*,高 鸿
(1.四川大学轻纺与食品学院,四川 成都 610065;2.四川大学华西公共卫生学院,四川 成都 610041)
野阳合(Habenaria ciliolaris Kranzl)又名毛葶玉风花,属于双子叶兰科植物,分布于我国长江流域及以南的湖南、四川等地区,其含蛋白质、糖类、维生素及矿物质等多种营养成分,深受当地居民的青睐。据《新华本草纲要》记载,野阳合具有滋阴补肾、消炎消肿等药用功效,对便秘、糖尿病等的治疗有辅助作用。然而,目前关于野阳合生物活性方面的研究较少。
花色苷是花青素与糖以糖苷键结合而成的一类化合物,是植物中色素最适宜的存在形式[1],具有类黄酮物质的典型结构[2-3]。它不仅能赋予植物色彩[4-5],还是非常有效的天然抗氧化剂[6-8],其清除自由基的能力是VC的20 倍[9]。除此之外,花色苷还具有预防心血管疾病[10]、抗肿瘤[11]、调节血糖血脂[12]、抑菌[13]和抗炎[14]等多种生理功能。因而,花色苷在医疗、食品和化妆品等领域极具应用前景。
近年来,对花色苷的研究主要集中于对富含花色苷植物中花色苷种类的定性定量分析、提取方式的优化以及花色苷生理功能的研究,但常见富含花色苷的蓝莓、黑加仑等植物价格较昂贵,因此含花色苷的平价植物逐渐走进研究视野。野阳合多作为地方野菜,价格低廉,含多种营养成分,其颜色呈紫色,推测其含有花色苷,但目前鲜有对野阳合花色苷的研究。本研究采用酸化乙醇提取野阳合花色苷,测定花色苷含量并定性分析花色苷的组成,测定野阳合花色苷提取物(anthocyanins extract of H. ciliolaris Kranzl,HAE)对2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除能力,通过测定细胞存活率、细胞膜脂质过氧化程度及细胞内活性氧簇(reactive oxygen species,ROS)的水平,研究HAE对过氧化氢(H2O2)诱导的中国仓鼠肺细胞(V79-4细胞)氧化损伤的保护作用,为野阳合的进一步开发利用提供实验数据和理论依据。
1 材料与方法
1.1 材料与试剂
实验所用野阳合采自四川雅安,由四川农业大学徐正君教授鉴定。于-20 ℃冷冻贮藏。
V79-4细胞 中国科学院上海生命科学院细胞资源中心;DMEM(Dulbecco’s modified Eagle medium)细胞培养基 美国Hyclone公司;没食子酸、福林-酚(Folin-Ciocalteu)试剂 成都科龙化工试剂厂;ABTS大连美仑生物技术有限公司;DPPH 上海晶纯生化科技股份有限公司;水溶性VE(Trolox)、噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)、十二烷基硫酸钠、硫代巴比妥酸、2’,7’-二氢二氯荧光黄双乙酸钠(2',7'-dichlorofluorescein diacetate,DCFH-DA) 美国Sigma公司;乙醇、浓盐酸、亚硝酸钠、碳酸钠、醋酸钠、氯化钠、氯化钾、双氧水等(均为分析纯) 成都科龙化工试剂厂。
1.2 仪器与设备
LC-6AD高效液相色谱(high performance liquid chromatography,HPLC)系统 日本岛津公司;色谱柱(SB-C18,250 mm×4.6 mm ,5 μm) 美国安捷伦公司;SPECTRA MAX190酶标仪 美国Molecular Devices公司;LGJ-50F冷冻干燥机 北京松源华兴科技发展有限公司;MCO-15AC细胞培养箱 日本Sanyo公司;TU-1901双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;API 3200电喷雾质谱 德国姆施塔特应用生物系统公司;Varioskan Flash荧光酶标仪美国Thermo公司。
1.3 方法
1.3.1 HAE的制备
挑选野阳合冻果,解冻后除去杂质与叶梗,称取10 g磨碎,采用0.1 mol/L盐酸与无水乙醇(40∶60,V/V)以固液比1∶20(m/V)、浸提温度20 ℃及浸提时间120 min的条件避光提取,溶液过滤并定容至200 mL,得到野阳合花色苷提取液,避光保存,备用。将提取液冷冻干燥后得到HAE,避光保存,备用。
1.3.2 总酚含量的测定
参考文献[15-16]的方法并稍作修改。将1.3.1节中制得的25.0 mg HAE溶于1.0 mL甲醇中,取0.1 mL与7.5%(质量分数,下同)的Na2CO3溶液1.5 mL混合,摇匀。静置2 min后,加入用蒸馏水对倍稀释(V/V)的Folin-Ciocalteu试剂0.9 mL,充分混合后,加入5.0 mL蒸馏水定容,室温避光静置30 min,测定反应液在750 nm波长处的吸光度。以乙醇为空白对照,以没食子酸当量计算野阳合中的总酚含量。回归方程为y=0.000 8x-0.013 3,R2=0.999,其中y为吸光度,x为没食子酸质量浓度/(μg/mL)。
1.3.3 花色苷质量浓度的测定
参考文献[17]的方法,采用双波长pH示差法。取1.3.1节中野阳合花色苷提取液1 mL,分别加入pH 4.5的0.4 mol/L醋酸钠缓冲液或pH 1.0的0.25 mol/L氯化钾缓冲液4.0 mL,摇匀,避光静置120 min,转入1 cm石英比色皿中,以蒸馏水为空白对照,采用紫外-可见分光光度计分别在520 nm和700 nm波长处测定其吸光度。以矢车菊素-3-葡萄糖苷当量表示花色苷质量浓度,并根据式(1)计算野阳合中的花色苷质量浓度。
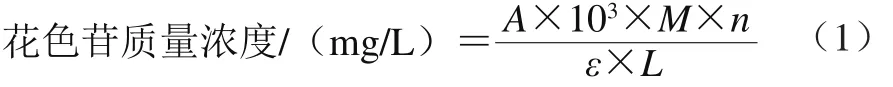
式中:A为最终吸光度,A=(A520nm-A700nm)pH1.0-(A520nm-A700nm)pH4.5;摩尔质量M为449.2 g/mol;摩尔吸光系数ε为26 900 L/(mol·cm);L为比色皿光路长/cm;n为稀释倍数。
1.3.4 HAE组成分析
称取HAE 2.0 mg,溶于1.0 mL乙醇中,过0.22 μm微孔滤膜,得到待测液。参考文献[18]的方法,采用高效液相色谱-质谱联用(high performance liquid chromatographymass spectrometry,HPLC-MS)进行分析。
HPLC条件:SB-C18色谱柱(250 mm×4.6 mm,5 μm);流速1.0 mL/min;柱温30 ℃;检测波长520 nm;进样量20 μL;梯度洗脱:A相:水(5%甲酸),B相:甲醇。洗脱程序:0~2 min,5% B;2~10 min,5%~20% B;10~15 min,20% B;15~30 min,20%~25% B;30~35 min,25% B;35~50 min,25%~33% B;50~55 min,33% B;55~65 min,33%~36% B;65~70 min,36%~45% B;70~75 min,45%~53% B;75~80 min,53%~55% B;80~84 min,55%~70% B;84~88 min,70%~5% B;88~90 min,5% B。
MS分析条件:光电二极管阵列检测器扫描范围为200~800 nm。大气压电喷雾离子源,正离子模式,毛细管电压1.50 kV,锥孔电压50 V,离子源温度105 ℃,脱溶剂气温度420 ℃,锥孔气流量45 L/h,脱溶剂气流量530 L/h。
1.3.5 ABTS+·清除能力测定
参考文献[19-20]的方法,7.00 mmol/L ABTS水溶液和2.45 mmol/L过硫酸钾于室温暗处避光孵育15~18 h,制得ABTS基准液。取适量ABTS基准液,用蒸馏水将其稀释至A734nm为0.700±0.005,制得工作液。
将不同花色苷质量浓度(28.64、14.32、7.16、3.58、1.79 μg/mL)的HAE溶液50 μL与ABTS工作液200 μL混合,充分振荡,室温避光孵育30 min,于波长734 nm处测定吸光度。以VC和Trolox作为阳性对照,按照公式(2)计算ABTS+·的清除率。
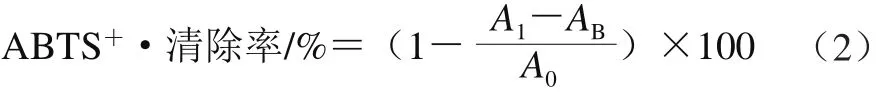
式中:A1表示实验组吸光度;A0表示空白对照组吸光度;AB表示背景吸光度。
1.3.6 DPPH自由基清除能力测定
参考文献[19-20]的方法,采用乙醇溶液作为溶剂,配制浓度为0.2 mmol/L的DPPH自由基溶液,避光保存。
将不同花色苷质量浓度(28.64、14.32、7.16、3.58、1.79 μg/mL)的HAE溶液100 μL与DPPH自由基溶液100 μL混合,充分振荡,室温避光孵育30 min,于波长517 nm处测定吸光度,以VC和Trolox作为阳性对照,按照公式(3)计算DPPH自由基清除率。
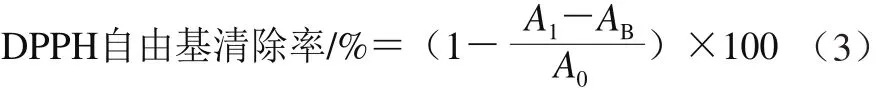
式中:A1表示实验组吸光度;A0表示空白对照组吸光度;AB表示背景吸光度。
1.3.7 细胞培养
选用V79-4细胞,以含10%胎血牛清、100 μg/mL链霉素、100 U/mL青霉素的DMEM培养基于37 ℃、5% CO2的饱和湿度培养箱中培养。传代时小心吹起细胞,并制成单细胞悬液[21]。
1.3.8 HAE对H2O2诱导V79-4细胞氧化损伤的影响
参考文献[22-23]并稍微修改,体外建立H2O2诱导V79-4细胞氧化损伤模型,采用MTT法检测细胞存活率。取处于对数生长期的V79-4细胞,以1.2×105个/mL接种于96 孔板中;培养16 h后,吸出全部原培养液,正常对照组和H2O2损伤组加入培养基,样品处理组分别加入剂量为50、100、200 μg/mL的HAE溶液。处理1 h后,正常对照组加入培养基,H2O2损伤组和样品处理组加入含1 mmol/L H2O2的培养基。在37 ℃下处理20 h后,加入20 μL质量浓度为5 mg/mL的MTT,37 ℃孵育4 h后停止培养,吸出上清液,每孔加入二甲基亚砜,于570 nm波长处测定OD值,计算细胞存活率。每个剂量5 个复孔,重复3 次,另设无细胞空白孔以消除培养基对OD值的影响。
1.3.9 HAE对H2O2诱导V79-4细胞膜脂质过氧化的影响
参考文献[24]并稍微修改,采用硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARS)含量衡量细胞膜脂质过氧化程度。取处于对数生长期的V79-4细胞,以1×105个/mL接种于96孔板中;培养16 h后,吸出全部原培养液,正常对照组和H2O2损伤组加入培养基,样品处理组分别加入剂量为50、100、200 μg/mL的HAE溶液。处理1 h后,正常对照组加入培养基,H2O2损伤组和样品处理组加入含1 mmol/L H2O2的培养基。孵育1 h后,细胞用预冷磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗,均质重悬于预冷的1.15% KCl溶液中。取出100 μL的细胞溶解物,加入8.1%十二烷基硫酸钠0.2 mL、20%冰醋酸(pH 3.5)1.5 mL和0.8%硫代巴比妥酸1.5 mL,用蒸馏水定容至4 mL,95 ℃加热2 h。冷却至室温后,加入正丁醇与吡啶(15∶1,V/V)的混合液5 mL,摇匀。离心10 min后,吸取上清液在532 nm波长处测定OD值,计算TBARS含量。每个剂量5 个复孔,重复3 次,另设无细胞空白孔以消除培养基对OD值的影响。
1.3.10 HAE对胞内ROS的清除能力
参考文献[25],采用荧光探针DCFH-DA检测胞内胞内ROS水平。取处于对数生长期的V79-4细胞,以2×104个/mL接种于96 孔板中;培养16 h后,吸出全部原培养液,H2O2损伤组加入培养基,样品处理组分别加入剂量为50、100、200 μg/mL的HAE溶液。处理30 min后,加入含1 mmol/L H2O2的培养基,在37 ℃下孵育30 min后,加入25 mmol/L的DCFH-DA继续孵育10 min,收集细胞,PBS冲洗2 次,将各组细胞制成细胞悬液。取细胞悬液,使用荧光酶标仪检测荧光强度,激发波长485 nm,发射波长538 nm。以H2O2损伤组荧光强度为100%,其余各组与损伤组相比,计算胞内ROS清除率。每个剂量5 个复孔,重复3 次,另设无细胞空白孔以消除培养基对荧光强度的影响。
1.4 数据统计分析
采用SPSS 13.0软件对数据进行处理,实验结果以表示,两组平均数之间采用t检验,以P<0.05表示差异显著,以P<0.01表示差异极显著。
2 结果与分析
2.1 总酚和花色苷含量
总酚含量通常能够反映物质的潜在生物活性,Folin-Ciocalteu比色法因其方法简便、结果可靠,常被用于多酚含量的测定。本实验中,野阳合多酚的含量为(0.65±0.21)g没食子酸/100 g md。
在不同的pH值条件下,花色苷结构的变化使其色调和色度发生改变:pH值为1.0时,花色苷以红色的2-苯基苯并吡喃的形式存在;pH 4.5时花色苷以无色的甲醇假碱的形式存在[26]。基于此原理并结合朗伯-比尔定律可得出,在这两个不同的pH值下,花色苷结构发生变化,其溶液吸光度的差值与花色苷的含量成比例。本实验中,野阳合花色苷的含量经测定为(81.38±1.45)mg矢车菊素-3-葡萄糖苷/100 g md。
2.2 HAE组成分析
采用HPLC对HAE进行分析,结果见图1。HAE在520 nm波长处的色谱峰有4 个,保留时间分别为25.9、29.7、41.7、45.8 min。

图1 HAE的HPLC色谱图Fig. 1 HPLC chromatogram of anthocyanins extract from H. ciliolaris Kranzl
为鉴定野阳合中花色苷的成分,采用HPLC-MS对该提取物进行定性分析,花色苷单体的质谱碎片离子结果见表1。图1中的峰1、2、3、4对应一级质谱离子质荷比(m/z)分别是449、595、463和609,依据保留时间、离子片段大小和文献[18]的报道,推测这4 种花色苷为矢车菊素-3-半乳糖苷、矢车菊素-3-(6”-香豆酰)葡萄糖苷、芍药色素-3-葡萄糖苷和芍药色素-3-(6”-香豆酰)葡萄糖苷。

表1 HAE的组成Table 1 Identification of anthocyanins compositions from H. ciliolaris Kranzl
2.3 HAE清除自由基的能力
2.3.1 ABTS+·清除能力
ABTS法被广泛用于体外抗氧化活性的测定。在反应体系中,ABTS氧化后生成稳定的蓝绿色阳离子自由基,与自由基清除剂发生反应使反应体系褪色,褪色程度能够反映自由基清除剂清除ABTS+·能力的强弱[27]。
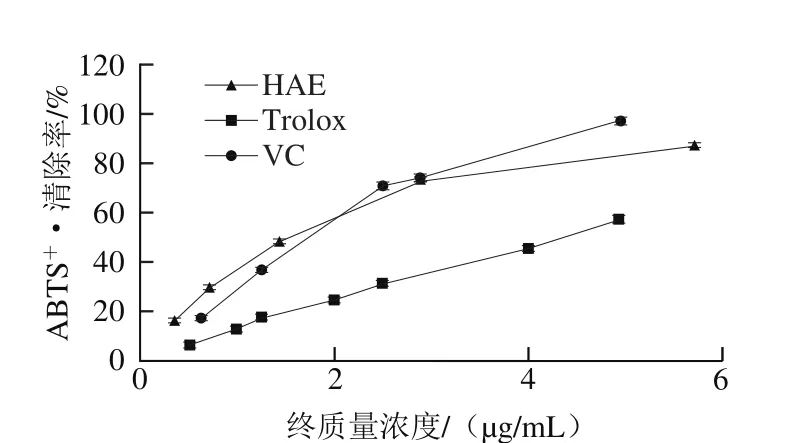
图2 HAE清除ABTS·的能力Fig. 2 ABTS radical scavenging capacity of anthocyanins extract from H. ciliolaris Kranzl
由图2可知,在0~6.0 μg/mL范围内,HAE和两种阳性对照对ABTS+·的清除率随质量浓度的增加而增大,且呈剂量依赖关系。VC、Trolox和HAE清除ABTS+·的半抑制浓度(half maximal inhibitory concentration,IC50)分别为(1.76±0.21)、(4.32±0.35)μg/mL和(1.72±0.26)μg/mL,表明HAE对ABTS+·的清除能力与VC相当,优于Trolox。
2.3.2 DPPH自由基清除能力
DPPH是目前使用最为广泛的自由基试剂之一。DPPH自由基在有机溶剂中是一种稳定的自由基,当加入自由基清除剂时,深紫色的DPPH自由基被还原成黄色的DPPH-H非自由基形式,褪色程度能够反映自由基清除剂清除DPPH自由基能力的强弱[27]。

图3 HAE清除DPPH自由基的能力Fig. 3 DPPH radical scavenging capacity of anthocyanins extract from H. ciliolaris Kranzl
由图3可知,在0~7.0 μg/mL范围内,HAE和两种阳性对照对DPPH自由基的清除率随质量浓度的增加而增大,且呈剂量依赖关系。VC、Trolox和HAE清除DPPH自由基的IC50分别为(1.78±0.38)、(3.69±0.52)μg/mL和(0.74±0.24)μg/mL,表明HAE对DPPH自由基的清除能力优于VC和Trolox。
2.4 HAE对H2O2诱导V79-4细胞氧化损伤的保护作用
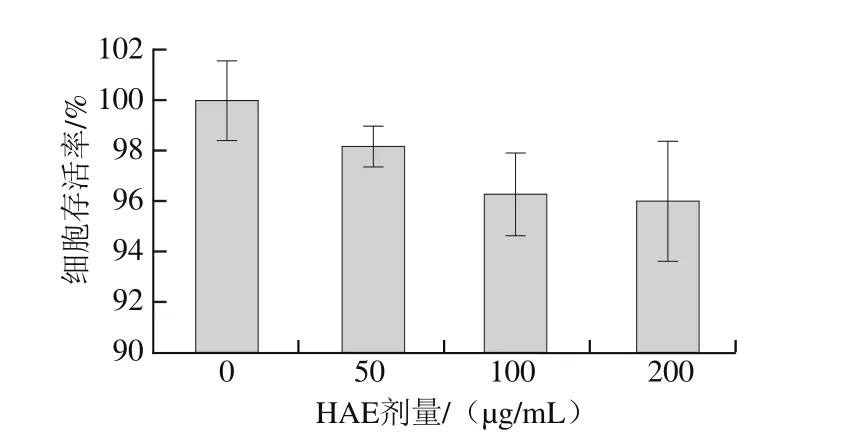
图4 HAE对V79-4细胞存活率的影响Fig. 4 Cell viability of V79-4 cells after treatment with anthocyanins extract from H. ciliolaris Kranzl
如图4所示,正常对照组未受到H2O2诱导氧化损伤和样品处理,细胞存活率为100%。V79-4细胞经不同剂量(50、100、200 μg/mL)的HAE溶液处理后,细胞存活率分别为(98.2±0.8)%、(96.3±1.6)%、(96.0±2.4)%,表明HAE溶液对细胞没有显著性的损伤作用。因此,实验中选用50~200 μg/mL的HAE用于后续抑制H2O2诱导V79-4细胞氧化损伤的实验。

图5 HAE对H2O2诱导V79-4细胞氧化损伤的保护作用Fig. 5 Protection of anthocyanins extract from H. ciliolaris Kranzl against H2O2-induced oxidative damage in V79-4 cells
由图5可知,损伤组细胞受到H2O2诱导的氧化损伤,部分细胞生长受阻或凋亡,细胞存活率下降至(51.6±2.1)%。经不同剂量(50、100、200 μg/mL)HAE溶液预处理后,各实验组V79-4细胞存活率分别为(58.7±0.7)%、(68.2±1.2)%、(88.2±1.1)%。同H2O2损伤组相比,经不同剂量HAE样品预处理,V79-4细胞对H2O2诱导的氧化损伤抵抗力逐渐增强,细胞存活率逐渐升高。
2.5 HAE对H2O2诱导V79-4细胞膜脂质过氧化的影响
TBARS是氧化的脂质生成的丙二醛及其他一些醛酮类物质与硫代巴比妥酸作用生成的有色化合物,该有色化合物在532 nm波长处有吸收。因此,可通过测定醛酮类物质的含量来评价脂质过氧化程度[28-29]。

图6 HAE对H2O2诱导V79-4脂质过氧化的抑制作用Fig. 6 Inhibitory effect of anthocyanins extract from H. ciliolaris Kranzl on H2O2-induced lipid peroxidation in V79-4 cells
由图6可知,正常对照组的TBARS含量为(1.7±0.2)μmol/mg,H2O2损伤组的TBARS含量为(3.8±0.3)μmol/mg,表明H2O2可诱导V79-4细胞膜发生脂质过氧化反应。经不同剂量(50、100、200 μg/mL)HAE溶液处理后,各实验组TBARS含量分别为(2.9±0.7)、(2.5±0.1)μmol/mg和(2.0±0.2)μmol/mg。同H2O2损伤组相比,预先加入50~200 μg/mL HAE可抑制H2O2诱导的细胞膜脂质过氧化,且呈剂量依赖性。
2.6 HAE对H2O2诱导V79-4细胞内ROS水平的影响
DCFH-DA进入细胞后,被水解生成二氯二氢荧光素,二氯二氢荧光素可与胞内的ROS反应生成具有荧光的二氯荧光素,故二氯荧光素荧光强度可反应细胞内ROS水平[30-31]。正常组细胞内ROS水平较低,荧光强度较弱,H2O2损伤组细胞内ROS水平显著增加。由图7可知,经不同剂量(50、100、200 μg/mL)HAE溶液处理后,实验组V79-4细胞内ROS清除率分别为(40.2±1.7)%、(62.2±2.0)%、(82.4±1.2)%,且清除率随剂量增加呈增高趋势。
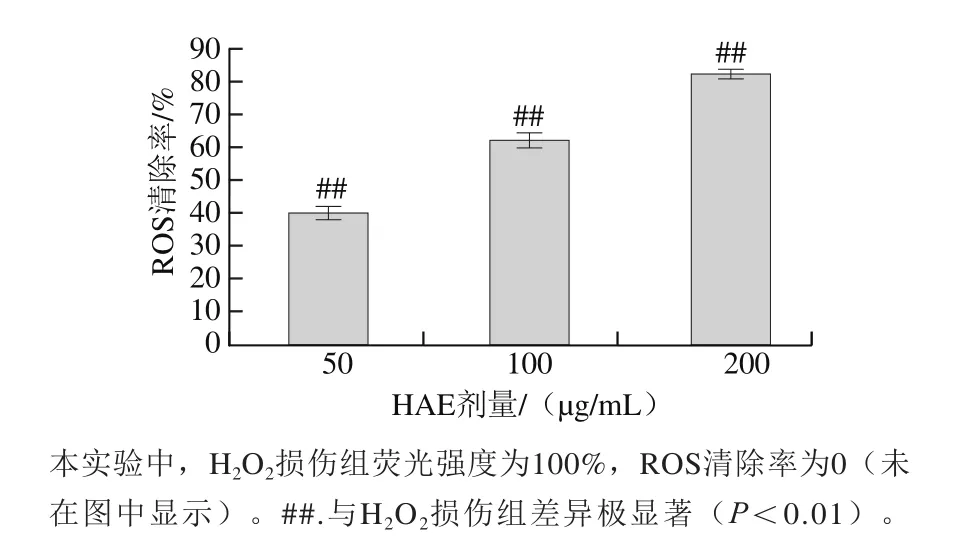
图7 HAE对H2O2处理的V79-4细胞内ROS清除率的影响Fig. 7 Effect of anthocyanins extract from H. ciliolaris Kranzl on ROS levels in H2O2-induced V79-4 cells
3 结 论
本实验中,采用pH示差法测得野阳合花色苷的含量为(81.38±1.45) mg矢车菊素-3-葡萄糖苷/100 g md;采用HPLC-MS分析,发现HAE中含有4 种花色苷,推测为矢车菊素-3-半乳糖苷、矢车菊素-3-(6”-香豆酰)葡萄糖苷、芍药色素-3-葡萄糖苷和芍药色素-3-(6”-香豆酰)葡萄糖苷。
体外自由基清除实验结果表明,HAE具有良好的自由基清除能力,在实验范围内,随着质量浓度增大,HAE清除ABTS+·和DPPH自由基的能力增强。HAE清除ABTS+·的IC50为(1.72±0.26)μg/mL,清除能力与VC相当;HAE清除DPPH自由基的IC50为(0.74±0.24)μg/mL,清除能力优于VC。张杨等[32]报道蓝莓果实含11 种花色苷,其清除ABTS+·和DPPH自由基能力均明显优于VC;Hao Jie等[33]报道黑米含9 种花色苷,其清除ABTS+·和DPPH自由基能力与VC相当。综上,花色苷自由基清除能力不同,推测可能与花色苷的含量、羟基化程度、酰基和糖苷类型有关[6]。
选用H2O2诱导V79-4细胞建立氧化损伤模型,进一步对HAE抗氧化活性进行研究。实验表明,经H2O2处理的V79-4细胞会发生显著的氧化损伤及脂质过氧化。50~200 μg/mL的HAE对H2O2诱导V79-4细胞氧化损伤具有较为明显的保护作用,明显抑制细胞膜脂质过氧化,降低损伤后胞内ROS水平,且呈剂量依赖关系。罗春丽等[34]报道,100~800 μg/mL紫薯花青素对H2O2诱导的HepG2细胞损伤具有较为明显的保护作用;徐丽萍等[35]报道,1~10 μmol/L蓝莓花青素氯化锦葵色素可明显降低细胞内ROS水平,保护血管内皮细胞免受损伤。本研究与以上文献的实验体系存在差异,不能定量分析活性强弱,但均在细胞水平上定性探究了花色苷的抗氧化活性,为深入研究花色苷如何调控细胞凋亡蛋白酶家族蛋白以及对超氧化物歧化酶、谷胱甘肽过氧化物酶等体内抗氧化酶活性的影响提供实验数据和理论依据。
[1] 吴杰, 郑影, 谷思云, 等. 笃斯越橘产品花色苷抗氧化活性评价[J]. 食品工业科技, 2012, 33(22): 181-185. DOI:10.13386/j.issn1002-0306.2012.22.054.
[2] 胡济美, 籍保平, 周峰, 等. 大兴安岭笃斯越橘花色苷成分鉴定研究[J]. 食品科学, 2009, 30(10): 239-241. DOI:10.3321/j.issn:1002-6630.2009.10.056.
[3] CĂTA A, STEFĂNUT M N, POP R, et al. Evaluation of antioxidant activities of some small fruits containing anthocyanins using electrochemical and chemical methods[J]. Croatica Chemica Acta,2016, 89(1): 37-48. DOI:10.5562/cca2656.
[4] JULIA M B, PURIFICACIÓN S P, FERNANDO R E, et al. Analysis and antioxidant capacity of anthocyanin pigments. part II: chemical structure, color, and intake of anthocyanins[J]. Critical Reviews in Analytical Chemistry, 2012, 42(2): 126-151. DOI:10.1080/10408347.2011.632314.
[5] ONSLOW M W. The anthocyanin pigments of plants[M]. Cambridge:Cambridge University Press, 2014: 1-324.
[6] 肖继坪, 杨晓艳, 郭华春. 彩色马铃薯“剑川红”和“转心乌”花色苷的抗氧化分析[J]. 食品科学, 2016, 37(13): 13-18. DOI:10.7506/spkx1002-6630-201613003.
[7] 郭晓倩, 房子舒, 刘凤娇, 等. 东北野生蓝莓花色苷组分分析及其抗氧化性比较[J]. 现代食品科技, 2016, 32(3): 313-320. DOI:10.13982/j.mfst.1673-9078.2016.3.048.
[8] CUI C, ZHANG S, YOU L, et al. Antioxidant capacity of anthocyanins from Rhodomyrtus tomentosa (Ait.) and identification of the major anthocyanins[J]. Food Chemistry, 2013, 139(1/2/3/4): 1-8.DOI:10.1016/j.foodchem.2013.01.107.
[9] 杨大毅. 紫薯发酵酒的生产工艺[J]. 酿酒, 2011, 38(1): 77-78.DOI:10.3969/j.issn.1002-8110.2011.01.028.
[10] DE PASCUAL-TERESA S. Molecular mechanisms involved in the cardiovascular and neuroprotective effects of anthocyanins[J].Archives of Biochemistry & Biophysics, 2014, 559(5): 68-74.DOI:10.1016/j.abb.2014.04.012.
[11] SMERIGLIO A, BARRECA D, BELLOCCO E, et al. Chemistry,pharmacology and health benefits of anthocyanins[J]. Phytotherapy Research, 2016, 30(8): 1265-1286. DOI:10.1002/ptr.5642.
[12] CASTANEDA-OVANDO A, DE LOURDES PACHECOHERNÁNDEZ M, PÁEZ-HERNÁNDEZ M E, et al. Chemical studies of anthocyanins: a review[J]. Food Chemistry, 2009, 113(4): 859-871.DOI:10.1016/j.foodchem.2008.09.001.
[13] 刘咪, 张伟松, 何财安, 等. 葡萄皮花色苷对几种常见食源性致病菌的抑制作用[J]. 中国食品学报, 2014, 14(11): 70-75. DOI:10.16429/j.1009-7848.2014.11.003.
[14] KASPAR K L, PARK J S, BROWN C R, et al. Pigmented potato consumption alters oxidative stress and inflammatory damage in men[J]. The Journal of Nutrition, 2011, 141(1): 108-111. DOI:10.3945/jn.110.128074.
[15] IVA R, MOJCA Š, ŽELJKO K, et al. Phenolic content and antioxidant potential of macerated white wines[J]. European Food Research and Technology, 2011, 233(3): 465-472. DOI:10.1007/s00217-011-1535-4.
[16] 李斌, 雷月, 孟宪军, 等. 响应面试验优化超声波辅助提取蓝靛果多酚工艺及其抗氧化活性研究[J]. 食品科学, 2015, 36(22): 33-39.DOI:10.7506/spkx1002-6630-201522006.
[17] 宋德群, 孟宪军, 王晨阳, 等. 蓝莓花色苷的pH示差法测定[J].沈阳农业大学学报, 2013, 44(2): 231-233. DOI:10.3969/j.issn.1000-1700.2013.02.019.
[18] WU X, PRIOR R L. Systematic identification and characterization of anthocyanins by HPLC-ESI-MS/MS in common foods in the United States: fruits and berries[J]. Journal of Agricultural and Food Chemistry, 2005, 53(7): 2589-2599. DOI:10.1021/jf048068b.
[19] LIANG L, WU X, ZHAO T, et al. In vitro, bioaccessibility and antioxidant activity of anthocyanins from mulberry (Morus atropurpurea Roxb.) following simulated gastro-intestinal digestion[J].Food Research International, 2012, 46(1): 76-82. DOI:10.1016/j.foodres.2011.11.024.
[20] 王健, 潘利华. 蓝莓花青素的抗氧化活性研究[J]. 安徽农业科学,2013, 41(12): 5487-5489. DOI:10.3969/j.issn.0517-6611.2013.12.110.
[21] LI D, ELLIS E M. 4-Hydroxynonenal induces an increase in expression of Receptor for Activating C Kinase 1 (RACK1) in Chinese hamster V79-4 lung cells[J]. Chemico-Biological Interactions, 2014,213(17): 13-20. DOI:10.1016/j.cbi.2014.01.020.
[22] SAFAEIAN L, SAJJADI S E, JAVANMARD S H, et al. Protective effect of Melissa officinalis extract against H2O2-induced oxidative stress in human vascular endothelial cells[J]. Research in Pharmaceutical Sciences, 2016, 11(5): 383-389. DOI:10.4103/1735-5362.192488.
[23] 高蒙蒙, 孙桂波, 斯建勇, 等. 红车轴草总黄酮对H2O2诱导的血管内皮细胞损伤的保护作用[J]. 中国药理学通报, 2013, 29(2): 201-207.DOI:10.3969/j.issn.1001-1978.2013.02.13.
[24] SABUNCUOGLU S, ORHAN H. Interference of metals and medications with the detection of lipid peroxidation in humans by photometric TBARS assay[J]. Current Analytical Chemistry, 2013,9(3): 457-462. DOI:10.2174/1573411011309030015.
[25] PIAO M J, KANG K A, ZHANG R, et al. Antioxidant properties of 1,2,3,4,6-penta-O-galloyl-β-D-glucose from Elaeocarpus sylvestris var. ellipticus[J]. Food Chemistry, 2009, 115(2): 412-418.DOI:10.1016/j.foodchem.2008.12.020.
[26] 李建伟. pH示差法测定山楂中花青素的含量[J]. 长治医学院学报,2015, 29(3): 177-179. DOI:10.3969/j.issn.1006-0588.2015.03.006.
[27] MARTYSIAK-ŻUROWSKA D, WENTA W. A comparison of ABTS and DPPH methods for assessing the total antioxidant capacity of human milk[J]. Acta Scientiarum Polonorum Technologia Alimentaria,2012, 11(1): 83-89.
[28] MONSERRAT J M, SEIXAS A L R, FERREIRA-CRAVO M, et al.Interference of single walled carbon nanotubes (SWCNT) in the measurement of lipid peroxidation in aquatic organisms through TBARS assay[J]. Ecotoxicology & Environmental Safety, 2017,140(2): 103-108. DOI:10.1016/j.ecoenv.2017.02.034.
[29] 李兴泰, 杜春雨, 刘雨晴, 等. 党红饮体外保护线粒体功能评价[J].食品科学, 2011, 32(19): 273-278.
[30] ZHAO C, FENG B, CAO Y, et al. Identification and characterisation of ROS modulator 1 in Lampetra japonica[J]. Fish & Shellfish Immunology, 2013, 35(2): 278-283. DOI:10.1016/j.fsi.2013.04.039.
[31] 余梦瑶, 许晓燕, 魏巍, 等. 炭角菌菌丝体乙醇提取物对H2O2所致PC12细胞损伤的保护作用[J]. 食用菌学报, 2014, 21(4): 49-52.DOI:10.3969/j.issn.1005-9873.2014.04.014.
[32] 张杨, 谢笔钧, 孙智达. 蓝莓酒渣、果、酒中花色苷成分鉴定及酒渣与果中花色苷抗氧化活性比较[J]. 食品科学, 2016, 37(2): 165-171. DOI:10.7506/spkx1002-6630-201602029.
[33] HAO Jie, ZHU Hui, ZHANG Zhenqing, et al. Identification of anthocyanins in black rice (Oryza sativa L.) by UPLC/Q-TOF-MS and their in vitro and in vivo antioxidant activities[J]. Journal of Cereal Science, 2015, 64(7): 92-99. DOI:10.1016/j.jcs.2015.05.003.
[34] 罗春丽, 王林, 李杏, 等. 紫薯花青素体外抗氧化及对H2O2诱导HepG2细胞氧化损伤的保护作用[J]. 食品科学, 2015, 36(17): 225-230. DOI:10.7506/spkx1002-6630-201517042.
[35] 徐丽萍, 付琳, 黄午阳, 等. 蓝莓花青素氯化锦葵色素在人脐静脉内皮细胞中的抗氧化作用[J]. 食品科学, 2015, 36(21): 233-237.DOI:10.7506/spkx1002-6630-201521043.
