杀菌温度对乳化肠中脂肪酸组成和脂肪氧化的影响
2018-06-19周慧敏潘晓倩陈文华张顺亮
周慧敏,赵 燕,任 双,李 素,赵 冰,潘晓倩,陈文华,曲 超,张顺亮*
(中国肉类食品综合研究中心,国家肉类加工工程技术研究中心,肉类加工技术北京市重点实验室,北京 100068)
乳化肠是将原料肉经斩碎、乳化等工艺加工而成的肉糜制品,由于其便于携带和营养美味的特点,在肉制品市场上占有率较高。近年来研究者多致力于不同辅料及食品添加剂改善乳化肠的色泽、风味、质构等品质的研究,取得了较多的成果[1-7]。目前在食品工业中应用最广泛最有效的仍然是热杀菌技术,其可以抑制或杀灭微生物,从而达到改善产品品质、延长贮藏期、保证其安全的目的。根据杀菌温度的不同[8-9],可将肉制品分为高温肉制品(115~121 ℃)、中温肉制品(90~110 ℃)和低温肉制品(72~85 ℃)。杀菌温度对肉制品的品质有较大影响,低温杀菌可保持产品良好的营养、风味和质构特性,但产品的保质期较短,同时需要全程冷链,流通成本高;高温杀菌货架期长,但产品的营养和风味损失较大[8-10]。关于热杀菌对乳化肠品质方面的影响研究,已有较多报道,如艾婷等[8]研究80~121 ℃不同杀菌条件对乳化香肠风味物质的变化规律;潘晓倩等[11]从中温乳化香肠中分离鉴定出一株优势腐败菌并分析生物学特性;赵冰等[12]研究杀菌温度对乳化香肠蛋白质变化的影响,发现低于100 ℃的杀菌条件下,乳化肠质构保持良好,高于100 ℃的杀菌温度对产品的质构破坏明显。
脂肪酸作为肉制品的主要成分之一,其组成及配比是决定产品食用品质、营养价值、风味及氧化稳定性的重要因素[13-14],一直是肉制品行业关注的热点。如黄业传等[15]研究不同加工方式与时间对猪肉脂肪含量和脂肪酸组成的影响;顾伟钢等[16]研究红烧肉制作过程中脂肪氧化和脂肪酸组成的变化;王瑞花等[17]研究烹制方式对猪肉肌内脂肪脂质氧化及脂肪酸组成的影响;Lin等[18]研究食鱼油对法兰克福香肠的脂肪酸成分和脂质氧化的影响;李莹莹等[19]研究蒸煮温度和时间对猪背脂中脂肪酸组成比例关系的影响。以上研究均表明,不同的加工条件会带来脂肪酸组成、配比及氧化稳定性的改变。热加工是乳化肠加工的重要环节,而目前对于不同的热杀菌条件对乳化肠中脂肪酸变化规律的研究鲜见相关报道。
本实验对比不同杀菌温度对乳化肠中各脂肪酸、饱和脂肪酸(saturated fatty acid,SFA)、不饱和脂肪酸(unsaturated fatty acid,UFA)、单不饱和脂肪酸(monounsaturated fatty acid,MUFA)和多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)组成的影响,同时分析脂肪氧化的变化规律,以期为乳化肠工业化的精细调控提供技术支持。
1 材料与方法
1.1 材料与试剂
猪后腿肉(4号肉)和猪背脂 北京市第五肉类联合加工厂;乳化肠加工用辅料(食盐、白砂糖、香辛料、大豆蛋白、玉米淀粉等) 中国肉类食品综合研究中心香辛料部;C4~C2437 种脂肪酸甲酯混合标准品、15%三氟化硼甲醇溶液 美国Sigma-Aldrich公司;正己烷(色谱纯) 德国默克公司;三氯甲烷、甲醇、氢氧化钠(均为分析纯) 北京化工厂。
1.2 仪器与设备
WH82绞肉机、D73434斩拌机 德国赛德曼机械制造公司;OSCAR 20真空灌肠机 德国海因里希弗雷机械制造有限公司;杀菌釜 诸城中泰机械有限公司;SU506手动U型打卡机 衡水鸿昊企业有限责任公司;TRACE1310气相色谱-TSQ8000质谱仪、TG-Wax MS气相色谱毛细管柱(30 m×0.25 mm,0.25 μm) 美国Thermo Scientific(中国)有限公司。
1.3 方法
1.3.1 乳化肠的制备
乳化肠的制备参考文献[8]进行。
配方:瘦肉80%、背脂20%;辅料(原料肉质量分数,下同):冰水35%、马铃薯淀粉5%、食盐2.2%、大豆分离蛋白2%、白糖1.5%、卡拉胶1%、葡萄糖0.9%、磷酸盐0.3%、味精0.2%、白胡椒粉0.2%、异抗坏血酸钠0.1%、红曲红0.1%、姜粉0.1%、肉豆蔻粉0.1%、亚硝酸钠0.006%。肠衣为2 cm的塑料肠衣。
加工步骤:原料肉剔除可见筋膜→瘦肉和肥肉分别绞成肉馅→加入食盐和磷酸盐混合均匀后在4 ℃条件下腌制16 h→和其他辅料共同斩拌→灌装→打卡→热杀菌→冷却→成品。
根据目前工业化的实际情况以及文献[8,11]的相关报道,本实验选择的热杀菌温度分别为:85、90、95、100、105、110 ℃和121 ℃,杀菌时间均为20 min;乳化肠熟化时间以产品中心温度达到蛋白的变性温度同时维持10 min以上,根据前期的工艺条件摸索,20 min的杀菌温度即可满足。
1.3.2 脂肪的提取
参考Folch等[20]的方法进行脂肪的提取,精确称取10 g绞碎的样品于250 mL碘量瓶中,加入10倍体积的氯仿-甲醇混合溶液(2∶1,V/V),45 ℃恒温振荡2 h后过滤,加入约0.2 倍体积的盐水振荡混匀,3 000 r/min离心15 min去除上层的水溶液,将下层提取液移入烧瓶,在45 ℃水浴中进行真空旋转蒸发浓缩至干,得到纯品脂肪,-20 ℃贮藏备用。
1.3.3 脂肪的皂化和脂肪酸的甲酯化
参考GB 5009.168—2016《食品中脂肪酸的测定》[21]的方法,取150 mg脂肪提取物,加入质量分数2%氢氧化钠-甲醇溶液4 mL,连接回流冷凝器,(90±1)℃水浴条件回流,直至油滴消失。从回流冷凝器上端加入5 mL质量分数15%三氟化硼甲醇溶液,在(80±1)℃水浴条件下继续回流2 min。用少量水冲洗回流冷凝器。停止加热,从水浴装置上取下烧瓶,迅速冷却至室温。准确加入15 mL正己烷,振摇2 min,再加入饱和氯化钠水溶液,静置分层。吸取上层正己烷提取溶液大约5 mL,至25 mL试管中,加入3~5 g无水硫酸钠,振摇1 min,静置5 min,吸取上层溶液到进样瓶中稀释后待测定。
1.3.4 脂肪酸的定性定量分析
参考张顺亮等[22]的方法,采用气相色谱-质谱联用技术进行脂肪酸的定性和定量确定。
气相色谱条件:TG-wax极性柱(30 m×0.25 mm,0.25 μm);高纯氦气(纯度>99.99%)作为载气;流速1.0 mL/min;分流模式100∶1;进样口温度230 ℃;程序升温程序为:柱温起始45 ℃保持3 min,以15 ℃/min升温到165 ℃,保持0 min,再以2 ℃/min升到230 ℃保持2 min。质谱条件:传输线温度230 ℃,电子能量70 eV,EI离子源,离子源温度260 ℃,溶剂延迟6 min;采用全扫描模式,质量扫描范围设定为m/z 40~600。
定性方法采用与标准品的保留时间比对和NIST、Willey谱库检索;定量方法采用外标法以色谱峰面积计算各脂肪酸的含量,单位以g/100 g脂肪表示。
1.3.5 脂肪氧化测定
过氧化值(peroxide value,POV)的测定[23]:称取100 g绞碎试样于500 mL具塞三角瓶中,加1~2 倍乙醚(30~60 ℃沸程)振荡60 min后,放置过夜,过滤后减压蒸馏得到油脂,得到的油脂根据GB/T 5009.227—2016《食品中过氧化值的测定》中的滴定法测定。
硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)含量的测定:根据GB/T 5009.181—2016《食品中丙二醛的测定》[24]的分光光度法测定。
1.4 数据统计分析
数据采用SPSS 17.0统计软件进行单因素方差分析(One-way analysis of variance)和邓肯氏多重差异显著性(Duncan’s multiple-range test)分析,P<0.05表示差异显著,P<0.01表示差异极显著;采用Pearson相关系数和双侧检验分析不同脂肪酸含量之间的相关性;所有实验结果以表示。
2 结果与分析
2.1 杀菌温度对乳化肠中不同脂肪酸组成的影响
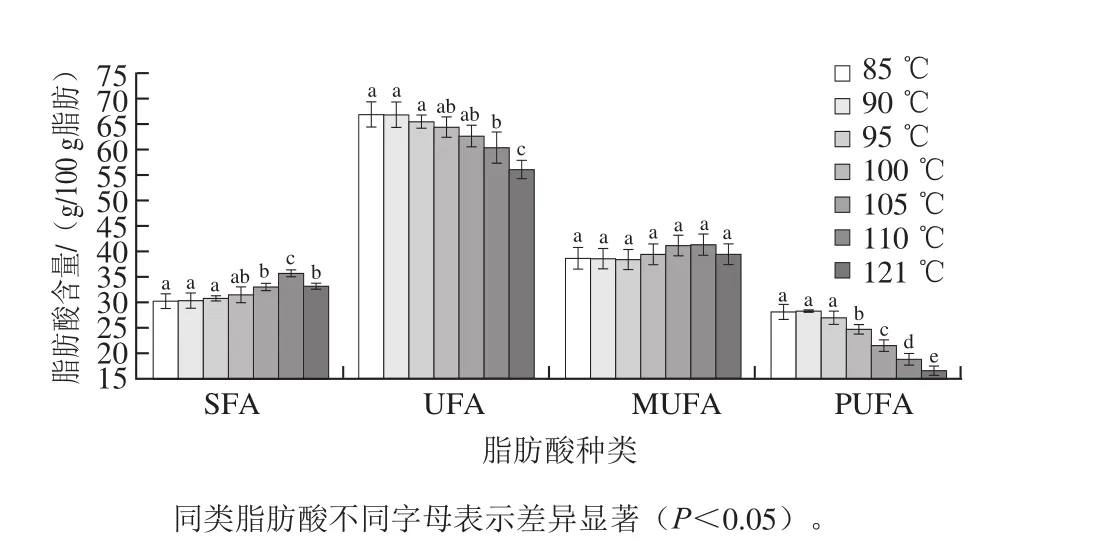
图1 杀菌温度对乳化肠中不同种类脂肪酸含量的影响Fig. 1 Effect of sterilization temperature on contents of all fatty acids classes in emulsified sausages
如图1所示,杀菌温度对SFA和UFA的含量影响均显著(P<0.05),对PUFA的影响极显著(P<0.01),而MUFA的变化不显著(P>0.05)。当热杀菌温度从85 ℃升到121 ℃时,样品中SFA含量呈先逐渐增加后降低的变化趋势,当达到110 ℃时,含量最大(35.67 g/100 g脂肪),比85 ℃杀菌组中SFA含量提高了18.03%,温度升到121 ℃时,SFA含量较110 ℃处理组下降7.04%(P<0.05),但仍比85 ℃杀菌组高9.72%(P<0.05)。研究表明,SFA十分稳定,不与空气、氧化剂发生任何化学反应,而121 ℃的热杀菌组中SFA含量降低的原因可能是高温下蛋白结构水解过度,产品质构软化,亲油能力大幅降低,出油严重所致[12,15]。当热杀菌温度范围为105~121 ℃,SFA的含量显著高于低温(85 ℃)杀菌处理组(P<0.05),而85~100 ℃处理组中SFA的总含量差异不显著(P>0.05),这一结果同李莹莹等[19]采用70~100 ℃蒸煮温度处理后猪背脂中SFA的含量变化不显著一致。
对于UFA,随杀菌温度(85~121 ℃)的升高,含量呈逐渐降低的趋势。85~105 ℃处理后,UFA的含量差异不显著(P>0.05),而110~121 ℃处理后,样品UFA的含量显著低于85 ℃处理组(P<0.05)。当热杀菌温度达到121 ℃时,含量达到最低(56.04 g/100 g脂肪),比85 ℃处理组中UFA含量降低了16.18%(P<0.05)。随着温度的升高,MUFA的含量变化和SFA一致,呈逐渐升高后降低的趋势,在110 ℃时,MUFA的含量最高(41.34 g/100 g脂肪),当热杀菌温度达到121 ℃时,MUFA的含量不显著降低(P>0.05)。在低于100 ℃的热杀菌温度范围内,随着温度的升高MUFA含量呈升高趋势,这可能由于PUFA转化成MUFA的速率大于MUFA进一步转化成SFA的速率[25]。对于PUFA,当热杀菌温度为85~95 ℃时,PUFA的总含量随着杀菌温度的升高而降低(P>0.05),随后的杀菌温度范围(100~121 ℃)内,每升高5 ℃,PUFA的含量极显著下降(P<0.01),下降速率分别为8.23%、12.98%、12.17%、12.53%。由此可知,高于100 ℃的杀菌温度对产品的PUFA破坏明显,UFA总含量的变化主要受PUFA的影响。
综上,高于100 ℃热杀菌温度对乳化香肠的脂肪酸组成影响显著,SFA含量明显上升,UFA和PUFA含量显著降低。黄业传等[15]也得到相似的结论,研究发现猪肉经蒸煮和烤制后,产品中SFA含量明显上升,而C18:2、C20:4及PUFA的含量有明显的下降。
2.2 杀菌温度对乳化香肠中SFA组成的影响
临床研究和动物实验表明,长链SFA摄入量过多会增加患动脉粥样硬化和冠心病的风险[26]。乳化肠中共检测出8 种SFA,结果如图2所示,按其含量高低排列依次为棕榈酸(C16:0)、硬脂酸(C18:0)、肉豆蔻酸(C14:0)、十七烷酸(C17:0)、花生酸(C20:0)、十五烷酸(C15:0)、癸酸(C10:0)、月桂酸(C12:0)。热杀菌温度从85 ℃升到121 ℃时,中链脂肪酸(C10:0、C12:0)含量变化较小,而C14:0、C20:0、C16:0、C18:0这4 种含量较高的脂肪酸呈先上升后降低的变化趋势,和SFA总量的变化趋势一致。当热处理温度为85~95 ℃,这些SFA含量差异不显著,之后温度每升高5 ℃,产品中SFA含量显著增加。这可能是因为超过100 ℃高温易使不饱和的氢键加氢成为SFA[25]。当热杀菌温度达到110 ℃时,C16:0和C18:0含量分别达到最大(20.95 g/100 g和12.99 g/100 g),分别比85 ℃杀菌组显著升高了16.79%、21.02%(P<0.05)。121 ℃处理组的SFA含量下降,这可能由于高温杀菌处理下UFA转化成SFA的量小于UFA的降解量所致。
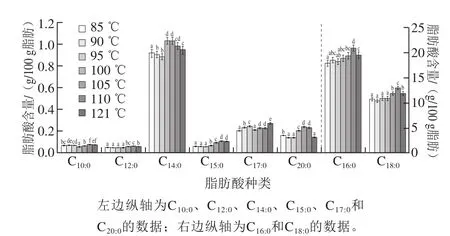
图2 杀菌温度对SFA含量的影响Fig. 2 Effect of sterilization temperature on contents of SFA in emulsified sausages
2.3 杀菌温度对乳化肠中UFA组成的影响
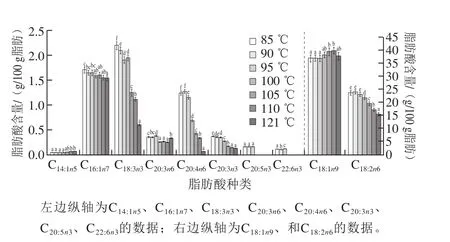
图3 杀菌温度对UFA含量的影响Fig. 3 Effect of sterilization temperature on contents of UFA
由图3可知,乳化肠中共检测出10 种UFA,包括3 种MUFA和7 种PUFA,按其含量高低排列依次为油酸(C18:1n9)、亚油酸(C18:2n6)、α-亚麻酸(C18:3n3)、十六烯酸(C16:ln7)、花生四烯酸(C20:4n6)、二十碳三烯酸(C20:3n6)、二十碳三烯酸(C20:3n3)、二十碳五烯酸(C20:5n3)、二十二碳六烯酸(C22:6n3)、肉豆蔻脑酸(C14:1n5)。随着杀菌温度的升高,MUFA C14:1n5和C16:ln7的含量变化差异不显著(P>0.05),而含量较高的C18:1n9和所有的PUFA差异显著(P<0.05)。经100 ℃以上温度处理后,乳化肠中主要的MUFA C18:1n9的含量显著高于85 ℃处理组。相关性分析表明,C18:1n9与C18:2n6、C18:3n3呈显著负相关(P<0.05)。由此说明,高温下C18:2n6和C易加氢或氧化转化成C[27-28]。
18:3n318:1n9
SFA又称必需脂肪酸(essential fatty acids,EFAs),是人体不能合成但必须从膳食中获取的脂肪酸,其是化学结构含有两个或多个不饱和双键的脂肪酸[27]。C18:2n6、C18:3n3随着温度的升高呈降低趋势,尤其是温度高于105 ℃时,呈极显著下降趋势(P<0.01)。研究发现,α-亚麻酸(C18:3n3)是人体必需脂肪酸,是维持生命的重要物质,能在体内经脱氢和碳链延长合成二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)等代谢产物[29]。对于其他的PUFA,经100 ℃以上温度处理后,其含量极显著下降(P<0.01),尤其是C20:5n3和C22:6n3,100~121 ℃温度处理组中未检测到。花生四烯酸、EPA、DHA等长链UFA在脑功能、婴幼儿智力及视功能发育等方面有重要意义[29]。由此说明,100 ℃的杀菌温度有助于最大程度地保持食品中的PUFA的含量,而100 ℃以上的杀菌温度对PUFA的组成破坏显著。
2.4 杀菌温度对乳化肠中脂肪酸比例的影响
随着脂肪营养研究的深入,脂肪酸的营养作用、需要量以及疾病预防作用日益受到人们广泛的关注。活性脂肪酸主要可分为n-6系列PUFA和n-3系列PUFA两大类。n-6 PUFA/n-3 PUFA是一个评价肉品质量的重要指标[30-31]。根据世界卫生组织/联合国粮食及农业组织推荐标准,根据人体营养需要,膳食营养中n-6 PUFA/n-3 PUFA的值4.0以下为宜。
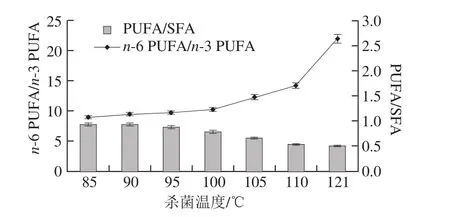
图4 杀菌温度对乳化香肠中活性脂肪酸比例的影响Fig. 4 Effect of sterilization temperature on n-6 PUFA/n-3 PUFA ratio and PUFA/SFA ratio
由图4可知,乳化香肠中n-6 PUFA/n-3 PUFA为8.95~21.94,随着杀菌温度升高,n-6 PUFA/n-3 PUFA的值呈上升趋势,杀菌温度超过100 ℃时,n-6 PUFA/n-3 PUFA的值显著升高。这主要是由于超过100 ℃的热杀菌严重破坏了n-3系列PUFA(C20:5n3和C22:6n3)。PUFA/SFA值是另一个衡量肉品质量的重要指标,随着杀菌温度升高,PUFA/SFA的值呈降低趋势,杀菌温度超过105 ℃时,PUFA/SFA值显著低于85℃热杀菌,这主要由于高温杀菌,PUFA的含量降低和SFA的含量升高共同的作用结果。根据英国卫生部门推荐,膳食营养中PUFA/SFA值通常需大于0.45,不同热处理组中PUFA/SFA值为0.50~0.93,符合膳食营养推荐标准。
2.5 杀菌温度对乳化肠中脂肪氧化的影响
POV是测定初级氧化产物-过氧化物含量的理化指标,能够反映脂质发生初级氧化的程度。丙二醛是指油脂中UFA氧化分解所产生的次级产物,其值的高低表明脂肪次级氧化的程度[28]。PUFA具有最高的氧化敏感性,其次是MUFA,氧化底物主要是亚油酸和油酸[32]。
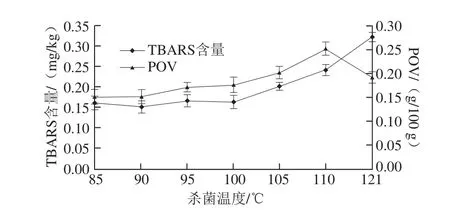
图5 热杀菌温度和时间对乳化香肠中POV和TBARS含量的影响Fig. 5 Effects of sterilization temperature and time on POV and TBARS
POV和TBARS含量的测定结果如图5所示。热杀菌温度范围在85~100 ℃时,杀菌温度和时间对POV和TBARS含量影响不明显。当热杀菌温度从100 ℃升高到110 ℃时,20 min杀菌时间组中POV显著上升,从0.175 g/100 g升至0.25 g/100 g(以脂肪计),而121 ℃处理组中POV显著下降,这是由于过氧化物只是脂肪氧化的初级氧化产物,它的含量决定于生成量和降解量的比率[14],表明高温杀菌条件可能会使初级氧化产物部分分解,从而降低了熟肉的POV。当热杀菌温度超过100 ℃,TBARS含量显著上升,尤其是高温杀菌达到121 ℃,丙二醛含量高达0.32 mg/kg,说明高温杀菌后乳化肠中生成较多的次级氧化产物,脂肪氧化明显。脂质氧化也是产生肉风味的主要途径,且脂质氧化程度的不同会导致肉类风味的差异,脂质的适度氧化产生的醛、酮、醇等挥发性物质,对肉的整体芳香气味产生贡献,这也可以解释艾婷等[8]的研究结果:经80、95、105 ℃和121 ℃分别杀菌的乳化肠中,醛类挥发性风味物质的含量呈现递增的趋势。当杀菌温度不超过100 ℃时,丙二醛含量变化不明显,而超过100 ℃时,丙二醛含量显著增加,说明杀菌温度会促进脂肪氧化。
3 结 论
综上所示,乳化肠经不同杀菌温度处理后,脂肪酸含量和脂肪氧化都会发生一定程度的变化。杀菌温度超过100 ℃时,SFA含量显著增加,而UFA含量显著降低,其中PUFA的含量呈现极显著的降低,而MUFA含量差异不显著,n-6 PUFA/n-3 PUFA的值显著增加,PUFA/SFA值显著降低,同时加速脂肪氧化的速率。100 ℃杀菌温度使C14:0、C20:0、C16:0、C18:0这4 种饱和脂肪酸的含量显著升高,同时C18:2n6、C18:3n3、C20:4n6、C20:3n6的含量显著降低,C20:5n3和C22:6n3未检出。因此,低于100 ℃条件下的杀菌可以最大程度保持产品的原有的脂肪酸组成。高于100 ℃的杀菌温度对产品的脂肪酸比例破坏明显,且促进脂肪氧化。在实际生产中,本研究结论有助于企业选择合适杀菌条件,使脂肪酸组分达到理想状态。
[1] 芦嘉莹, 夏秀芳, 孔保华, 等. 复配食用胶对乳化肠品质的影响[J].食品科学, 2013, 34(5): 31-35. DOI:1002-6630(2013)05-0031-05.
[2] 王鹏, 徐幸莲, 周光宏. 原料肉状态及磷酸盐用量对乳化肠贮藏期间保水和质构性质的影响[J]. 中国农业科学, 2008, 41(9): 2769-2775. DOI:10.3864/j.issn.0578-1752.2008.09.027.
[3] 芦嘉莹, 孔保华, 刘骞, 等. 加水量对添加不同食用胶的乳化肠品质的影响[J]. 食品科学, 2012, 33(15): 57-60.
[4] 刘迪迪, 孔保华. 不同肥瘦肉质量比对乳化肠品质的影响[J]. 食品与发酵工业, 2009, 35(12): 173-177.
[5] ALMEIDA C M, WAGNER R, MASCARIN L G, et al. Production of low-fat emulsified cooked sausages using amorphous cellulose gel[J].Journal of Food Quality, 2015, 37(6): 437-443. DOI:10.1111/jfq.12104.
[6] 邓亚敏, 张立芳, 邵俊花, 等. 胡萝卜汁添加对乳化肠食用品质的影响[J]. 肉类研究, 2014, 28(4): 1-4. DOI:1001-8123(2014)04-0001-04.
[7] KIM Y J, HWANGBO S. Effects of addition of mugwort and pine needle extracts on shelf-life in emulsified sausage during cold storage[J]. Journal of Animal Science and Technology, 2011, 53(5):461-467. DOI:10.5187/JAST.2011.53.5.461.
[8] 艾婷, 张顺亮, 王守伟, 等. 中温杀菌对乳化肠挥发性风味物质变化的影响[J]. 肉类研究, 2014, 26(12): 6-9. DOI:1001-8123(2014)12-0006-04.
[9] 李梦颖, 李建科, 何晓叶, 等. 食品加工中的热杀菌技术和非热杀菌技术[J]. 农产品加工(学刊), 2013(16): 109-113. DOI:10.3969/jissn.1671- 9646(X).2013.08.065.
[10] XU B C. Effect of raw meat composition on textural properties of low temperature emulsified sausage and its proportion optimization[J].Journal of Nanjing Agricultural University, 2011, 34(4): 111-116.DOI:1000- 2030(2011)04-0111-06.
[11] 潘晓倩, 赵燕, 张顺亮, 等. 中温乳化香肠中一株优势腐败菌的分离鉴定与生物学特性[J]. 食品科学, 2016, 37(7): 93-98. DOI:1002-6630(2016)07-0093-06.
[12] 赵冰, 周慧敏, 张顺亮, 等. 中温杀菌对乳化香肠蛋白质变化的影响[J].肉类研究, 2016, 30(3): 5-9. DOI:10.15922/j.cnki.rlyj.2016.03.002.
[13] ALINA A R, NURUL A H, MASHITOH A S, et al. Effect of grilling and roasting on the fatty acids profile of chicken and mutton[J]. World Applied Sciences Journal, 2013, 17: 29-33.
[14] ALFAIA C M M, ALVES S P, LOPES A F, et al. Effect of cooking methods on fatty acids, conjugated isomers of linoleic acid and nutritional quality of beef intramuscular fat[J]. Meat Science, 2010,84(4): 769-777. DOI:10.1016/j.meatsci.2009.11.014.
[15] 黄业传, 李洪军, 秦刚, 等. 不同加工方式与时间对猪肉脂肪含量和脂肪酸组成的影响[J]. 食品工业科技, 2012, 33(1): 159-163; 174.DOI:10.13386/j.issn1002-0306.2012.01.056.
[16] 顾伟钢, 张进杰, 姚燕佳, 等. 红烧肉制作过程中脂肪氧化和脂肪酸组成的变化[J]. 食品科学, 2011, 32(17): 76-80. DOI:1002-6630(2011)17-0076-04.
[17] 王瑞花, 汪倩, 姜万舟, 等. 烹制方式对猪肉肌内脂肪脂质氧化及脂肪酸组成的影响[J]. 中国食品学报, 2017, 17(7): 61-68.DOI:10.16429/j.1009-7848.2017.07.009.
[18] LIN J H, LIN Y H, KUO C C. Effect of dietary fish oil on fatty acid composition, lipid oxidation and sensory property of chicken Frankfurters during storage[J]. Meat Science, 2002, 60(2): 161-167.DOI:10.1016/S0309-1740(01)00116-4.
[19] 李莹莹, 李家鹏, 吴晓丽, 等. 蒸煮温度和时间对猪肉脂肪酸组成比例关系的影响[J]. 食品科学, 2012, 33(23): 27-30. DOI:1002-6630(2012)23-0027-04.
[20] FOLCH L M, SLOANE G H S. A simple method for isolation andpurification of total lipids from animal tissues[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509. DOI:10.1111/j.1365-2621.1970.tb04815.x.
[21] 国家卫生和计划生育委员会. GB 5009.168—2016: 食品中脂肪酸的测定[S]. 北京: 中国标准出版社, 2016: 1-13.
[22] 张顺亮, 赵冰, 潘晓倩, 等. 哈萨克羊肉和市售普通羊肉营养品质与风味特性的对比分析研究[J]. 肉类研究, 2017, 31(3): 23-29.DOI:1001-8123(2017)03-0023-07.
[23] 国家卫生和计划生育委员会. GB 5009.227—2016: 食品中过氧化值的测定[S]. 北京: 中国标准出版社, 2016: 1-6.
[24] 国家卫生和计划生育委员会. GB 5009.181—2016: 食品中丙二醛的测定[S]. 北京: 中国标准出版社, 2016: 1-5.
[25] BAGGIO S R, BRAGAGNOLO N. The effect of heat treatment on the cholesterol oxides, cholesterol, total lipid and fatty acid contents of processed meat products[J]. Food Chemistry, 2006, 95(4): 611-619.DOI:10.1016/j.foodchem.2005.01.037.
[26] DINICOLANTONIO J J, LUCAN S C, O’KEEFE J H. The evidence for saturated fat and for sugar related to coronary heart disease[J].Progress in Cardiovascular Diseases, 2016, 58(5): 464-472.DOI:10.1016/j.pcad.2015.11.006.
[27] CHEN Y J, CAO J, DAI B Y, et al. Changes of fatty acids composition in beef under different thermal treatment[J]. Journal of Food and Nutrition Research, 2015, 3: 303-310. DOI:10.12691/jfnr-3-5-3.
[28] VASANTHI C, VENKATARAMANUJAM V, DUSHYANTHAN K. Effect of cooking temperature and time on the physico-chemical,histological and sensory properties of female carabeef (buffalo)meat[J]. Meat Science, 2007, 76(2): 274-280. DOI:10.1016/j.meatsci.2006.11.018.
[29] SPECTOR A A, KIM H Y. Cytochrome P450 epoxygenase pathway of polyunsaturated fatty acid metabolism[J]. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids, 2015, 1851(4):356-365. DOI:10.1016/j.bbalip.2014.07.020.
[30] IVANA S, ALE T, IRENA V. Effect of heat treatment on the n-3/n-6 ratio and content of polyunsaturated fatty acids in fish tissues[J]. Food Chemistry, 2015, 176: 205-211. DOI:10.1016/j.foodchem.2014.12.058.
[31] RUSSO G L. Dietary n-6 and n-3 polyunsaturated fatty acids: from biochemistry to clinical implications in cardiovascular prevention[J].Biochemical Pharmacology, 2009, 77(6): 937-946. DOI:10.1016/j.bcp.2008.10.020.
[32] ZHANG J J, WU D, LIU D H, et al. Effect of cooking styles on the lipid oxidation and fatty acid composition of grass carp(Ctenopharynyodon idellus) fillet[J]. Journal of Food Biochemistry,2013, 37(2): 212-219. DOI:10.1111/j.1745-4514.2011.00626.x.
