红茂草生物碱对肺炎克雷伯菌的抑菌作用及机理初探
2018-06-19王廷璞高义霞袁毅君马伟超李成辉
王廷璞,高义霞,赵 强,袁毅君,马伟超,薛 丽,李成辉
(天水师范学院 生物工程与技术学院,甘肃 天水 741001)
红茂草[Dicranostigma leptopodum(Maxim.)Fedde,DLF]又名秃疮花,秃子花,勒马回(陕西),二年生或多年生草本,罂栗科秃疮花属植物。[1-2]植物含淡黄色汁液,茎2~5条,多数为基生叶,根为肉质的直根,在甘肃省秦岭南北、渭水流域分布较广泛。在民间红茂草无论全草入药,还是复方配药,都有消肿止痛,清热解毒,杀虫等功效,[3-4]可治疗扁桃体炎,咽喉痛,淋巴结核等症,已经制定了中药材地方标准。[5-6]红茂草生物碱是从红茂草中分离提取出的有效成分,主要有:异紫堇碱(Laooorvdine),紫堇碱(Corvdine),异紫堇啡碱,木兰碱(Magnoflorine)及原阿片碱(Vrotopine)等。其中异紫堇碱具有明显的镇痛、镇静、解除平滑肌痉挛等作用,[7-8]研究表明红茂草生物碱对粪肠球菌、大肠杆菌、枯草杆菌、金黄色葡萄球菌都具有较好的抑菌作用。红茂草生物碱抑菌机理的开发利用尤为重要,它是一种亟待开发的新型药物资源,有广阔的开发应用前景和极大的社会经济效益。
当前临床上,肺炎克雷伯菌已成为医院感染最常见的病原菌之一,尤其新生儿在医院极易感染肺炎克雷伯菌而患败血症。据研究可知,肺炎克雷伯菌属敏感率高,对2,3代头孢菌素、头孢吡肟、4代头孢菌素、喹诺酮类[9]等多种抗菌药物都比较敏感且有较高的耐药性,其耐药问题严重,亟待采取有效的控制措施。
本文以肺炎克雷伯菌为试验菌,通过绘制生长曲线、测定最小抑菌浓度、抑菌率、半数抑菌浓度、电导率及细胞形态进行研究,来探讨红茂草对肺炎克雷伯菌的抑菌作用,为红茂草资源的合理开发利用和肺炎克雷伯菌的高耐药性提供一定的理论参考。
1 材料与方法
1.1 实验材料
红茂草粉末:由王廷璞老师提供;红茂草粉末(初夏采于天水师范学院规范化种植的红茂草,风干,粉碎后过80目筛);肺炎克雷伯菌(Klebsiella pneumoniae编号:ATCC 700603)由天水师范学院免疫学实验室保存。
1.2 药品及仪器
牛肉膏(北京市奥星生物技术有限责任公司)、普通琼脂(北京市奥星生物技术有限责任公司)、氯化钠(分析纯,西安化学试剂厂)、蛋白胨(北京市奥星生物技术有限责任公司)、无水乙醇(分析纯,开封化学试剂总厂)、无水乙醇(分析纯,开封市芳晶化学试剂有限公司),80万单位青霉素(哈药集团制药总厂,产品批号:A1311080)。
垂直流超净工作台(上海智城分析仪器制造有限公司,型号ZHJH-2112B);全自动新型电热培养箱(上海智城分析仪器制造有限公司,型号ZDP-2120);KQ-500E超声波清洗器(昆山市超声仪器有限公司);TDZ5-WS多管架自动平衡离心机(长沙湘仪离心机仪器有限公司);722型可见分光光度计(上海智城分析仪器制造有限公司);电子天平(岛津,型号:AUY220)等。
1.3 实验方法
1.3.1 红茂草生物碱的制备
准确称取500 g红茂草干燥粉末,溶于1000 mL水中,保存在密封的玻璃容器中,浸泡2~3天,超声波振荡1h后,减压抽滤。[10,22]抽滤掉残渣后,煎煮浓缩至糖浆状,按参考文献[2]所述优化方法制备红茂草生物碱。色谱检测生物碱有效含量80%以上,室温下保存备用。
1.3.2 培养基的配制
牛肉膏固体培养基:牛肉膏3g,蛋白胨10g,NaCI5g,蒸馏水1000mL,琼脂15~20g,pH7.4.
牛肉膏液体培养基:牛肉膏3g,蛋白胨10g,NaCI5g,蒸馏水1000mL,pH7.4.
将配置好的液体培养基分成三组A、B、C分别为实验组、空白对照组(加入生理盐水)和阳性对照组(青霉素:3500 u/mL),实验组红茂草生物碱浓度梯度设为1 mg/mL,1.5mg/mL,2mg/mL,2.5mg/mL,3mg/mL(此浓度均按生药量计算)。按梯度要求分别加入红茂草提取液,然后向盛有培养基的各容器中分别加入20 μl活化的肺炎克雷伯菌的菌液,再置于电热恒温振荡器中培养。
1.3.3 菌种的活化
取冷藏保存的肺炎克雷伯菌菌种,在琼脂平板上进行划线培养,放置在电热恒温培养箱中,在37℃下培养24h后,挑取单菌落接种在液体培养基中,放置在电热恒温振荡器中,在37℃,130 r/min下培养8h活化菌种。摇床扩大培养到对数期,利用麦氏比浊法[11-12]将菌株配制成108cfu/mL的菌悬液。
1.3.4 生长曲线的制作
将已加入菌液的培养液放置在振荡器中在37℃,130 r/min下培养,将菌液按时间梯度0h,1h,2h,3h,4h,5h,6h,7h,8h,9h,10h,11h,12h分别测其在波长600nm处的OD值并记录数据,在测定过程中为减少菌液在空气中的暴露,应将从振荡器中取出的菌液于无菌间的超净工作台上进行操作,用移液枪吸取菌液前应先摇晃容器,使菌液充分混匀,重复测定3次。每次在测定完之后应清洗比色皿至少3次,根据三次重复测定的OD值,求出平均值,以时间为横坐标,OD值为纵坐标,绘制生长曲线。[13]
1.4 抑菌试验
1.4.1 菌液的制备
配制红茂草生物碱系列浓度:1.0mg/mL,1.5mg/mL,2.0mg/mL,2.5mg/mL,3.0mg/mL的固体培养基。于无菌间的超净工作台上进行操作,待凝固后备用。每次吸取108cfu/mL10μl菌悬液,分别滴于红茂草生物碱系列浓度平板上涂均匀,放置在电热恒温培养箱中,在37℃下培养24h.同时作空白对照组和阳性对照组(青霉素浓度:3500u/mL),观察计数菌落个数并记录结果。
1.4.2 最小抑菌浓度(MIC)的测定
取上述肺炎克雷伯菌菌悬液,采用平板稀释法,[14-15]将红茂草生物碱用无菌蒸馏水进行倍比稀释,制备系列浓度培养液,同时制备不含红茂草生物碱的培养液作为对照。再按培养皿上标记计量,用移液枪分别吸取定量被试菌液,涂于平板上置于37℃恒温培养箱中培养24h后,观察菌落生长情况,以平板菌落计数法计算菌落数,重复3次。以肉眼观测完全没有菌落生长的最低红茂草生物碱浓度作为该药物的最小抑菌浓度(MIC)。
1.4.3 抑菌率[16,21]的计算
将灭好菌的20 mL固体培养基置于超净工作台上至50℃~60℃,加入2 mL红茂草生物碱提取液混匀后,在超净工作台上倒入无菌培养皿中,再加入0.1 mL的菌液,用涂布棒涂抹均匀,同一浓度的做三组,以未加红茂草生物碱的培养基作为对照组,将其置于37℃的培养箱中培养24h,统计菌落数,计算抑菌率。根据公式计算抑菌率:η=(c1-c2)/c1×100%其中c1和c2分别是指空白皿和涂有药液的平皿上的菌落数。
1.4.3 半数抑菌浓度(IC50)的测定
按照MIC测定方法稀释药液,制备药液平板,每个药液稀释度接种3个供试菌落平板,37℃培养观察菌落生长情况,以培养皿中长菌或不长菌为准,按Reed-Muench法计算半数抑菌浓度IC50.[17,22]
1.4.4 红茂草生物碱对肺炎克雷伯菌通透性及形态观察
参照Lee方法,[18-19]吸取20μl菌悬液分别接种于20mL的2.5mg/mL红茂草生物碱,同时作空白对照和阳性对照(青霉素:3500u/ml)。置于37℃130r/min振荡器中培养,按时间间隔0h,2h,4h,6h,8h,10h,进行革兰氏染色观察肺炎克雷伯菌形态的变化。分别取出3 mL稀释20倍后,按时间梯度用电导仪测定电导率并记录结果,重复3次。
2 试验结果与分析
2.1 试验生长曲线
肺炎克雷伯菌的生长曲线如图1.
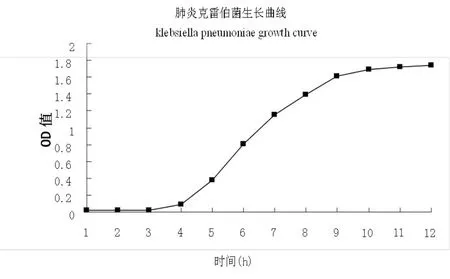
图1 肺炎克雷伯菌生长曲线(波长600nm)
通过测定肺炎克雷伯菌在波长600nm处的生长曲线反映了菌体的群体生长规律,依据其生长的速度可把菌体的生长曲线划分为调整期、对数期、稳定期和衰亡期4个阶段。由图1所示:3h前菌体处于调整期,生长速度缓慢,随着时间的延长,在3h菌体开始进入对数期,4h~9h菌体开始大量的增殖,11h开始达到稳定期,菌体的数量趋于稳定;12h后菌体生长缓慢数量有所减少,其进入衰亡期。
2.2 抑菌试验测定结果
2.2.1 红茂草生物碱MIC的测定
由图2可知,红茂草生物碱对肺炎克雷伯菌有明显的抑菌效果,以a作为空白对照,g作为阳性对照,随着红茂草生物碱浓度的增加,平皿上生长的菌落数也越来越少。由表1可知,其中2.0mg/mL时菌落数为15个;2.5mg/mL时菌落数为1个,3.0mg/mL时菌落数为0个,完全抑制菌落的生长,说明红茂草生物碱的MIC为2.5mg/mL,随着红茂草生物碱液浓度的增加,其抑菌能力也逐渐增强。
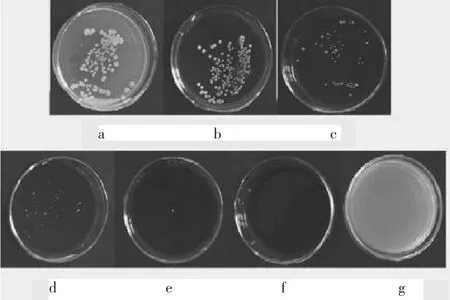
图2 不同浓度红茂草生物碱抑菌结果
2.2.2 红茂草生物碱对肺炎克雷伯菌的抑菌率经计算红茂草的半数抑菌率结果见表2.

表1 红茂草生物碱抑菌数的计数结果

表2 红茂草生物碱的抑菌率(%)
由表2可见,供试菌的菌落数随着红茂草生物碱药液浓度的增加而减少,表明红茂草生物碱对该菌具有显著的抑菌效果。红茂草生物碱药液浓度对供试菌抑菌率的多重比较表明,当药液浓度为1.0 mg/mL时,该菌对药液的作用不敏感(菌落数为162个);当药液浓度达到3.0mg/mL时,红茂草生物碱对供试菌产生完全抑菌作用。
2.2.3 红茂草生物碱IC50的测定
红茂草生物碱对肺炎克雷伯菌的抑菌结果计算IC50(见表3所示)。
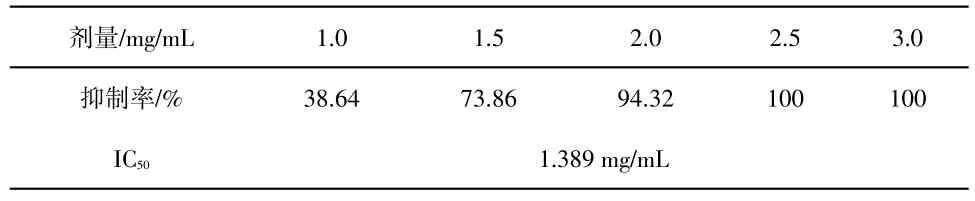
表3 红茂草生物碱抑菌效果的IC50
由表3可知:红茂草生物碱对肺炎克雷伯菌的IC50为1.389 mg/mL.
2.2.4 红茂草生物碱对肺炎克雷伯菌的形态影响
选取浓度为2.5 mg/mL红茂草生物碱对肺炎克雷伯菌进行抑菌,分别在培养0h、2h、4h、6h、8h、10h后进行染色形态观察,结果见图3.
由图3可知,培养6h后部分菌体正常,部分菌体形态略有变短加粗;培养8h后,大部分菌体已变为不规则形状,一部分菌体已经缢裂,有较多菌体残骸;培养10h后,菌体已经全部缢裂,菌体残骸较少。结果表明,红茂草生物碱能够抑制肺炎克雷伯菌的生长,并且能够使菌体形态改变,并使菌体缢裂。

图3 红茂草生物碱对肺炎克雷伯菌形态的影响
2.2.5 红茂草生物碱对肺炎克雷伯菌渗透性影响
红茂草生物碱对肺炎克雷伯菌培养液电导率测定结果如图4,对抑菌实验结果,进行方差分析可知,空白对照组与红茂草生物碱实验组,P<0.05有显著差异;空白对照组与青霉素组,P>0.05无显著差异;青霉素组与红茂草生物碱组,P<0.05有显著差异。培养液电导率的改变可以反映出细胞渗透性的改变。经红茂草生物碱处理的肺炎克雷伯菌的培养液的电导率明显高于对照组,而且随着作用时间的延长,培养液的电导率表现出先增长后趋于稳定的趋势,说明当该菌遇到抑制剂而使细胞膜遭到破坏时,打破细胞膜的保护屏障,导致其电解质外泄至培养液中,使培养液的电导率发生变化。一定浓度的红茂草生物碱能改变肺炎克雷伯菌的细胞渗透性,对肺炎克雷伯菌有显著的抑菌作用。

图4 红茂草生物碱对肺炎克雷伯菌渗通透性影响
3 讨论与结论
3.1据研究表明,肺炎克雷伯菌携带有青霉素、氯霉素等抗性基因,[20]是医院常见的一种耐药病原菌。红茂草提取液抑菌谱广,对革兰氏阴性菌及革兰氏阳性菌均有抑制作用。肺炎克雷伯菌属于革兰氏阴性菌,通过青霉素做阳性对照,结果表明红茂草生物碱对供试菌有显著的抑菌效果,且随着药物浓度增加抑菌作用增强。
3.2赵强[21-28]等研究表明:红茂草生物碱对金黄色葡萄球菌、粪肠球菌的MIC分别是0.18、0.30mg/mL;IC50分别是0.1407、0.2605mg/mL.而本实验结果表明:红茂草生物碱对肺炎克雷伯菌的MIC为2.5mg/mL,IC50为1.389mg/mL;最小抑菌浓度与半数抑菌浓度都明显比以上菌中的抑菌浓度大,可能存在的原因:肺炎克雷伯菌是革兰氏阴性菌,金黄色葡萄球菌、粪肠球菌属于革兰氏阳性菌,从细胞壁的组成来分析,革兰氏阳性菌的细胞壁较厚结构紧密,且细胞壁含有丰富的磷壁酸,革兰氏阴性菌细胞的壁薄,交联松散,红茂草生物碱分子进入细胞对它们的作用效果存在差异,及红茂草生物碱对肺炎克雷伯菌的抑菌浓度比以上两种菌的抑菌浓度高。
3.3通过红茂草生物碱对肺炎克雷伯菌细胞形态的影响试验,初步探讨红茂草生物碱的可能抑菌机理:一是红茂草生物碱与细菌细胞膜上的脂蛋白作用,造成细菌细胞壁缺损,抑制细胞壁的合成,水解细胞壁中的糖苷键,破坏了细胞壁结构,使细胞内出现空腔。二是红茂草提取物渗入细胞内部,抑制胞内酶的活性,扰乱细胞的正常代谢活动。[23]红茂草生物碱与肺炎克雷伯菌作用后,电导率明显上升,说明红茂草生物碱使肺炎克雷伯菌通透性增加,使小分子物质从细胞中渗出,使菌悬液的电导率增加。
[1]王廷璞,赵强.药用植物红茂草化学成分及抗炎作用研究进展[J].食品安全质量检测学报,2013,4(5):1323-1328.
[2]王廷璞,李强,刘小东,等.红茂草生物碱提取工艺优选及色谱分析[J].食品工业科技,2012,33(22):51-55.
[3]冯艳,杨爱梅,柳军玺,等.秃疮花中异紫堇碱的提取分离纯化工艺研究[J].中药材,2013,36(5):807-809
[4]赵强,杨明,李一鸥,等.红茂草化学成分及药理作用的研究进展[J].农业科技与信息,2008,(16),29-30.
[5]陈荃,王廷璞,赵兰兰,等.红茂草药理作用与人工栽培研究进展[J].天水师范学院学报,2008,28(2):49-52.
[6]刘大护,张天才,柳军玺,等.秃疮花生物碱类化学成分研究[J].中草药,2011,42(8):1505-1508.
[7]赵强,王廷璞,孙国禄,等.秃疮花生物碱成分分析及药理作用研究进展[J].陇东学院学报,2010,21(2):53-57.
[8]王廷璞,安建平,贾志国,等.红茂草生物碱提取方法及指纹检测技术建立的研究[J].中兽医医药杂志,2008,(6):41-42.
[9]汪滢,李家斌.238株肺炎克雷伯菌的临床分布和耐药分析[J].安徽医学,2012,33(6):652-654.
[10]栗星,溪春蕊,王晓琳.超声波提取桑葚果渣黄铜工艺研究[J].农业工程技术,2010,(12):30-33.
[11]马秀玲,陈蕊君,王飞,等.吸光度法快速确定菌悬液浓度及其适用范围[J].微生物学杂志,2014,34(4):90-92.
[12]罗映辉,邬国军,余俊龙,等.细菌繁殖与计数新方法的实验研究[J].实用预防医学,2003,10(5):828-829.
[13]刘世旺,徐艳霞,石宏武.虎耳草乙醇提取物对生长曲线的影响[J].安徽农业科学,2007,35(4):943-946.
[14]陶永霞,刘洪海,王忠民,等.番茄生物碱粗提物抑菌作用的研究[J].天然产物研究与开发2006,(18):439.
[15]朱亚芳,赵浩如.中药体外抑制痤疮丙酸杆菌的活性测定[J].药学与临床研究,2009,(3):224-226
[16]胡仁火,任国祥.9种中药植物抑菌作用的研究[J].安徽农业科学,2007,35(27):8534-8535.
[17]杜平.医用实验病毒学[M].北京:人民军医出版社,1985:82.
[18]孙延忠,曾洪梅,石义萍,等.武夷菌素对番茄灰霉菌(Botrytis cinerea)的作用方式[J].植物病理学报,2003,33(5):434-438.
[19]艾启俊,于庆华,张红星,等.鹿蹄草素对金黄色葡萄球菌的抑制作用及其研究进展[J].中国食品科学,2007,7(2):33-37.
[20]方渊,朱德梅,汪复,等.肺炎克雷伯菌庆大霉素钝化酶基因的检测与分析[J].中华医学检验杂志,1996,19(3):170-172.
[21]赵强,王廷璞,余四九,等.红茂草生物碱抑菌活性的测定[J].中国兽医科学,2008,38(10):1098-1101.
[22]董晓宁,赵强,杨明.秃疮花生物碱的提取与体外抑菌研究[J].中兽医学杂志,2010,(2):6-11.
[23]刘世旺,徐艳霞,郑永良.连翘乙醇提取物对细菌生长曲线的影响[J].安徽农业科学,2007,35(24):7383-7384.
[24]赵强,王廷璞.野生药用红茂草挥发油提取及抗氧化活性研究[J].草地学报,2014,24(2):473-478.
[25]赵强,王廷璞.红茂草中黄酮类提取工艺优化及体外抑菌研究[J].畜牧兽医杂志,2016,35(1):4-12.
[26]赵强,王廷璞,索有瑞.西北野生药用植物红茂草资源的研究与利用[M].北京:化学工业出版社,2015:390-400.
[27]王廷璞,关倩,方继利,等.红茂草生物碱对金黄色葡萄球菌的抑菌作用研究[J].中兽医医药杂志,2017,36(6):13-16.
[28]赵强,王廷璞,董晓宁,等.红茂草中异紫堇啡碱正交提取工艺的建立[J].中兽医医药杂志,2012,(4):5-7.
