CYP2C19基因多态性与艾司西酞普兰临床疗效的关系*
2018-06-17
CYP450是由一群基因超家族编码的肝脏药物代谢酶,参与了临床 90%药物的代谢[1]。CYP2C19酶属于人类CYP2C亚科,其编码基因位于人类10q23.33染色体上。到目前为止,除了已知的野生型CYP2C19*1外,还存在34个等位基因,即 CYP2C19*2~CYP2C19*35,并且这个数字还在不断增长。这些突变基因可分成两种类型:一类是降低酶活性的,如 CYP2C19*2、CYP2C19*3;一类是增加酶活性的,如 CYP2C19*17。相应的,其表型有四种:超快代谢型(Ultra-rapid Metabolism,UM)、快代谢型(Extensive Metabolism,EM)、慢代谢型(Poor Metabolism,PM)和中间代谢型(Intermediate Metabolism, IM)[2]。CYP2C19是艾司西酞普兰的主要代谢酶,CYP2C19的基因突变后出现多型性,从而使体内蛋白酶的活性发生变化,改变艾司西酞普兰的药代动力学。因此,研究不同基因型患者的代谢特点,对于提高艾司西酞普兰的疗效、减少不良反应、缩短治疗时间均有一定的意义[3]。本研究中,以艾司西酞普兰为底物,利用数字荧光分子杂交技术测定酶活性,探讨对艾司西酞普兰疗效的影响,为临床个体化用药提供科学依据。
1 对象与方法
1.1 对象 以2016 年11月~2017年12月在潍坊市精神卫生中心就诊的患者为研究对象。入组标准:(1)符合国际疾病分类第10版(ICD-10) 中抑郁发作的诊断标准, 年龄25~60 岁,男女不限;(2)17项汉密尔顿抑郁量表(HAMD-17) 评分≥17分。排除标准:(1)脑器质性精神障碍;(2)精神活性物质及非成瘾物质所致抑郁障碍;(3)双相情感障碍,目前为抑郁发作;(4)难治性抑郁症患者;(5)伴有精神病性症状的抑郁发作;(6)双相障碍家族史;(7)对抗抑郁药过敏的患者;(8)精神分裂症后抑郁;(9)严重自杀自伤风险的患者;(10)2周前曾使用抗抑郁药物者;(11)严重心、肝及肾脏功能障碍等疾病。共入组96例。其中男35例(37.63%),女61例(63.54%);平均年龄(46.45±13.80)岁;首发抑郁症患者52例,复发性抑郁症患者44例;病程15 d~240个月,平均(53.72±60.99)个月。向患者及家属解释说明本次研究的目的及临床意义,获得患者的知情同意,并签署知情同意书。该研究获得潍坊市精神卫生中心医学伦理委员会审核批准。
1.2 方法
1.2.1 治疗方法 艾司西酞普兰起始剂量为5 mg/d,1周内加至20 mg/d。持续给药6周。整个试验期间禁止合用其他抗抑郁剂或抗精神病药物,禁止行心理治疗、物理治疗等。伴有失眠的患者,可临时给予扎来普隆片5 mg对症处理。
1.2.2 基因检测 对采集到的临床全血样本按要求编号,然后进行白细胞富集。向底部富集有白细胞的离心管中加入 40~50 μL核酸纯化试剂。将检测仪器打开,放入待检样本,运行开始后系统将自行进行基因检测。荧光分子杂交基本原理是用已知的标记单链核酸为探针,按照碱基互补的原则,与待检材料中未知的单链核酸进行特异性结合,形成可被检测的杂交双链核酸。
1.2.3 疗效及不良反应评定 采用HAMD-17进行临床疗效评估。治疗过程中出现的药物不良反应采用治疗中需处理的不良反应症状量表(TESS)评定。量表评定由2名具有多年临床经验的资深主治医师独立完成。在治疗前及治疗后第1、2、4、6周末,应用HAMD-17进行评分,同时在用药后第3天及第1、2、4、6周末进行TESS的评定,以评价药物的不良反应。实验室检查:治疗前及治疗后第4、6周末进行血常规、尿常规、肝功能、肾功能、心电图等检查。以 HAMD-17减分率作为疗效评定标准[4],减分率=(治疗前评分-治疗后第6周末评分)/治疗前评分100%,减分率≥75%达到临床痊愈,50%~74%为显著进步,25%~49%为好转,<25%为无效。

2 结果
2.1 CYP2C19基因型及代谢型分布情况 共获得 5 种基因型,3 种代谢表型。其中EM型35例,占35.46%,IM型46例,占47.92%,PM组15例,占15.63%;野生纯合子(CYP2C19*1/*1)35例,所占比例35.46%,是所有基因型中频数最高的一组;突变杂合子(CYP2C19*1/*2)33例、(CYP2C19*1/*3)13例,分别占32.29%和13.54%;突变纯合型(CYP2C19*2/*2)为10例, (CYP2C19*2/*3)为5例, (CYP2C19*3/*3)为0例,分别占10.46%、6.25%、0.00%;未出现UM型患者。
2.2 3种代谢型患者一般资料比较 3种不同代谢型患者比较发现,患者的年龄、性别组成、病程、高血压史、糖尿病史、吸烟史、饮酒史及 HAMD 基线评分在不同表型之间比较差异无统计学意义(P>0.05)。见表1。
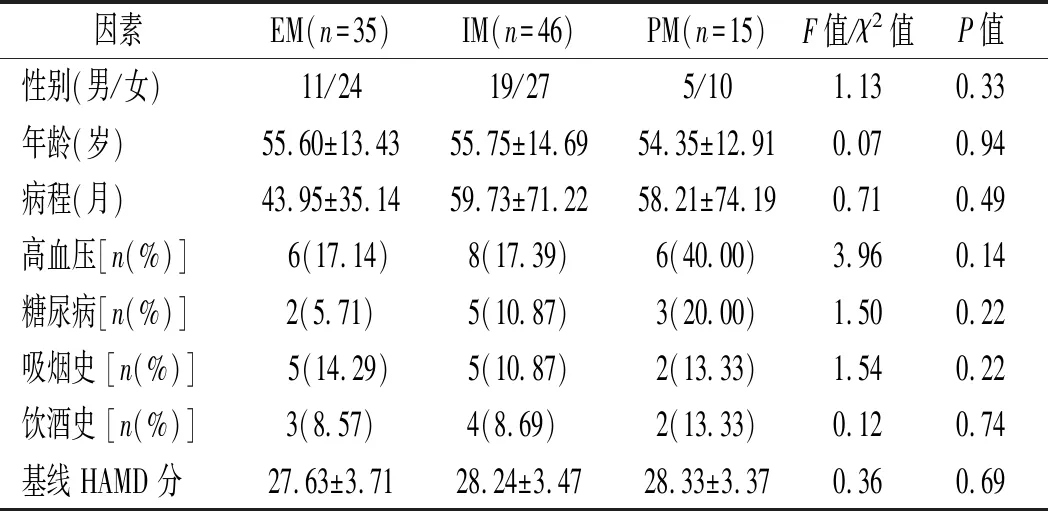
表1 3 种代谢型患者一般资料比较
2.3 3种代谢型患者HAMD评分及减分率比较 治疗后第1、2、4、6周末,3种不同代谢型患者HAMD评分均较各自治疗前降低(P<0.05)。治疗后第6周末,3组患者HAMD评分比较差异有统计学意义(P<0.05)。见表2。EM组的治疗有效率为57.14%,IM组为82.61%,而PM组为80.00%,3组不同代谢型患者治疗有效率比较差异有统计学意义(χ2=8.46,P=0.014)。EM组治疗有效率低于IM组与PM组(χ12=6.34,P1=0.014;χ22=5.08,P2=0.019),但是IM组与PM组治疗有效率比较差异无统计学意义(χ2=0.136,P=0.712)。
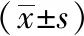
表2 3种代谢型患者各时间段 HAMD 评分比较
注:与治疗前比较,P<0.05
2.4 3种代谢型患者不良反应比较 治疗过程中,96例患者共出现不良反应34例,总不良反应发生率为35.42%;其中EM组8例不良反应,发生率为22.86%;IM组出现14例,发生率为30.43%;PM组共出现12例,发生率为80.00%。3组间总不良反应发生率比较差异有统计学意义(χ2=15.95,P=0.00)。见表3。
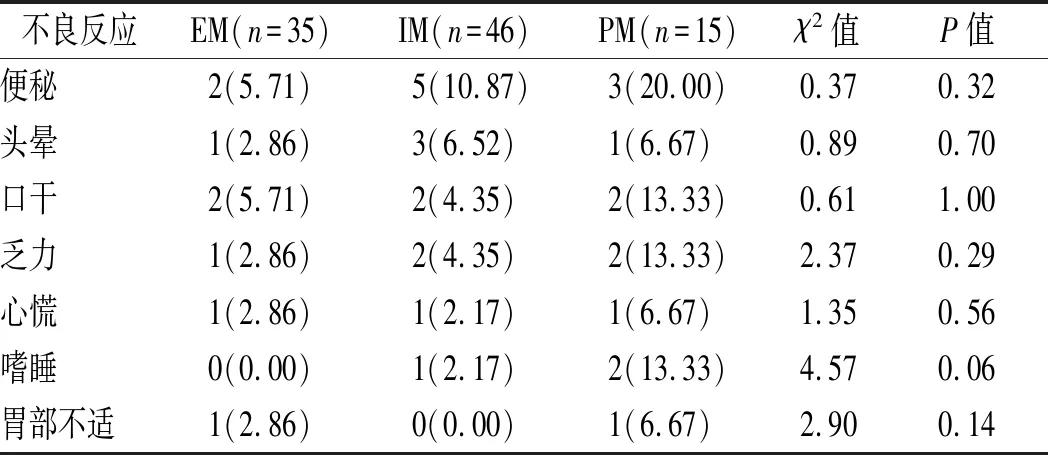
表3 3种代谢型患者不良反应比较 [n(%)]
3 讨论
抑郁症(Depressive Disorders,DD)作为一种以心境低落、兴趣丧失、易疲劳等为主的精神性疾病,伴有不同程度的认知和行为的改变,有些可出现妄想、幻觉等精神病性症状,严重者有自杀观念或行为,而且多数患者有反复发作倾向[5]。
CYP2C19 作为艾司西酞普兰的主要代谢酶,其遗传的异质性对其血药浓度的升高或者降低具有一定的影响[6]。当酶较为缺乏或表达受到抑制时,药物在血液当中的浓度将会迅速提升,这就会让药物半衰期在一定程度上延长进而引发药物毒性反应。Hodgson K等[6]对266 例欧洲抑郁症患者进行了12周的随访,进行血药浓度的检测及药物疗效评估,结果表明 CYP2C19 基因型的不同与艾司西酞普兰在体内的血药浓度存在一定的关系。刘东波等[7]对108例汉族抑郁症患者进行6周的抗抑郁治疗,结果发现治疗后第6周末纯合子强代谢组与杂合子强代谢组之间的HAMD分值差异无统计学意义;治疗后第1、2、6周末, 3种代谢组间HAMD分值及减分率比较差异均有统计学意义。Herrlin K等[8]的研究显示,CYP2C19 弱代谢者的血浆中艾司西酞普兰浓度较其他代谢型高。安志国等[9]对新疆维吾尔族人群的研究发现,CYP2C19 遗传异质性与艾司西酞普兰不论是在药物疗效还是药物不良反应之间均存在关联,而且该等位基因频率的分布在新疆维吾尔族人群与汉族人群之间存在较大的差别,该少数民族中弱代谢型的发生频率低于汉族人群,说明 CYP2C19 基因多态性存在种族差异。上述研究均说明 CYP2C19基因多态性影响艾司西酞普兰的治疗效果。
本研究共出现 5 种基因型,3 种表现型,没有出现 CYP2C19*3/*3 这个等位基因,考虑与试验所收集的样本量偏少有关,这也从侧面说明了这种变异的等位基因在我国汉族人群中发生的概率较低。治疗前3组不同表型患者的一般资料及 HAMD 基线评分比较,差异无统计学意义(P>0.05)。治疗后第1、2、4、6周末,3种不同代谢型患者HAMD评分均较各自治疗前降低(P<0.05)。治疗后第6周末,3组患者HAMD评分比较差异有统计学意义(P<0.05)。治疗结束,3组患者的治疗有效率分别为:EM组57.14%、IM组82.61%、PM组80.00%,3组患者治疗有效率比较差异存在统计学意义(P<0.05)。药物不良反应共出现34例,没有因不能耐受药物不良反应而退出研究的。在所有不良反应中出现频率较高的是抗胆碱能不良反应和神经系统症状,各组实验室检查结果无明显异常,从侧面说明艾司西酞普兰安全性好。从各不良反应发生的频率来看,3组间比较差异无统计学意义。但从各组总不良反应发生率看,PM型患者更容易出现不良反应,说明PM型患者对药物的代谢速度较慢,药物浓度在体内蓄积所致。由此可见,短时间内相同剂量的抗抑郁治疗后,不同基因型患者对药物的应答水平不同,EM型患者服药后血药浓度达峰时间延长,或不能达到治疗所需的药物浓度水平,因此疗效不佳。而PM型患者对药物代谢的速度慢,血药浓度达到治疗标准,但因药物长时间在体内蓄积,由此导致药物不良反应大大增加,对于年轻患者轻微的不良反应如便秘、口干等或许可以耐受,但对于老年人,本身对于药物代谢的能力就降低,若为PM型,可能会出现严重的不良反应,如精神障碍、QT间期延长等。因此说明在短疗程内,艾司西酞普兰抗抑郁症治疗的疗效与CYP2C19各等位基因之间具有一定的基因剂量依赖效应[11],这与杨琴等[11]研究结果基本一致。这说明,CYP2C19出现遗传异质性后引起的代谢酶活性的改变对药物不良反应的发生起着某种重要的作用,催化活性低的患者经相同剂量的药物治疗后有较高的药物不良反应。
综上所述,CYP2C19基因多态性对艾司西酞普兰的临床疗效有一定的影响。但本研究尚存在样本量偏少、观察时间较短等局限,有待扩大样本作进一步探讨。
