三种培养基对人脐带间充质干细胞培养生长和数量影响的比较
2018-06-15高健伟郭红燕李艳生
高健伟,郭红燕,李艳生
人脐带间充质干细胞在实验及临床有广泛的应用,取得了很多很好的成果,逐渐成为人们研究的热点;但干细胞的培养扩增还存在较多问题,很多因素都可能导致原代干细胞体外培养失败(如选择培养基、血清、脐带质量、无菌情况、技术操作等),即使成功培养间充质干细胞 (mesenchymal stem cells,MSCs),其生长状态不良、数量少、细胞收集不足等情况,影响实验结果。笔者对目前使用的三种不同培养基进行原代干细胞培养,对其观察细胞培养数量的结果具体分析如下。
1 材料与方法
1.1 培养基、试剂和仪器 低糖DMEM、高糖DMEM、DMEM/F12(均使用 HyClone),青霉素和链霉素 100×(Solabio),15%FBS(Gibco),培养皿(美国康宁),倒置显微镜 (100×),荧光倒置显微镜(100×)。
1.2 不同培养基的培养皿孔数计数 全部采用同一厂家6孔培养板,同一培养板只能用一种培养基,共3板,1孔为一份标本,共18份标本。
1.3 培养时间和观察内容 不同培养时间点,分别是 7、10、15、20、25 d, 在不同时间点观察不同培养基对细胞游出面积、细胞计数的影响。
1.4 脐带采集和培养 人脐带间充质干细胞原代培养采用组织块贴壁法进行,同一婴儿的脐带进行三种不同培养基培养。足月、健康剖腹产产妇的新鲜、无菌、健康的新生儿脐带长约24 cm,用4℃无菌恒温盒储存运输,即刻消毒,用PBS(含1∶1000的青霉素和链霉素)反复冲洗表面血迹和血管内残留血液,清洗彻底干净,随后用组织剪剪取干净、清亮、饱满部分的脐带,每一段长约1 cm,挑选取用18段用PBS再次反复冲洗。冲洗干净后用血管钳和眼科剪细心分离先将脐带静脉和动脉去除,然后去除羊膜,剩余即为华通胶。取无菌一次性培养皿用眼科剪将华通胶一般剪成1 mm×1 mm×1 mm组织块,平均分别种在一次性无菌6孔板的培养板底部,随后把培养板放在37℃,5%CO2恒温孵育箱中1.5~2.5 h。1.5~2.5 h后取出在超净操作台上用加液器缓慢小心分别加入DMEM低糖、DMEM高糖、DMEM/F12培养液(含1∶100的青霉素和链霉素)。倒置显微镜下观察未见异常后置于37℃,5%CO2恒温孵育箱内培养,孵育期间要更换培养基。
2 结果
2.1 细胞游出面积和细胞计数情况 在相同的培养条件下,采用足月、健康剖腹产产妇的新鲜、无菌、健康的新生儿脐带。以每厘米脐带培养进行比较计数,三种不同培养基细胞游出概率及细胞计数比较见表 1、2。
2.2 人脐带MSCs形态学特性 人脐带华通胶行组织块贴壁法培养间充质干细胞,分别应用A组、B组、C组进行培养。观察7 d、15 d细胞发现:A组B组细胞游出时间偏长,数量较少,成功概率下降,镜检发现干细胞游出少,瘦小,生长缓慢,呈索状偏长,细胞排列稀疏;C组细胞游出时间较短,数量较多,大片呈集落群体生长,生长迅速,增殖较快,成功概率较高,镜检发现干细胞游出较多,体积较大,呈条索状或菱形偏长,形态均一,大多数平行生长,细胞融合及细胞排列紧密,多数可出现多层细胞,细胞生长旺盛[1,2]。
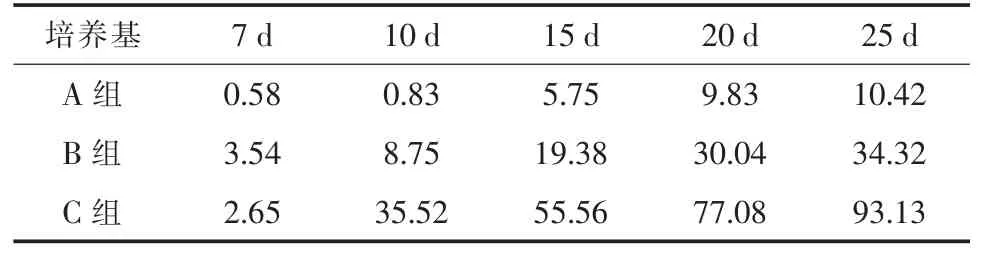
表1 不同培养基细胞不同时点游出面积百分比(%)

表2 不同培养基不同时点细胞计数(每厘米脐带)
2.3 不同培养基及不同时间段对原代细胞培养的影响 通过三种不同培养基进行原代干细胞培养发现:在三种培养基中C组培养为最佳;B组次之,A组一般。
采用SPSS 13.0统计软件进行重复测量方差分析,结果显示,三种不同培养基及不同时间段比较,P<0.05,差异具有统计学意义。结果还显示,P值(Sig)均<0.05。
认为DMEM低糖和DMEM高糖、DMEM高糖和DMEM/F12、DMEM/F12和DMEM低糖三组之间对比对细胞生长差别有统计学意义。
3 讨论
人脐带间充质干细胞 (human umbilical cord mesenchymal stem cells,HUC-MSCs)起源于成体干细胞的中胚层,来源于脐带的华尔通胶或叫沃顿胶(whartoncs jelly,WJ),是具有自我更新和多向分化的多能干细胞,参与神经的修复,促进多种有利因子的产生,在其组织内可以进行迁移、整合、调节、分泌等作用,在脊髓损伤的修复治疗方面较其他干细胞治疗更具有明显优势[3-11],成为目前干细胞研究的焦点和热点。
脐带处理要求清洗干净,必须选择足月剖腹产健康胎儿的新鲜脐带,低温保存4 h内处理,时间越短越好,最好不要超过24 h;李铎等[12]对脐带进行24 h内处理,HUC-MSCs获得量及分离成功率高,随时间延长获得量减少,分离成功率降低。窦慧慧[13]应用MesencultTM培养基对原代细胞进行培养发现细胞培养成功率达到100%;但其价格较高,适于专业干细胞技术人员。
人脐带间充质干细胞原代培养对培养基的选择十分重要[14-16],对今后培养成功起着关键决定性作用;一般科研院校学生应用DMEM/F12培养基已足够,价格低,经济实惠;应用MesencultTM培养基价格太高。FBS浓度一般控制在10%~20%,该研究经过多次浓度配比比较发现采用15%的培养基效果较好。个别干细胞需要更高浓度的培养基。A组加15%FBS加1%青链霉素双抗,行人脐带华通胶原代培养时间一般情况下比同期干细胞培养延长3天,细胞生长缓慢,贴壁率低;B组加15%FBS加1%青链霉素双抗,行人脐带华通胶原代培养一般情况下最早开始5 d就可见干细胞贴壁生长,10 d左右干细胞自组织块游离出来越来越多,14 d开始贴壁生长逐渐旺盛,22 d左右细胞生长开始逐渐变得缓慢;C组加15%FBS加1%青链霉素双抗,3 d就可见少量干细胞贴壁生长,5 d可见明显生长,7 d左右干细胞自组织块游离出来越来越多,14~22 d左右贴壁生长最为旺盛,比A组B组效果明显。一般情况下17~20 d传代最好,25 d左右贴壁细胞生长变慢,27 d基本停止生长或老化,最长培养35 d细胞贴壁生长未再见明显变化。
通过培养发现细胞生长形态有所不同,A组培养基培养贴壁细胞生长缓慢,排列稀疏,细胞干瘪瘦小,整体体积小;B组培养的细胞生长迅速,细胞体积变大,整体体积明显增大,后期集落群体明显细胞密集;C组培养细胞生长形态均一,胞体饱满,细胞状态及密集度更高,较前两组效果更好;同时发现脐带 MSCs 体外增殖较快较高等多种优点[17,18]。
综上所述,采用DMEM/F12培养基+15%FBS联合培养所取得的原代干细胞形态均一,生长良好,质量较高,成分较纯,解决了原代细胞培养生长不良,游出率较低,细胞较少,成功率较低等难题,对人脐带间充质干细胞原代培养提供了有力依据,为提高实验研究和培养成功率奠定了良好基础[19]。
[1]金正帅.不同时期局部移植人脐带间充质干细胞修复脊髓损伤的组织学观察[J]. 中国组织工程研究,2016,20(45):6714-6719.
[2]马锡慧,冯凯,石炳毅.人脐带间充质干细胞生物学特性及其研究进展[J]. 中国组织工程研究与临床康复,2011,15(32):6064-6067.
[3] CHO JS,PARK SK.Transplantation of mesenchymal stem cells enhances axonal outgrowth and cell survival in an organotypic spinal cord slice culture[J].Neurosci Left,2009,454,(1):43-48.
[4] ALEXANIAN AR,MAIMAN DJ,KURPAD SN,et al.In vitro and in vivo characterization of neurally modifiers and neural stem cell environment[J].Stem Cells Dev,2008,17(6):1123-1130.
[5] ROONEY GE,MORAN C,MCMAHON SS,et al.Gene-modifired mesenchymal stem cells express functionally active nerve growth factor on an engineered poly lactic glycolic acid(PLGA) substrate[J].Tissue Eng Part A,2008,14(5):681-690.
[6] WRIGHT,MASRI WE,OSMAN A,et al.The cell culture expansion of bone marrow stromal cells from humans with spinal cord injury:implications for future cell transplantation therapy[J].Spinal Cord,2008,46(12):811-817.
[7] CAO FJ,FENG SQ.Human umbilical cord mesenchymal stem cells and the treatment of spinal cord injury[J].Chn Med J(Engl),2009,122(2):225-231.
[8]赵鹏,冯世庆,王颖,等.不同浓度人脐带间充质干细胞移植修复大鼠脊髓损伤的实验研究[J].中国矫形外科杂志,2010,11(21):1817-1821.
[9]魏开斌,卓锋,刘红,等.移植脐带间充质干细胞治疗脊髓损伤的实验研究[J]. 中国矫形外科杂志,2012,20(22):2081-2085.
[10]高健伟,魏开斌.人脐带间充质干细胞治疗脊髓损伤的研究进展[J]. 中国矫形外科杂志,2013,21(6):582-586.
[11]余永涛,钟德君.移植人脐带间充质干细胞修复大鼠脊髓损伤的疗效[J]. 生物技术世界,2016(4):113.
[12]李铎,石钏,洪敬欣,等.组织块法分离人脐带间充质干细胞的研究[J]. 中国医药导报,2011,8(24):19-22.
[13]窦慧慧,郭文君,于丽,等.人脐带间充质干细胞分离培养方法的研究[J]. 中国组织工程研究与临床康复,2010,14(19):186-189.
[14]韩晓燕,汪伟民.人脐带间充质干细胞的体外培养及其对大鼠血液指标的影响[J]. 安徽医学,2015,36(8):911-914.
[15]王菲,周洪,郭昱成,等.原代人脐带间充质干细胞培养方法的研究[J]. 中国组织工程研究,2014,18(19):3042-3047.
[16]胡培,王小莉,李东升,等.人脐带间充质干细胞的分离培养与鉴定[J]. 生物技术通讯,2014,25(1):87-90.
[17] FU YS,SH IH YT,CHENG TC,et al.Transformation of human umbilical mesenchymal cells into neurons in vitro[J].J Biomde Sci,2004,5(6):652-660.
[18] MITCHELL KE,WEISS ML,MITCHELL BM,et al.Matrix cells from Wharton’s jelly from neurons and glia[J].Stem Cells,2003,21(1):50-60.
[19]李嘉,尹春艳.人脐带间充质干细胞在临床治疗中的研究进展[J]. 医学综述,2016,22(10):1931-1934.
