肝脏上皮样血管平滑肌脂肪瘤的MRI表现及误诊分析
2018-06-15刘孝臣徐鹏举胡国祥房文皓吴平沈春林
刘孝臣,徐鹏举,胡国祥,房文皓,吴平,沈春林
1.海安县人民医院影像科,江苏海安 226600;2.上海复旦大学附属中山医院放射科,上海 200032;3.长沙市中心医院放射科,湖南长沙 410004;
血管平滑肌脂肪瘤(angiomyolipoma,AML)是一种少见的间叶源性肿瘤,2004年WHO将其分为经典型和上皮样型[1],最常见于肾脏,其次为肝脏[2],经典型AML具有较多脂肪成分容易诊断,而肝脏上皮样血管平滑肌脂肪瘤(hepatic epithelioid angiomyolipoma,HEAML)含少量脂肪或不含脂肪,临床表现缺乏特异性,且具有恶变潜质,预后尚不明确,误诊率较高,国内系统报道较少,大部分为个案报道。本研究回顾性分析18例HEAML患者的临床及影像学资料,探讨其影像学表现,分析误诊原因,以提高诊断的准确性。
1 资料与方法
1.1 研究对象 回顾性分析2013年6月-2016年6月复旦大学附属中山医院经病理证实的 18例HEAML患者,其中女15例,男3例;年龄32~67岁,平均(44±9)岁;14例体检发现,2例腰痛,1例腹痛不适,1例发热盗汗;18例患者均无肝炎、肝硬化病史,其中2例患有脂肪肝,肿瘤标志物甲胎蛋白(αfetoprotein,AFP)均为阴性。
1.2 仪器与方法 采用Siemens AERA 1.5T MR仪,采用8通道相控阵体部表面线圈,扫描序列及参数:①平扫2次屏气二维快速小角度激发梯度回波T1WI横断位,层厚5~7 mm,层间距1.5~2.1 mm;②平扫呼吸导航快速自旋回波T2WI抑脂横断位,层厚5~7 mm,层间距1.5~2.1 mm;③扩散加权成像(DWI):采用单次激发自旋回波序列,b值为0、500 s/mm2,层厚5~7 mm;④3D-VIBE序列增强扫描:经肘静脉注射对比剂马根维显(Gd-DTPA),剂量0.2 mmol/kg,速度2 ml/s,于25~30 s、70~90 s、180 s行动脉期、门静脉期、平衡期扫描。
1.3 图像分析 影像资料传至PACS系统,由2名从事腹部影像诊断的主治医师和副主任医师共同阅片,协商达成意见统一,主要观察和记录病变部位、数量、大小、形态、包膜、含脂肪情况、引流静脉、病灶内血管及MRI平扫信号与强化特点。
2 结果
2.1 临床资料 18例HEAML患者中,单发16例,1例2枚病灶,1例3枚病灶,共21枚,其中位于左叶11枚(II段3枚,III段、IV段各4枚)、右叶8枚(V段、VI段各3枚,VII段、VIII段各1枚)、尾叶(I段)2枚,21枚病灶中12枚呈类圆形,9枚呈类椭圆形,境界均清楚,肿瘤最大约18.2 cm×23.1 cm,最小者直径约1.2 cm,术前11例(61.1%)误诊,其中5例误诊为肝细胞肝癌(hepatocellular carcinoma,HCC),3例误诊为肝腺瘤(hepatocellular adenoma,HCA),2例误诊为转移瘤,1例误诊为肝脏局灶性结节增生(focal nodular hyperplasia,FNH)。
2.2 MRI表现 MRI平扫T1WI以低信号为主,其中8枚病灶含有不同比例脂肪,T1WI呈高低混杂信号,8枚病灶抑脂信号均有减低,其中4枚病灶反相位亦有不同程度信号减低(长径4.0~23.1 cm,平均11.0 cm,图1A~C);T2WI呈高信号17枚,高低混杂信号4枚;DWI均呈不同程度高信号,15枚病灶ADC图为低信号,6枚ADC图为高信号。增强扫描18枚动脉期明显强化,其中门静脉期及延迟期持续强化,高于肝实质信号,14枚(66.7%)呈“快进慢出”(图2)、门静脉期及延迟期强化减退,低于肝实质信号,7枚(33.3%)呈“快进快出”(图3、4)。
18例患者中,动脉期见引流静脉显影9例,肝左静脉4例(图5C),肝右、肝中静脉各1例,3例引流至下腔静脉。
17枚(81.0%)病灶增强扫描后见增粗畸形血管影(图1D)。6枚(28.6%)病灶见“假包膜”(图3、4),T1WI呈低信号,增强扫描后延迟强化。
2.3 HEAML病理与免疫组化 大体标本:肿瘤组织无包膜,与周围组织分界清晰,切面呈灰白、灰黄、灰红、灰褐色,大多质软,3枚质中,周围肝组织均未见结节性肝硬化征象,4枚病灶边缘见受压肝实质,2枚病灶见坏死,1枚病灶见出血。镜检:肿瘤组织呈弥漫片状、多边形分布,由窦隙状薄壁血管网所分隔,胞质丰富,嗜酸性,核仁明显(图1E),不易见核分裂,1例见5个/50HPF。
免疫组化:抗黑色素瘤特异性抗体(HMB-45)均为阳性(+~+++),平滑肌抗体(SMA)均呈阳性(+),13例S-100蛋白检查中10例阳性(+),Ki-67(2%~30%),上皮细胞标记(CK7、C19)、AFP均为阴性。
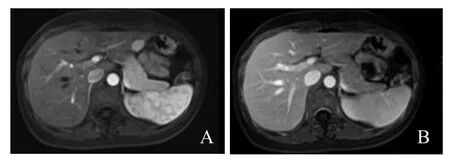
图3 女,41岁,肝左外叶HEAML误诊为HCC。病灶呈“快进快出”,动脉期病灶明显强化(A);门静脉期强化减退(B),周围见包膜

图4 女,40岁,肝右前叶HEAML误诊为HCA。病灶呈“快进快出”,动脉期病灶明显均匀强化(A);门静脉期强化减退(B),信号不均,有包膜

图5 男,46岁,肝左叶HEAML。T2WI呈高信号(A);DWI呈高信号(B);增强扫描动脉期肝左静脉提前显影(箭,C)
3 讨论
肝脏AML是由血管、平滑肌、脂肪3种成分不同比例组成的肿瘤,而HEAML为其罕见亚型,具有潜在恶性生物学行为[3],本组患者截至研究未发现有复发及转移病例。
3.1 临床表现与病理 HEAML好发于中年女性,男女比例约1∶5,与文献报道[4]基本一致,大多单发,临床症状缺乏特异性,少数患者出现腹痛[5-6]。本组18例患者中,女性15例,平均年龄(44±9)岁,单发16例,14例体检发现,3例表现为腰痛、腹部不适,与既往报道基本相符;病灶分布未见明显规律性,每段均可发生;HEAML与肝炎、肝硬化、肿瘤家族史无明显相关性,AFP为阴性[7],与文献报道基本一致。
大体标本显示HEAML多无明显包膜,境界清楚,切面多呈灰白、灰红色,质软,少数伴有坏死、囊变和出血。镜检:肿瘤组织主要由多边形上皮样平滑肌细胞构成,排列成梁索样结构,由窦隙状薄壁血管网所分隔,不含或仅含少量成熟脂肪细胞,胞质丰富,嗜酸性,核仁明显,核分裂少见[2]。HEAML是血管周上皮样细胞瘤家族成员,主要表现为黑色素细胞标记(HBM-45、Melan A)阳性表达,SMA部分阳性表达,CK不表达[8]。本研究结果与上述报道基本一致。
3.2 HEAML的MRI表现
3.2.1 平扫表现 HEAML的MRI信号取决于肿瘤含血管、平滑肌、上皮成分比例,部分病灶可见少量脂肪,甚至不含脂肪,HEAML病灶为上皮样平滑肌细胞,含有脂肪成分少,不易被影像检查发现,本组21枚病灶中,13枚(61.9%)在MRI图像上未见脂肪成分,其中有9枚病灶在病理上找到脂肪细胞;另外8枚(38.1%)在MRI图像上发现不同比例脂肪成分,T1WI呈高低混杂信号,抑脂信号均有减低,其中4枚反相位亦有不同程度信号减低,Xu等[9]研究发现大多数HEAML完全没有脂肪,可以作为区别于非上皮样AML的特征表现。赵燕风等[10]研究认为上皮样 AML与非上皮样AML并不能决定脂肪含量的多少,本组数据符合后者;T2WI呈高信号17枚,高低混杂信号4枚,对比其他各序列显示更高信号为慢血流小血管影及部分坏死区,低信号为粗大流空血管影;DWI均呈不同程度均匀或不均匀高信号,脂肪组织呈低信号。
3.2.2 增强扫描表现 MRI增强扫描动脉期呈明显均匀或不均匀强化,由于HEAML含有上皮样平滑肌组织和不同程度纡曲、扩张的血管网,血管网越丰富,动脉期强化越明显[11],病灶内血管大多为静脉结构血管,可位于病灶边缘或内部,并与引流静脉相连,大多引流至肝静脉、门静脉、下腔静脉[12],本组21枚病灶中,18枚动脉期明显强化;18例患者中,9例可见引流静脉动脉期显影,17枚病灶可见中心增粗血管影,动脉期及门静脉期显示较清楚,与文献报道相符;由于肿瘤血管较粗,血管缓慢,造影剂滞留时间较长,而且肿瘤血管壁较厚,造影剂扩散至血管外间隙需要较长时间,故门静脉期及延迟期肿瘤呈相对肝实质高信号,即“快进慢出”具有一定特征性,本组呈“快进慢出”14枚。Jeon等[12]报道一部分病灶肿瘤细胞周围间质较少,含有丰富的血管网,而且管壁较薄,血流速度增加,造影剂扩散加快,门静脉期及延迟期呈相对肝实质低信号,即“快进快出”。本组呈“快进快出”7枚。病理结果显示HEAML无包膜,肿瘤生长过程中可以对周围肝脏组织形成推压,增强扫描后门静脉期及延迟期有强化,形成所谓“假包膜”[9],本组6枚病灶见“假包膜”,病理标本大体观及镜下仅1枚见部分带包膜,其余病灶周围门静脉期及延迟期强化影,部分为粗大强化的引流血管,部分为被挤压的肝实质和疏松的结缔组织。
3.3 鉴别诊断与误诊分析 ①HCC:本组 11例误诊病例中,5例误诊为HCC,误诊原因为此5例均表现为“快进快出”,延迟期有“假包膜”,与HCC表现相似。HCC患者多见于中老年男性,一般有乙肝、肝硬化病史,常伴有AFP升高;而HEAML以中年女性多见,无乙肝、肝硬化病史,AFP正常[8]。增强扫描动脉期HCC由动脉供血,病灶内为动脉血管,门静脉期及延迟期不会显示;而HEAML病灶周围和中心为增粗纡曲的静脉,早期有引流静脉显影[13],门静脉期及延迟期病灶周围和中心静脉持续强化,动脉期病灶强化程度低于HCC[14];HCC病灶内脂肪变性为细胞内脂肪,化学位移成像技术显示反相位信号减低,而HEAML中的脂肪为成熟脂肪,抑脂序列信号减低;HCC强化方式为“快进快出”,后期多见包膜强化,而HEAML多为“快进慢出”,可出现“假包膜”。②HCA:本组11例误诊病例中,3例误诊为HCA,误诊原因为3例均为中年女性,无临床症状及肝炎、肝硬化病史,AFP正常,强化方式为“快进快出”,后期有“假包膜”,与HCA表现相似。HCA常见于青年女性,多与服用类固醇激素有关,可伴有出血、囊变、脂肪变性,多有包膜;而HEAML一般无临床病史,少有出血、囊变,另外含有成熟脂肪,引流静脉早显及病灶内或周围增粗静脉可支持HEAML的诊断。③FNH:本组11例误诊病例中,1例3枚病灶误诊为FNH,误诊原因为病灶直径均<3 cm,增强“快进慢出”、无包膜、延迟期病灶内线状强化影误认为瘢痕。FNH平扫T1WI呈等或稍低信号,T2WI呈等或稍高信号,增强扫描动脉期明显强化,门静脉期及延迟期强化减低,无包膜样强化,病灶中央见延迟强化的星芒状瘢痕影,而HEAML中心无瘢痕,病灶内畸形静脉持续强化,动脉期有引流静脉早显。如果遇到不典型病灶,可通过肝胆特异性对比剂进行鉴别,FNH为高信号,而HEAML为低信号。④肝转移瘤:本组11例误诊病例中,2例误诊为转移瘤,误诊原因为2例病灶比较小,直径均<2 cm,增强扫描后呈持续环形强化,病灶内未见明显畸形静脉影。转移瘤一般有原发肿瘤病史,且无病灶内畸形静脉及引流静脉早显。
总之,HEAML好发于中年女性,以单发、境界清、乏脂或无脂、“快进慢出”强化方式为特征,引流静脉早显以及病灶内畸形静脉血管有助于诊断。
[1] Walker RA. World Health Organization classification of tumours. Pathology and genetics of tumours of the breast and female genital organs. Histopathology, 2005, 46(2): 229.
[2] Armah HB, Parwani AV. Perivascular epithelioid cell tumor.Arch Pathol Lab Med, 2009, 133(4): 648-654.
[3] Xie L, Jessurun J, Manivel JC, et al. Hepatic epithelioid angiomyolipoma with trabecular growth pattern: a mimic of hepatocellular carcinoma on fine needle aspiration cytology.Diagn Cytopathol, 2012, 40(7): 639-650.
[4] 吴秀丽, 刘歆军. 肝脏血管平滑肌脂肪瘤的 CT诊断. 中国医学影像学杂志, 2009, 17(6): 469-472.
[5] Mai KT, Belanger EC. Perivascular epithelioid cell tumor(PEComa) of the soft tissue. Pathology, 2006, 38(5): 415-420.
[6] Yamasaki S, Tanaka S, Fujii H, et al. Monotypic epithelioid angiomyolipoma of the liver. Histopathology, 2000, 36(5): 451-456.
[7] Cai PQ, Wu YP, Xie CM, et al. Hepatica angiomyolipoma: CT and MRI imaging findings with clinical-pathologic comaparison. Abdomen Imaging, 2013, 38(3): 482-489.
[8] Patra S, Vij M, Kota V, et al. Pigmented perivascular epithelioid cell tumor of the liver: report of a rare case with brief review of literature. J Cancer Res Ther, 2013, 9(2): 305-307.
[9] Xu PJ, Shan Y, Yan FH, et al. Epithelioid angiomyolipoma of the liver: cross-sectional imaging findings of 10 immunohistochemically-verified eades. World J Gastroenterol, 2009, 15(36): 4576-4581.
[10] 赵燕风, 欧阳汉, 王小艺, 等. 肝脏血管平滑肌脂肪瘤MRI表现. 放射学实践, 2014, 29(1): 64-68.
[11] Dai CL, Xue LP, Li YM. Multi-slice computed tomography manifestations of hepatic epitheliold angiomyolipoma. World J Gastroenterol, 2014, 20(12): 3364-3368.
[12] Jeon TY, Kim SH, Lim HK, et al. Assessment of triple-phase CT findings for the differentiation of fat-deficient hepatic angiomyolipoma from hepatocellular carcinoma in noncirrhotic liver. Eur J Radiol, 2010, 73(3): 601-606.
[13] Ji JS, Lu CY, Wang ZF, et al. Epithelioid angiomyolipoma of the liver:CT and MRI features. Abdom Imaging, 2013, 38(2): 309-314.
[14] 王胜裕, 蒯新平, 王鹏, 等. CT对肝血管平滑肌脂肪瘤与肝细胞肝癌的鉴别诊断价值. 中国医学影像学杂志, 2013, 21(12): 924-927.
