KISS-1基因表达物对骨肉瘤细胞凋亡和自噬调控机制的研究
2018-06-15刘晓强吴华明谢惠姚熙四川省资阳市安岳县人民医院骨科四川资阳642350
刘晓强,吴华明,谢惠,姚熙四川省资阳市安岳县人民医院骨科,四川资阳 642350
骨肉瘤是一种罕见的原发性骨肿瘤,在美国占不到1%[1]。然而,它是儿童和年轻人中最常见的原发性骨恶性肿瘤,约占3.4%,占所有儿童癌症和儿童骨恶性肿瘤的大部分[2]。手术切除肿瘤是治疗的基该组成部分,化疗已被证明可以改善骨肉瘤患者的生存[3]。然而,骨肉瘤患者的生存率一直保持在3年前的约60%,复发的患者中有85%发生早期肺部转移[4]。既往文献显示,骨肉瘤转移的发生与 KISS-1/G蛋白偶联受体54(GPR54)表达异常相关[5]。肿瘤转移抑制基因 KISS-1作为肿瘤抑制基因在许多肿瘤中都有被证明,如肝癌[6]、乳腺癌[7]、结肠及直肠癌[8]。在骨肉瘤体外培养细胞中,Kiss-1基因表达对细胞增殖和侵袭能力呈负相关[9],此外,Kiss-1基因转染和过表达后,对人骨肉瘤细胞的增殖和入侵能力可能有所下降。该研究在设计时考虑到这些发现,该实验于2016年4月—2017年1月在该院细胞实验室进行,应用K7M2骨肉瘤细胞系进行研究,分别向其加入KISS1基因表达物--Kp或抗Kp蛋白,并分别与普通K7M2细胞体系进行比较,了解骨肉瘤细胞在KISS-1基因表达物的影响下的增殖、凋亡和自噬作用。
1 材料与方法
1.1 主要材料
人骨肉瘤K7M2细胞,KISS1蛋白--Kp及抗Kp蛋白,流式细胞仪,cDNA合成试剂盒,RNA提取试剂盒,SYBR Premix EX Taq和定量PCR试剂盒,MTT试剂盒。
1.2 方法
细胞培养24、48、72 h和96 h后,用MTT染色法检查每个培养瓶细胞的增殖情况,流式细胞检测仪分析细胞凋亡情况。RT-PCR检测培养72 h后的凋亡标记物(P53、CytC)及自噬标记物(P62、Beclin1)的 mRNA表达水平。
1.2.1 分组 对数生长期的骨肉瘤细胞K7M2在分别在加入 Kp(100 nmol/L)或者抗 Kp蛋白(100 nmol/L)的培养液中培养,并将其对应地分为Kp组及Anti-Kp组,且以普通培养的K7M2细胞形成控制对照组。
1.2.2 细胞传代及培养 加0.25%胰蛋白酶消化后,加入含10%FBS的DMEM悬液细胞,悬液1 000 rpm×5 min离心,弃上清加入常规培养液重悬,以1×105/mL接种于新的培养瓶,将培养瓶置入37℃、5%CO2的饱和湿度培养箱内培养,以后隔日换液,并适时拍照记录。
1.2.3 细胞增长率检测 胰蛋白酶消化法收集细胞,96孔板每孔放置1×106/mL的悬浮细胞100 μL,细胞于37℃ 5%CO2分别孵育 24、48、72、96 h 后,分别加入 10 μL的MTT溶液5 mg/mL后继续孵育4 h。离心,每孔加入150 μL二甲基亚砜,低速振荡8 min使结晶物充分溶解后,在酶联免疫检测仪OD 490 nm测量各孔的吸光值,重复3次取平均值。
1.2.4 细胞凋亡率检测 细胞接种后,于37℃5%CO2分别孵育24、48、72、96 h后,分别收集各时段细胞并PBS洗涤一次。用4%多聚甲醛固定细胞30 min,PBS洗涤,用含0.1%Triton X-100的PBS重悬细胞,冰育2 min后,再次PBS洗涤1次,加入50 μL的TUNEL检测液(TdT酶+荧光标记液+TUNEL检测液),37℃避光孵育60 min,PBS悬浮,在细胞流式细胞仪进行检测。
1.2.5 P53、CytC和P62、Beclin1的mRNA表达检测细胞接种72 h后,RNA提取试剂盒提取RNA,cDNA第一链试剂盒合成cDNA第一链。由Takara生物合成各引物(PCR 引物:p53:正向 5'-tacatgtgttaacagttcctgca-3';反向引物 5'-ttctgacaacgatcggagga-3';温度 55℃;CytC:正向引物 5'-GATTGACCAGGAAGCTGCAG-3',反向引物5'-CCACCAAAATCTCCTGCGTT-3';温度55℃;P62正向引物 5'-GACTACGACTTGTGTAGCGTC-3',反向引物 5'-AGTGTCCGTGTTTCACCTTCC-3';Beclin1:正向引物5'-CGGGATCCATGGAAGGGTCTAAGACGTCC-3',反向引物5'-CGGAATTCTCATTTGTTATAAAATTG TGAGG-3';温度 55℃)。 由 2.5 μL 5×缓冲+1.5 μL 氯化镁+0.5+1 μdNTPμL L GAP-43 的正义和反义引物+0.3 μL Taq 酶+2 μcDNA 模板和水的反应 25 μL,条件 95℃ 5 min,95℃ 30 s、62℃ 30 s、72℃ 30 s, 重复循环35次,最终以72℃10 min延伸。后行琼脂糖凝胶电泳,紫外灯下观察结果,采用凝胶图像分析系统,对电泳条带进行密度扫描。
1.3 统计方法
采用SPSS 24统计学软件进行统计分析。所有计量数据以均数±标准差(±s)表示,采用方差分析(ANOVA)方法进行分析比较,采用LSD-t法进行检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞培养24、48、72、96 h后增殖率的比较
在对照组和Anti-Kp组的细胞增殖率处于增长状态,Anti-Kp组的细胞增殖率明显高于对照组,差异有统计学意义(P<0.05),在控制组和 Kp组比较中,Kp组的细胞增殖率明显低于对照组,且随时间推移呈现下降趋势,差异有统计学意义(P<0.05),见表 1。
表 1 各组细胞的增殖率[(±s),%]
注:Kp 组与对照组比较,P<0.05;Anti-Kp 组与对照组比较,P<0.05。
组别24 h 48 h 72 h 96 h对照组Kp组Anti-Kp 组0.660±0.075 0.530±0.083 0.677±0.093 0.818±0.095 0.468±0.088 0.905±0.121 1.105±0.167 0.377±0.058 1.217±0.142 1.330±0.214 0.328±0.044 1.465±0.194
2.2 细胞培养 24、48、72、96 h凋亡率的比较
在Kp组的细胞凋亡率处于上升状态,对照组和Anti-Kp组的细胞凋亡率变化不明显。Kp组与对照组比较,差异有统计学意义(P<0.05),见表 2。
表 2 各组细胞凋亡率[(±s),%]

表 2 各组细胞凋亡率[(±s),%]
注:Kp组与对照组比较,P<0.05。
组别24 h 48 h 72 h 96 h对照值Kp值Anti-Kp 值15.89±2.73 24.53±3.65 8.65±1.47 15.67±2.58 27.54±4.65 9.18±1.47 16.28±2.40 35.77±5.03 8.60±1.68 16.53±2.68 39.75±8.32 9.37±1.39
2.3 P53、Cytc、P62、Beclin1 的 mRNA 表达水平比较
细胞接种培养72 h后,Kp组的凋亡标记物(P53、Cytc)和自噬标记物(P62、Beclin1)的 mRNA 表达明显高于对照组,差异有统计学意义(P<0.05)。Anti-Kp组凋亡标记物(P53、Cytc )和自噬标记物(P62、Beclin1)的mRNA表达明显低于对照组,两组差异有统计学意义(P<0.05),见表 3。
表 3 P53、P62、Cytc、Beclin1 的 mRNA 表达水平(±s)

表 3 P53、P62、Cytc、Beclin1 的 mRNA 表达水平(±s)
注:Kp 组与控制组 P53、P62、Cytc、Beclin1 的 mRNA 表达的比较,P<0.05;Anti-Kp 组与控制组 P53、P62、Cytc、Beclin1 的 mRNA 表达的比较,P<0.05。
组别P53CytC P62 Beclin1 Kp值对照值Anti-Kp值0.393±0.107 0.213±0.045 0144±0.044 0.509±0.145 0.220±0.046 0.124±0.048 0.426±0.120 0.169±0.055 0.096±0.018 0.357±0.103 0.120±0.043 0.077±0.019
2.4 方差分析 P53、P62、Cytc、Beclin1 的 mRNA 表达差异性比较
细胞接种培养72 h后行(ANOVA)方法进行组间比较,在 Kp 组或者 Anti-Kp 组内 P53、P62、Cytc、Beclin1各自的mRNA表达量差异无统计学意义(P>0.05)(表4),说明Kp或Anti-Kp对它们的促进或者抑制各基因表达的作用强度在统计学上没有明显差异性。
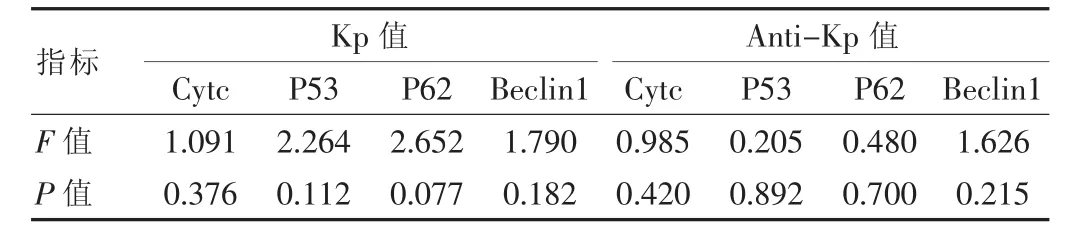
表4 方差分析P53、P62、Cytc、Beclin1的mRNA表达差异性比较
3 讨论
KISS-1基因主要表达在胎盘组织中,但也可以表达于中枢神经系统、睾丸、卵巢、胰腺和小肠[10],近年研究发现,KISS-1基因在肿瘤的发生、发展过程中起着重要的作用[11]。Kp是GPR54的内源性配体,是KISS-1翻译产物。Kp和GPR54之间的相互作用可以激活受体,通过信号传导通路在细胞内引起一系列的影响,包括激活磷脂酶,钙内流和胶原酶活性的调节,激活PI释放花生四烯酸,活化的MAPK网络和细胞外信号调节蛋白激酶1和2(ERK1和ERK2)[12]。然而,同样的相互作用,也可以抑制趋化活性[13]。抗Kp蛋白具有拮抗Kp的作用,达到抑制Kp功能的能力。
该研究结果显示,细胞培养96 h后,对照组细胞增殖率均数百分比由(0.660±0.075)%变为(1.330±0.214)%,Anti-Kp组细胞增殖率均数百分比由(0.677±0.093)%变为(1.465±0.194)%,而 Kp 组细胞增殖率均数百分比由(0.530±0.083)%变为(0.328±0.044)%,对照组和Anti-Kp组细胞增殖率随时间延长而增加,而Kp组细胞增殖率呈下降趋势。此外,Anti-Kp组细胞增殖率高于对照组,而Kp组细胞增殖率最低。基于此,似乎KISS-1表达物具有抑制骨肉瘤细胞增殖的作用,可以作为抑癌基因发挥抑癌作用。KISS-1基因表达物也显示在骨肉瘤细胞凋亡中具有重要作用,对照组随时间变化凋亡率无明显差异,而在Kp组细胞凋亡率均数百分比由(24.53±3.65)%变为(39.75±8.32)%,细胞凋亡率最高,而在Anti-Kp组凋亡率均数百分比由(8.65±1.47)%变为(9.37±1.39)%,变化率最低,故此可以认为,Kp蛋白可能具有促进细胞凋亡的作用,也可认为KISS-1基因表达物在骨肉瘤细胞的凋亡中起着一定的作用,且有利于骨肉瘤细胞的凋亡。同理,也就意味着在机体中,KISS-1基因可能促进骨肉瘤细胞的凋亡作用,进而起到减缓骨肉瘤发生、发展的能力。
凋亡基因P53和CytC在真核细胞促进细胞凋亡中起重要的作用,具有决定细胞凋亡的作用。在该次的研究与对照组相比显示,细胞接种培养72 h后,对照组的 P53和 CytC的 mRNA表达水平均数为 (0.213±0.045)和(0.220±0.046),Kp 组 P53 和 CytC 的 mRNA 表达量均数为(0.393±0.107)和(0.509±0.145),可见对照组P53、CytC基因的相对表达水平基本保持不变,而Kp组的P53、CytC基因的mRNA表达水平升高,Anti-Kp组的P53、CytC基因的mRNA表达水平减低,另外,对照组和Anti-Kp组细胞凋亡率较低,故此,可以认为Kp蛋白具有促进凋亡基因P53、CytC表达的能力,进而认为KISS-1基因在机体中的表达具有促进凋亡基因(P53、CytC)表达,以此来达到抑制骨肉瘤的发展。
自噬不同于凋亡,具有典型的自噬体在细胞内形成,Beclin1作为细胞的自噬基因在细胞自噬方面发挥重要的作用[14]。PI3K复合物III激活自噬体的形成,引导相关蛋白Beclin1发生自噬反应[15]。P62与Beclin1密切相关,且同时作为细胞自噬标记基因[16]。细胞在培养过程中,P62和Beclin1在控制组的mRNA表达量均数为(0.169±0.055)和(0.120±0.043),而在 Kp 组 P62 和Beclin1mRNA 表达量均数为(0.426±0.120)和(0.357±0.103)。相对表达水平的P62和Beclin1基因在控制组无明显变化,但在Kp组P62和Beclin1 mRNA表达水平明显升高,提示Kp蛋白可能具有促进自噬基因(P62、Beclin1)表达的能力,在培养中具有促进骨肉瘤细胞的自噬反应。
综上所述,可以看出KISS-1基因表达物具有抑制骨肉瘤增殖、促进细胞凋亡的作用,同时还能促进凋亡基因(P53 和 CytC)和自噬基因(P62、Beclin1)的表达作用,通过加快凋亡和自噬过程抑制骨肉瘤细胞增殖。在该研究中发现,抗Kp蛋白具有拮抗KISS-1基因的表达蛋白Kp的功能表现,也进一步证明KISS-1基因的抑癌作用,其有望成为一个新的骨肉瘤药物治疗的靶点。
[1]Bennion NR,Baine MJ,Malouff T,et al.Osteosarcoma of the Larynx:Treatment Outcomes and Patterns of Failure Analysis[J].Rare Tumors,2017,9(1):6955.
[2]Spix C,Grosche B,Bleher M,et al.Background gamma radiation and childhood cancer in Germany:an ecological study[J].Radiation&Environmental Biophysics,2017,56(1):1-12.
[3]Berner K,Hall KS,Monge OR,et al.Prognostic factors and treatment results of high-grade osteosarcoma in norway:a scope beyond the"classical"patient[J].Sarcoma,2015(3):1-14.
[4]Matsubara E,Mori T,Koga T,et al.Metastasectomy of Pulmonary Metastases from Osteosarcoma:Prognostic Factors and Indication for Repeat Metastasectomy[J].Journal of Respiratory Medicine,2015:1-5.
[5]Khan MH,Hazarika SB,Perumal Pl.Kiss 1 and GPR54 mRNA expression,endocrine profile,follicular development and onset of estrus following kisspeptin administration in prepubertal mithun heifers[J].Indian Journal of Animal Sciences,2017,87(4):427-431.
[6]Song WW,Gui A Pl.Expressions of HIF and KISS-1 in patients with liver cancer and correlation analysis[J].European Review for Medical&Pharmacological Sciences,2017,21(18):4058.
[7]Kaverina N,Borovjagin AV,Kadagidze Z.Astrocytes promote progression of breast cancer metastases to the brain via a KISS1-mediated autophagy[J].Autophagy,2017:1.
[8]Mousavi AR,Hashemzadeh S,Behrouz SS.Aberrant methylated EDNRB can act as a potential diagnostic biomarker in sporadic colorectal cancer while KISS1 is controversial[J].Bioengineered,2017:1-10.
[9]Yin Y,Tang L,Shi L.The metastasis suppressor gene KISS-1 regulates osteosarcoma apoptosis and autophagy processes[J].Molecular Medicine Reports,2017,15(3):1286.
[10]Shahi N,Singh AK,Sahoo M,et al.Molecular cloning,characterization and expression profile of kisspeptin1 and kisspeptin1 receptor at brain-pituitary-gonad(BPG)axis of golden mahseer,Tor putitora (Hamilton,1822)during gonadal development[J].Comparative Biochemistry&Physiology Part B Biochemistry&Molecular Biology,2017,205:13-29.
[11]Kaverina N,Borovjagin AV,Kadagidze Zl.Astrocytes promote progression of breast cancer metastases to the brain via a KISS1-mediated autophagy[J].Autophagy,2017:1.
[12]Peng J,Tang M,Zhang BP.Kisspeptin stimulates progesterone secretion via the Erk1/2 mitogen-activated protein kinase signaling pathway in rat luteal cells[J].Fertility&Sterility,2013,99(5):1436.
[13] Quevedo EG,Aguilar GM,Aguilar LA.Polymorphisms rs12998 and rs5780218 in KiSS1 suppressor metastasis gene in Mexican patients with breast cancer[J].Disease Markers,2015,2015(12):365845.
[14]Qi JJ,Han XF,Cai XL,et al.[Expression and clinical significance of autophagy-related gene Beclin1 and P62 in nasal polyps][J].Zhonghua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi,2016,51(6):428-432.
[15]Wang S,Jie L,Du Y,et al.The Class I PI3K Inhibitor S14161 induces autophagy in malignant blood cells by modulating the Beclin 1/Vps34 complex[J].Journal of Pharmacological Sciences,2017,134(4).
[16]陈飞,余婷婷,李俊.宫颈癌中自噬标记蛋白Beclin1、p62的表达及其临床意义[J].实用癌症杂志,2017,32(2):218-220.
