甘蔗磷脂酰肌醇转运蛋白基因ScSEC14响应干旱和盐胁迫
2018-06-15毛花英苏炜华王文举李聪娜汤翰臣苏亚春阙友雄
毛花英 刘 峰 苏炜华 黄 宁 凌 辉 张 旭 王文举 李聪娜 汤翰臣 苏亚春 阙友雄
甘蔗磷脂酰肌醇转运蛋白基因响应干旱和盐胁迫
毛花英 刘 峰 苏炜华 黄 宁 凌 辉 张 旭 王文举 李聪娜 汤翰臣 苏亚春 阙友雄*
福建农林大学农业部福建甘蔗生物学与遗传育种重点实验室 / 国家甘蔗工程技术研究中心, 福建福州 350002
Sec14-like磷脂酰肌醇转运蛋白(Sec14-like phosphatidylinositol transfer proteins, PITPs), 广泛存在于真核生物细胞中, 参与肌醇磷酸代谢、膜运输、极性生长、信号转导、逆境胁迫等多种重要的生命过程。甘蔗中响应干旱和盐胁迫的Sec14-like基因尚未见报道。本研究从甘蔗受黑穗病胁迫的转录组数据库中获得一条基因序列, 并利用RT-PCR技术克隆得到甘蔗基因cDNA全长序列, 命名为(GenBank登录号为MG571103)。生物信息学分析显示,基因全长1617 bp, 包含一个1008 bp的完整开放阅读框, 编码335个氨基酸; ScSEC14为不稳定的亲水性蛋白, 不存在信号肽; 蛋白二级结构元件多为α-螺旋, 具有典型的SEC14结构域和CRAL_TRIO_N结构域。此外, 系统进化树分析揭示, 该蛋白属于Sec14-like蛋白家族的SSH (soybean Sec14 homolog group)亚家族。亚细胞定位结果表明, ScSEC14蛋白主要定位于细胞膜。实时荧光定量PCR分析发现,基因在甘蔗中组成型表达, 在蔗皮中的表达量最低, 蔗叶中的表达量最高, 约为蔗皮的4.9倍; 该基因在PEG、NaCl、CaCl2和水杨酸(SA)胁迫下的表达量均上调。因此, 甘蔗基因可能参与Ca2+和SA介导的抗逆信号通路, 积极响应逆境胁迫, 尤其调节了干旱和高盐环境下的抗逆性。
甘蔗; Sec14-like磷脂酰肌醇转运蛋白;; 干旱; 盐胁迫
磷酸肌醇是磷脂酰肌醇及其磷酸衍生物的总称, 是一类由磷脂酸与肌醇结合的脂质。磷酸肌醇由一分子的甘油和一分子磷酸结合而成, 并可以通过磷酸化或去磷酸化获得到多种不同衍生物[1,2]。目前, 植物中发现的磷酸肌醇主要包括磷脂酰肌醇-3-磷酸(phosphatidylinositol-3-phosphate, PtdIns3P)、磷脂酰肌醇-4-磷酸(phosphatidylinositol-4-phosphate, PtdIns4P)、磷脂酰肌醇-5-磷酸(phosphatidylinositol- 5-phosphate, PtdIns5P)、磷脂酰肌醇-3,5-二磷酸(phosphatidylinositol-3,5-bisphosphate, PtdIns (3,5) P2)和磷脂酰肌醇-4,5-二磷酸(phosphatidylinositol-4,5- bisphosphate, PtdIns (4,5) P2)[1]。这些植物磷酸肌醇在细胞内特定位置合成, 并被转运到特定的位置发挥功能, 其功能包括: 维持细胞结构、控制膜流动、调节膜物质的转运及调控离子通道和细胞信号转导等[3]。
磷脂酰肌醇转运蛋白(phosphatidylinositol transfer protein, PITP)是真核生物中普遍存在的一种脂质转运蛋白[4]。根据物种来源, 磷脂酰肌醇转运蛋白可被分为哺乳动物和昆虫等多细胞动物的PITP及植物和真菌的PITP两大类[5]。其中植物与真菌PITP的序列同源性高, 但除PITP结构域外, C端还包含其他的结构域, 如GOLD-domain和Nodulin- domain[1]。根据C端结构域的不同, 植物PITP又可以分为三类, 一是只含有磷脂转移功能域的PITP, 如大豆中发现的Ssh1p和Ssh2p, 该类蛋白主要参与渗透调节[6]; 二是C端具有GOLD-domain的PITP, 该类蛋白主要参与细胞分裂和囊泡运输, 如拟南芥AtPATL蛋白[7]和意大利青瓜CpPATL1蛋白[8]; 三是C端具有Nodulin-domain的PITP, 该类蛋白主要与细胞的极性生长有关, 如拟南芥AtSFH蛋白[9]。前人研究显示, 在真核生物细胞内, 该蛋白能够发挥调节真核生物细胞内膜系统间磷脂的转运、调节磷脂信号的传递、调节植物生长发育和响应植物逆境胁迫等功能[5,10]。该基因在不同作物中响应盐胁迫、干旱、低温等均有相关报道。Kiba等[11-12]在本氏烟中鉴定了一个, 该基因在脂质介导的信号途径中参与植物的免疫应答, 随后又发现烟草SEC14磷脂转运蛋白可以通过茉莉酸依赖的防御信号途径来调控植物对假单胞菌的抗性。Kielbowicz- Matuk等[13]报道了抗旱大麦中一个基因, 在种子形成与萌发的特定发育阶段以及不同渗透胁迫下, 其转录水平与蛋白水平均上调表达。苏世超等[14]在普通小麦中克隆了一个基因, 该基因在小麦孕穗期的不同组织中组成型表达, 并受盐、脱落酸、干旱及低温胁迫的诱导。王晓宇等[15]在玉米中分离鉴定了一个基因, 该基因在4℃、盐胁迫、ABA处理时上调表达, 稳定表达该基因则能提高转基因拟南芥植株对冷胁迫的耐受性。Kearns等[6]和Monks等[16]报道了2个大豆磷脂酰肌醇转运蛋白Ssh1p和Ssh2p参与渗透胁迫下植物的应答, 随后又报道了细胞高渗压力下Ssh1p蛋白通过激活蛋白激酶SPK1和SPK2使其快速磷酸化。
甘蔗(spp)是一种重要的糖料作物, 蔗糖占全世界食糖的60%以上, 占我国的90%以上[17]。我国甘蔗主要种植在盐碱地和旱地[18]。研究表明, 在甘蔗生长发育过程中, 干旱胁迫和高盐环境对其萌芽、分蘖、伸长生长、叶片扩展和成熟等进程具有重要的影响, 最终造成蔗茎产量的减少和蔗糖分的降低[19-20]。近年来, 从甘蔗克隆出一些与逆境胁迫有关的基因。例如, 郭晋隆等[21]报道了甘蔗基因, 其参与了甘蔗对干旱、盐和氧化应激反应; 苏亚春等[22-23]报道了2种应激相关基因, 即和, 以及从甘蔗中分离的新型应激诱导基因, 含有该基因的转基因烟草植株对干旱、盐和氧化胁迫具有较高的耐受性; 陈云等[24]报道了一个甘蔗非特异性脂质转运蛋白ScNsLTP, 该基因对适应干旱和低温环境发挥重要作用。
从基因工程角度看, 一旦挖掘鉴定到控制某种优良性状的主效基因, 我们就有可能通过遗传转化途径将其用于改良甘蔗品种的目标性状[25]。迄今为止,基因仅在几种作物中被报道[15,26-27], 国内外均未见在甘蔗中的研究报道。本研究拟以甘蔗受黑穗病胁迫下转录组数据库中基因序列作为探针, 电子克隆的全长cDNA序列; 利用RT-PCR技术扩增验证基因序列的正确性; 并采用实时荧光定量PCR (reverse transcript-qPCR, RT-qPCR)等方法分析该基因在根、侧芽、蔗皮、蔗髓、叶中表达的特异性及其在不同外源胁迫(salicylic acid、CaCl2、PEG、NaCl、CuCl2和CdCl2)下的表达特性。希望能为进一步深入理解基因在甘蔗中的功能表达和作用机制奠定一定基础, 并为甘蔗抗逆性状的基因工程改良提供具有潜在育种利用价值的基因资源。
1 材料与方法
1.1 植物材料及主要试剂
供试甘蔗材料品种ROC22由福建农林大学农业部福建甘蔗生物学与遗传育种重点实验室提供。试剂主要为PrimeScript RT-PCR Kit反转录试剂盒(TaKaRa, 中国大连)、TRIzol Reagent (Invitrogen, USA)、Gel Extracti on Kit (TIANGEN, 中国北京)、SYBRGreen PCR Master Mix Kit (Roche, USA)。
1.2 材料处理和RNA提取
从田间选取生长健壮、长势相似的植株, 砍成单芽茎段, 用流动清水浸泡24 h, 于高温高压灭菌营养土中催芽(16 h/8 h, 光/暗, 28℃), 待4~6叶时取长势一致的蔗苗用于组培苗的诱导, 而后将组培甘蔗幼苗移出并在温室内开放水培一周。设置对照组和试验组, 生物学重复为3次。试验组以5 mmol L–1水杨酸(SA: 3、6和12 h)、50 μmol L–1氯化钙(CaCl2: 3、6和12 h)、25.0% PEG (模拟干旱: 6、12和24 h)、250 mmol L–1氯化钠(NaCl: 6、12和24 h)、500 mmol L–1氯化铜(CuCl2: 12、24和48 h)、500 mmol L–1氯化铬(CdCl2: 12、24和48 h)水溶液培养, 以0 h未处理的蔗苗为对照。以上所有甘蔗材料取样后被立即投入液氮并保存于–80℃冰箱至RNA提取。采用TRIzol法提取所有样品的总RNA, 包括用于甘蔗基因RT-PCR扩增的蔗苗, 用于组织特异性表达分析的甘蔗根、侧芽、蔗皮、蔗髓和叶片组织, 以及用于SA、CaCl2、PEG、NaCl、CuCl2和CdCl26种外源胁迫处理材料。

表1 实时荧光定量材料处理
1.4 甘蔗ScSEC14基因的RT-PCR扩增及序列测定
使用Prime-Script RT Reagent Kit反转录试剂盒合成cDNA作为RT-PCR扩增模板。应用Primer 5.0软件设计甘蔗基因的RT-PCR扩增引物(表2)。PCR扩增体系总体积为25 μL, 含10×Exbuffer 2.5 μL、10 mmol L–1dNTPs 2 μL、20 μmol L–1上下游引物各1.0 μL、Ex酶0.125 μL、cDNA模板1.0 μL、ddH2O 17.375 μL。PCR程序为95℃预变性4 min; 95℃变性30 s, 65℃(每个循环降0.5℃)退火30 s, 72℃延伸1 min 30 s, 35个循环; 72℃延伸10 min。先将扩增产物纯化回收, 然后将回收产物连接到pMD-19T载体并转化到大肠杆菌DH5α感受态细胞中, 于含有氨苄青霉素的LB平板上进行阳性克隆筛选并挑取单菌落鉴定, 随后送上海铂尚生物工程技术服务有限公司测序, 并通过DNAMAN软件比对测序结果的正确性。
1.5 甘蔗ScSEC14基因序列的生物信息学分析
利用在线工具ExPASy中的Protparam tool (http://web.expasy.org/compute_pi/)预测基因的理化性质及其编码的蛋白的一级结构、亲疏水性等; 利用Prabi (https://npsa-prabi.ibcp.fr/cgi-bin/ npsa_automat.pl?page=/NPSA/npsa_hnn.html)、ProtFun (http://www.cbs.dtu.dk/services/ProtFun/)、SignalP (http://www.cbs.dtu.dk/ services/SignalP/)和TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)分别对其二级结构、功能特性、信号肽、和跨膜特性进行预测分析; 用SWISSMODEL (https://swissmodel.expasy.org/interactive)在线预测工具预测分析蛋白三级结构; 通过NCBI中的CDD (conserved domain database)数据库预测蛋白保守结构域; 用Blastp在线工具查找甘蔗同源氨基酸序列, 并使用DNAMAN 7.0软件多重比对同源氨基酸序列, 使用MEGA 6.0软件ML (maximum likelihood,LG+G)法构建系统进化树。

表2 ScSEC14基因克隆与表达所用引物
1.6 甘蔗ScSEC14基因的亚细胞定位分析
采用双酶切方法将基因构建到亚细胞定位载体pCAMBIA 2300-GFP上, 然后将筛选好的阳性质粒转化农杆菌GV3101菌株。在含50 μg mL–1卡那霉素和35 μg mL–1利福平的LB液体培养基上, 用含200 μmol L–1乙酰丁香酮的MS空白培养基, 将菌液浓度调整至OD600=0.8, 然后选择5~8片叶龄、长势一致的本氏烟进行叶片注射, 对照组为空载pCAMBIA 2300-GFP。注射完在28℃下光照16 h/黑暗8 h培养, 2 d后, 显微镜观察亚细胞定位结果。
1.7 甘蔗ScSEC14基因原核表达分析
运用Gateway构载体方法将基因构到原核表达载体pEZY19中得到重组菌- pEZY19, 将阳性重组菌株、空白菌株BL21和空载BL21-pEZY19菌液, 分别加至20 mL LB液体培养基中, 于37℃下200 r min–1振荡培养至OD600约为0.6后, 加入异丙基硫代半乳糖苷(IPTG)至终浓度为1.0 mmol L–1, 在28℃下200 r min–1摇床内进行蛋白诱导, 分别于0、1.5、1、2、4、6、8 h取样。将上述样品在4℃下8000 r min–1离心10 min收集菌体, 去除上清液后, 加入30 μL 2×蛋白上样缓冲液, 混匀后于100℃水浴5 min进行裂解, 各取10 μL上清液用12%十二烷基磺酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)检测, 经考马斯亮蓝染色和成像分析。
1.8 甘蔗ScSEC14基因表达的RT-qPCR分析
参照Prime-Script RT Reagent Kit操作说明书, 将RNA反转录合成cDNA得到模板。采用NCBI引物在线设计工具Primer designing tool (https://www.ncbi. nlm.nih.gov/tools/primer-blast/index.cgi?LINK_LOC=BlastHome)设计基因和内参基因(和)[28]的定量PCR引物(表2)。RT-qPCR体系(20 μL)含SYBRGreen Primix Ex(2×) 10 μL、10 μmol L–1上下游引物各1 μL、cDNA 1.0 μL、ddH2O 7 μL。扩增程序为50℃ 2 min; 95℃ 10 min; 95℃ 15 s, 60℃ 1 min, 45个循环; 增加熔解曲线; 反应时设置3次技术重复。在ABI PRISM7500 Real-time PCR System进行实时荧光定量PCR分析, 实验结束后导出Microsoft Excel工作表, 采用2–ΔΔCt算法[29]分析RT-qPCR试验结果, 计算3次重复数据的标准误后绘图。
2 结果与分析
2.1 甘蔗ScSEC14基因序列的获得
应用电子克隆技术获得甘蔗磷脂酰肌醇转运蛋白基因的cDNA全长序列, 并根据该序列设计特异性引物, 经过RT-PCR扩增、胶回收、连接转化、菌液PCR鉴定和测序获得约1008 bp的单一条带(图1)。序列比对表明, 测序序列与电子克隆序列同源性高达99.40%, 验证了RT-PCR扩增产物的正确性, 将该基因命名为, 其GenBank登录号为MG571103。基因的核酸序列及其推导的氨基酸序列如图2。
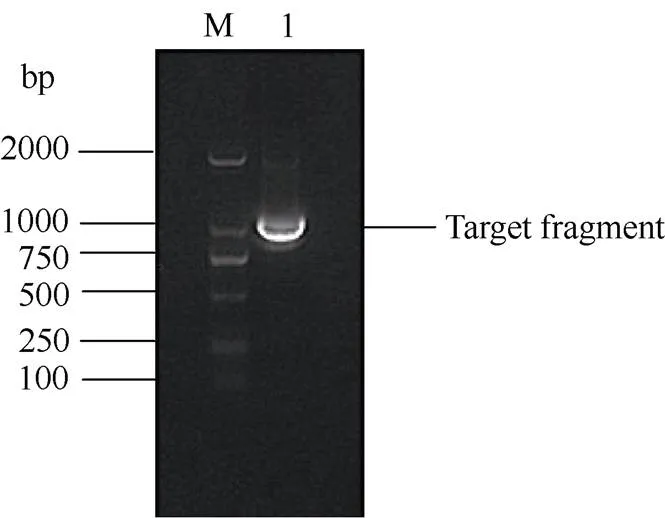
图1甘蔗ScSEC14基因的RT-PCR扩增
M: DNA marker, D2000 bp; 1:目的条带。
M: DNA marker, D2000 bp; 1: Target fragment.

图2 甘蔗ScSEC14基因的cDNA序列及其推导的氨基酸序列(*终止密码子)
方框部分为特异性引物在基因序列中的位置。
The sequence fragment complementary to primer is highlighted in the box.
2.2 甘蔗ScSEC14基因的生物信息学分析
2.2.1 甘蔗ScSEC14蛋白信号肽、疏水性/亲水性的预测和分析 甘蔗ScSEC14蛋白氨基酸残基的加权平均值较小, 为0.101 (<0.5), 推测该蛋白不存在信号肽。即甘蔗ScSEC14蛋白为非分泌蛋白, 在细胞质中合成后不能被转运。从图3可以看出, 第93位具有最高分值, 为1.633, 疏水性最强; 第215位具有最低分值, 为–2.544, 亲水性最强。分值大于0的氨基酸数为112个, 分值小于0的氨基酸数为223个, 推测甘蔗ScSEC14蛋白是一种亲水蛋白。
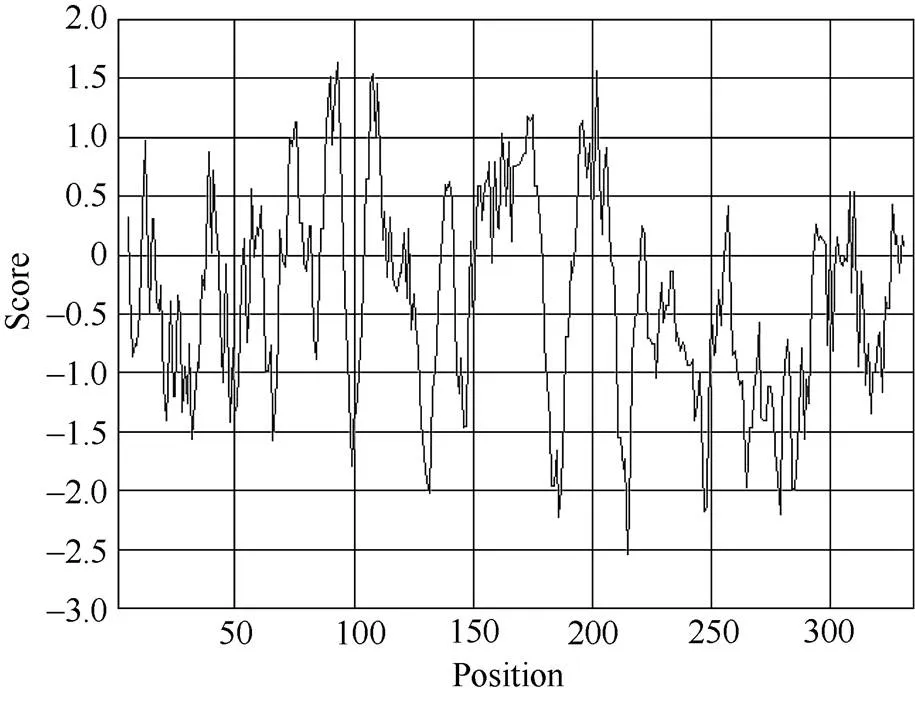
图3 甘蔗ScSEC14蛋白氨基酸疏水性/亲水性预测
2.2.2 甘蔗基因编码蛋白的一级和二级结构预测 甘蔗基因编码蛋白的一级结构预测显示, 该蛋白分子式为C1698H2684N460O500S17, 分子量为38 087.79, 编码了335个氨基酸, 其等电点(pI)为8.6, 不稳定系数为42.31, 数值大于40表明该蛋白不稳定, 推测为不稳定的碱性蛋白质。二级结构预测显示, 甘蔗ScSEC14蛋白中α-螺旋所占的比例最高, 为43.28%, 延伸链所占比例最低, 为15.52%, 无规则卷曲结构占41.19% (表3)。
2.2.3 甘蔗ScSEC14蛋白三级结构预测 用SWISSMODEL软件预测甘蔗ScSEC14的三级结构(图4), 由图4中可以看出, 其结构主要以螺旋和无规则卷曲为主。比较甘蔗、高粱、玉米、小米和水稻的SEC14蛋白的三级结构图, 结果如图4所示: 甘蔗ScSEC14蛋白与高粱、玉米、小米和水稻的SEC14蛋白相似度较高, 其中甘蔗与高粱的SEC14蛋白的相似度最高。
2.2.4 甘蔗ScSEC14蛋白的功能预测和保守结构域分析 Profun 2.2 Server网站预测分析显示, 甘蔗ScSEC14蛋白的主要功能与氨基酸生物合成(优势比Odd: 5.878)和辅酶因子生物合成(优势比Odd: 2.893)相关, 其次也可能是翻译(优势比Odd: 2.818)。保守结构域分析显示, 甘蔗ScSEC14蛋白隶属的家族为SEC14 superfamily, N端包含一个CRAL_ TRIO_N结构域(图5)。
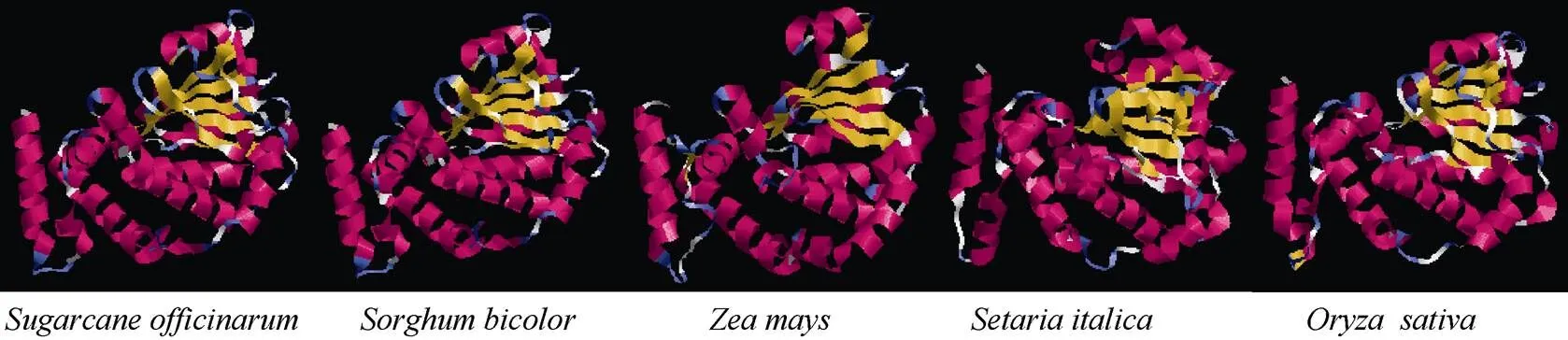
图4 甘蔗、高粱、玉米、粟和水稻SEC14蛋白三级结构预测
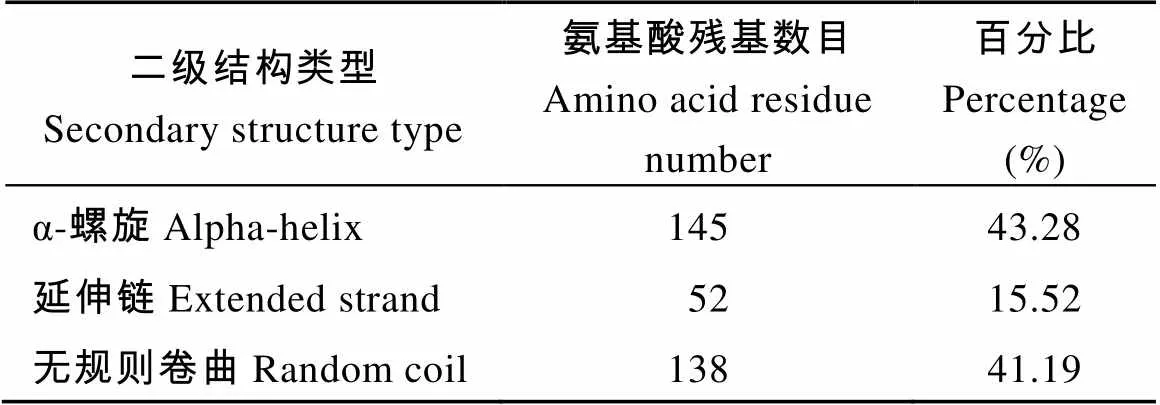
表3 甘蔗ScSEC14蛋白二级结构预测分析
2.2.5 甘蔗ScSEC14蛋白的氨基酸序列同源性分析和系统进化树分析 通过NCBI中的Blastp程序对甘蔗及其他物种SEC14蛋白的氨基酸序列进行同源性分析。结果显示, ScSEC14蛋白与高粱(|XP_002459926.1|)、玉米(|NP_ 001136689.1|)、粟(|XP_004956364.1|)、水稻(|XP_006660469.1|)、二穗短柄草(|XP_003576972.1|)、粗山羊草亚种(subsp|XP_ 020197696.1|)、大麦(subsp.|BAK00848.1|)、油棕(|XP_010942585.1|)和海枣(|XP_008797755.1|)中SEC14蛋白的氨基酸序列相似性分别为95%、93%、90%、84%、81%、81%、80%、71%和69% (图6-A)。本研究中克隆得到的基因编码蛋白与其他物种的SEC14蛋白具有较高的同源性。将甘蔗ScSEC14与拟南芥、大豆等植物的PITP基因[11]进行系统进化树分析(图6-B), 可知植物Sec14-like蛋白主要分为4组: SSH (soybean Sec14 homolog group)、UCSH (uncharacterized SEC14p homolog group)、SFH (Sec14 homolog group)和PATL (patellin group), 其中甘蔗ScSEC14属于Sec14-like蛋白家族的SSH亚家族, 其结构域中只包含1个N端SEC14结构域(图6-C)。
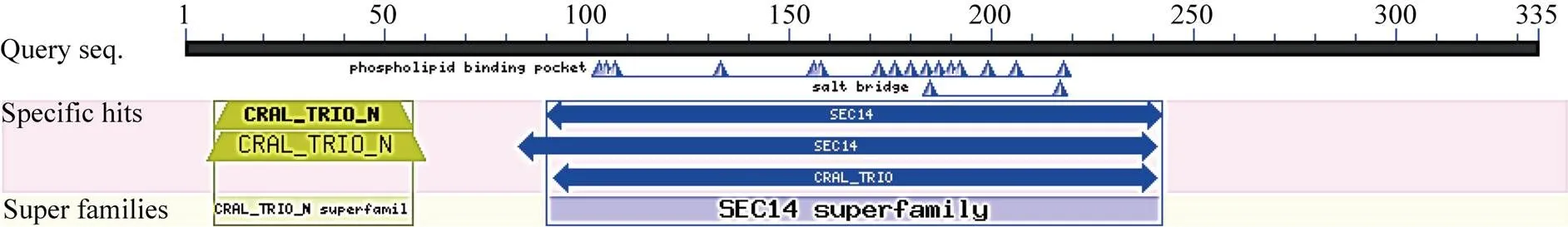
图5 甘蔗ScSEC14蛋白的保守结构域分析

(图6)

(图6)
A: ScSEC14 蛋白与其他物种的SEC14 蛋白的氨基酸序列比对; B: ScSEC14 蛋白与其他物种SEC14 蛋白的系统进化树分析; C: ScSEC14 蛋白与其他物种SEC14 蛋白的结构域分析。
A: Amino acid sequence alignment of the ScSEC14 protein with SEC14 proteins of other species; B: Phylogenetic tree analysis of ScSEC14 protein and SEC14 protein from other species; C: Domain analysis of ScSEC14 protein and SEC14 proteins of other species.

图7 甘蔗ScSEC14蛋白在烟草叶片中的亚细胞定位
红色箭头代表细胞核; 白色箭头代表细胞膜; 蓝色箭头代表细胞质。
Red arrow represents nucleus; white arrow represents plasma membrane; blue arrow represents cytoplasm.
2.3 甘蔗ScSEC14蛋白的亚细胞定位
运用DAPI核染色的方法, 采用明场、绿色荧光、蓝色荧光及绿色荧光和蓝色荧光叠加这4个视野拍摄ScSEC14蛋白的亚细胞定位图片。从图7中可以看出, 对照组在细胞膜、细胞核、细胞质中均有定位, ScSEC14蛋白在细胞膜和细胞核中均有定位, 但在细胞核中的表达较弱, 因此ScSEC14蛋白主要定位于细胞膜。
2.4 甘蔗ScSEC14基因的原核表达实验
在获得基因全长cDNA的基础上, 将其克隆至原核表达载体pEZY19中, 构建了重组表达载体pEZY19-, 表达产物经SDS-PAGE验证, 获得与预期相符的38 kDa左右的重组蛋白, 表明目的蛋白在大肠杆菌表达菌株BL21 (DE3)中得到成功表达(图8)。
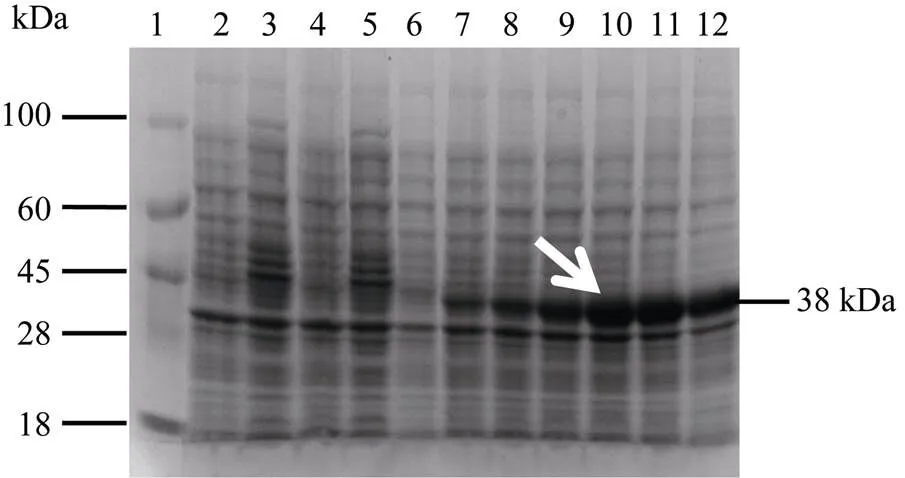
图8 pEZY19-ScSEC14和pEZY19(+)表达产物的SDS-PAGE分析
1: marker; 2: 空菌诱导0 h; 3: 空菌诱导8 h; 4: 空载诱导0 h; 5: 空载诱导8 h; 6~12: 重组菌诱导0、1.5、1、2、4、6、8 h; 白色箭头代表被诱导的目标蛋白。
1: marker; 2: empty bacteria induced for 0 h; 3: empty bacteria induced for 8 h; 4: empty vector induced for 0 h; 5: empty vector induced for 8 h; 6–12: recombinant bacteria induced for 0, 1.5, 1, 2, 4, 6, 8 h; white arrow represents the target protein induced.
2.5 甘蔗ScSEC14基因的组织特异性表达分析
组织特异性表达的分析结果显示, 甘蔗14基因在ROC22中组成型表达, 即在植株的根、侧芽、蔗皮、蔗髓、叶中均有表达。其中在叶中的表达量最高, 约为蔗皮的4.9倍, 其次是在根中的表达量, 约为蔗皮的2.0倍, 在蔗皮中的表达量则最低(图9), 推测该基因的表达可能与叶片的水分运输、蒸腾作用相关[36]。

图9 甘蔗ScSEC14基因在不同组织中的表达
误差线为每组处理的标准误差(= 3)。
Error bars represent the standard error of each treating group (= 3).
2.4 甘蔗ScSEC14基因在不同外源胁迫下的表达特性分析
基因在NaCl、SA、PEG、CaCl2胁迫下表达量均上调, 其中在NaCl胁迫下12 h的表达量最高, 约为对照的4.7倍, 同样在PEG胁迫下12 h的表达量最高, 约为对照的5.5倍(图10-A); SA胁迫下6 h达到最高, 约为对照的2.4倍, 在CaCl2胁迫下12 h达到最高, 约为对照的2.3倍(图10-B); 在CuCl2和CdCl2胁迫下的表达量先上调后下调, 且都在12 h处理时的表达量最高, CuCl2约为对照的1.6倍, CdCl2约为对照的1.1倍(图10-C)。
3 讨论
磷酸肌醇在细胞中发挥着重要的作用[1]。前人研究表明, Sec14-like磷脂酰肌醇转运蛋白是一个信号集成器(signal integrators), 在时间和空间上连接了脂质代谢和磷酸肌醇信号, 并参与细胞内肌醇磷酸代谢、膜运输、极性生长、信号转导、逆境胁迫等多种重要的生命过程[1,4]。
本研究以课题组前期甘蔗受黑穗病胁迫下转录组数据库中作为探针, 结合电子克隆和RT-PCR扩增验证获得一条具有完整开放读码框的甘蔗基因cDNA全长序列。蛋白与高粱、玉米的同源性较高, 分别为95%和93%, 说明基因编码的蛋白在不同物种间具有较高的保守性。ScSEC14属于Sec14-like蛋白家族的SSH (soybean Sec14 homolog group)亚家族, 其功能主要与渗透调节相关[1,11]。生物信息学分析显示, 甘蔗ScSEC14蛋白为不稳定的亲水性蛋白, 这与罗明武等[30]对巴西橡胶树磷脂酰肌醇转移蛋白基因的分析的结果相同。此外, 该蛋白的二级结构主要为α-螺旋, 这与苏世超等[14]获得的小麦SEC14和Kiełbowiczmatuk等[13]获得的大麦SEC14蛋白的二级结构特征相符。三级结构预测分析结果显示, 甘蔗ScSEC14与高粱SEC14蛋白的差异较小, 而与玉米、水稻、小米的SEC14蛋白差异较大, 其原因可能是甘蔗与高粱的亲缘关系较近而与其他物种的亲缘关系较远。保守结构域分析显示, 甘蔗ScSEC14 蛋白的N端具有一个高等植物特有的CRAL_ TRIO_N结构域和一个典型的SEC14结构域。CRAL_TRIO_N结构域通常存在于植物中, 被称为脂质结合结构域, SEC14结构域则在细胞内脂质代谢、膜运输等方面发挥重要作用[26,31], 这2个结构域的存在对预测甘蔗ScSEC14蛋白的功能具有一定的参考价值。
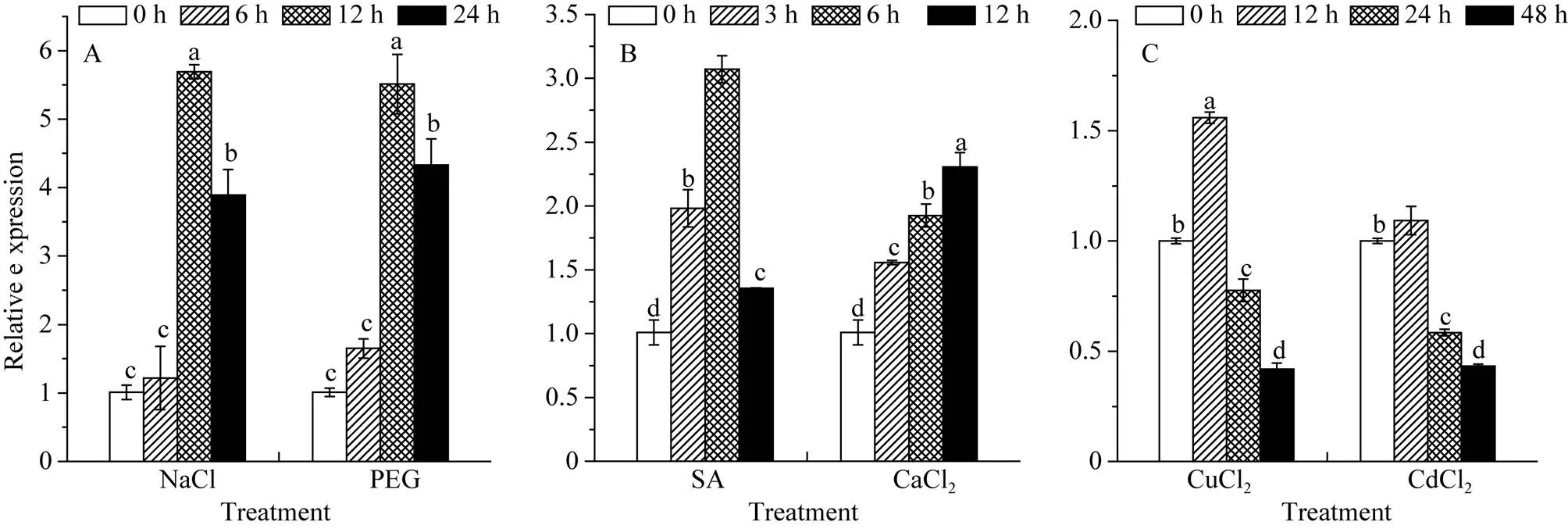
图10 甘蔗ScSEC14基因在不同外源胁迫下的表达特性
误差线为每组处理的标准误差(= 3)。
Error bars represent the standard error of each treating group (= 3).
磷脂酰肌醇转运蛋白最核心的基础功能是转运在内质网膜(ER)上合成的磷脂酰肌醇或磷脂酰肌醇衍生物[32]。亚细胞定位实验结果显示, ScSEC14在细胞核与细胞膜均有定位, 但主要定位于细胞膜, 这与其在质膜间转运物质的功能相符[32]。目前, 与ScSEC14属于同一亚家族的拟南芥Atsec14-1、Atsec14-5和大豆Ssh1p, 尚无亚细胞定位的文献报道。但是, 莫萍丽[33]在研究2个拟南芥花中特异表达的Sec14-like磷脂酰肌醇转移蛋白AtSFH3和AtSFH12 (与ScSEC14亲缘关系较近的另一亚家族)时发现, AtSFH3定位在细胞膜, AtSFH12则定位于细胞核与细胞膜上。
干旱、高盐等逆境在不同程度上影响植物体内的水分状况, 从而严重影响作物产量及品质[34], 是植物面临的主要非生物胁迫。苏世超等[14]在研究普通小麦基因时发现, 该基因在高盐胁迫下的响应程度较明显, 可能参与盐依赖抗逆信号转导途径。本研究中甘蔗基因的RT-qPCR表达分析结果显示, 在NaCl和PEG下, 该基因的表达量均上调, 且上调幅度较大, 推测该基因在植物抗逆过程中积极响应干旱和盐胁迫。近来研究表明, 水杨酸不仅在植物对多种病原体的胁迫响应中发挥作用, 还在非生物胁迫诱导的信号传导中起重要作用[35]。本研究中,在水杨酸(SA)胁迫处理下的表达量上调, 推测该基因参与了水杨酸(SA)介导的抗逆信号途径。有研究报道, 在磷酸肌醇代谢PITP-PLC途径中, 磷脂酰肌醇转运蛋白通过结合磷脂酰肌醇将其转运到质膜, 该过程会产生第二信使IP3和DAG, 其中IP3释放到细胞质中与胞内Ca2+结合, 激活多种依赖Ca2+的生理生化反应[2,36]。本研究中基因在CaCl2胁迫下的表达量上调, 一定程度上说明该基因参与了甘蔗细胞内Ca2+信号途径。当重金属含量超过某一临界值时, 会破坏植物生物膜系统, 对植物产生一定的毒害作用, 轻则使植物体内的代谢过程紊乱, 重则导致植物死亡[37]。本研究中甘蔗基因在CuCl2、CdCl2处理下的表达量在12 h上调, 24 h和48 h下调, 说明在Cu2+和Cd2+胁迫初期, 细胞内Cu2+和Cd2+浓度的增加促使磷脂酰肌醇转运蛋白将磷脂酰肌醇从内质网转运到质膜以降低细胞内离子浓度, 维持细胞稳态[38], 但随着胁迫时间的延长, 植物体受到毒害作用, 磷脂酰肌醇转运蛋白功能受阻,基因表达量也随之下降。
4 结论
从甘蔗中克隆到一个典型的Sec14-like磷脂酰肌醇转运蛋白基因(GenBank登录号为MG571103), 其全长1617 bp, 包含一个1008 bp的完整开放阅读框, 编码335个氨基酸。ScSEC14蛋白隶属于Sec14-like 蛋白家族的SSH (soybean Sec14 homolog group)亚家族。ScSEC14蛋白主要定位于细胞膜。在NaCl、PEG、SA、CaCl2以及重金属Cu2+和Cd2+胁迫诱导下,基因的表达均有不同程度的响应, 特别是在干旱和高盐胁迫下响应程度较明显, 因此推测该基因积极响应干旱和盐胁迫。该基因在蔗皮中的表达量最少, 在叶中的表达量最高, 其功能可能与叶片的水分运输和蒸腾作用相关。
[1] Ghosh R, Bankaitis V A. Phosphatidylinositol transfer proteins: negotiating the regulatory interface between lipid metabolism and lipid signaling in diverse cellular processes., 2011, 37: 290–308
[2] Muellerroeber B, Pical C. Inositol phospholipid metabolism in Arabidopsis. Characterized and putative isoforms of inositol phospholipid kinase and phosphoinositide-specific phospholipase C., 2002, 130: 22–46
[3] Balla T. Phosphoinositides: tiny lipids with giant impact on cell regulation., 2013, 93: 1019–1137
[4] Phillips S E, Vincent P, Rizzieri K E, Schaaf G, Bankaitis V A, Gaucher E A. The diverse biological functions of phosphatidylinositol transfer proteins in eukaryotes., 2006, 41: 21–49
[5] Aitken J F, van Heusden G P, Temkin M, Dowhan W. The gene encoding the phosphatidylinositol transfer protein is essential for cell growth., 1990, 265: 4711–4717
[6] Kearns M A, Monks D E, Fang M, Rivas M P, Courtney P D, Chen J, Prestwich G D, Theibert A B, Dewey R E, Bankaitis V A. Novel developmentally regulated phosphoinositide binding proteins from soybean whose expression bypasses the requirement for an essential phosphatidylinositol transfer protein in yeast., 1998, 17: 4004–4017
[7] Peterman T K, Ohol Y M, Mcreynolds L J, Luna E J. Patellin1, a novel Sec14-like protein, localizes to the cell plate and binds phosphoinositides., 2004, 136: 3080–3094
[8] Peterman T K, Sequeira A S, Samia J A, Lunde E E. Molecular cloning and characterization of patellin1, a novel sec14-related protein, from zucchini ()., 2006, 163: 1150–1158
[9] Vincent P, Chua M, Nogue F, Fairbrother A, Mekeel H, Xu Y, Allen N, Bibikova T N, Gilroy S, Bankaitis V A. A Sec14p-nodulin domain phosphatidylinositol transfer protein polarizes membrane growth of Arabidopsis thaliana root hairs., 2005, 168: 801–812
[10] Routt S M, Bankaitis V A. Biological functions of phosphatidylinositol transfer proteins., 2004, 82: 254–262
[11] Kiba A, Nakano M, Vincent-Pope P, Takahashi H, Sawasaki T, Endo Y, Ohnishi K, Yoshioka H, Hikichi Y. A novel Sec14 phospholipid transfer protein from Nicotiana benthamiana is up-regulated in response toinfection, pathogen associated molecular patterns and effector molecules and involved in plant immunity., 2012, 169: 1017–1022
[12] Kiba A, Galis I, Hojo Y, Ohnishi K, Yoshioka H, Hikichi Y. SEC14 phospholipid transfer protein is involved in lipid signaling-mediated plant immune responses in., 2014, 9: e98150
[13] Kiełbowiczmatuk A, Banachowicz E, Turskatarska A, Rey P, Rorat T. Expression and characterization of a barley phosphatidylinositol transfer protein structurally homologous to the yeast Sec14p protein., 2016, 246: 98–111
[14] 苏世超, 唐益苗, 徐磊, 王伟伟, 高世庆, 马锦绣, 孙辉, 王永波, 乔亚科, 赵昌平. 普通小麦基因的克隆及表达分析. 农业生物技术学报, 2016, 24: 1129–1137 Su S C, Tang Y M, Xu L, Wang W W, Gao S Q, Ma J X, Sun H, Wang Y B, Qiao Y K, Zhao C P.Cloning and expression analysis ofgene from wheat ()., 2016, 24: 1129–1137 (in Chinese with English abstract)
[15] Wang X, Shan X, Xue C, Wu Y, Su S, Li S, Liu H, Jiang Y, Zhang Y, Yuan Y. Isolation and functional characterization of a cold responsive phosphatidylinositol transfer-associated protein,, from maize (L.)., 2016, 35: 1671–1686
[16] Monks D E, Aghoram K, Courtney P D, De Wald D B, Dewey R E. Hyperosmotic stress induces the rapid phosphorylation of a soybean phosphatidylinositol transfer protein homolog through activation of the protein kinases SPK1 and SPK2., 2001, 13: 1205–1219
[17] 陈义强. 甘蔗抗旱种质资源的筛选及斑茅杂种后代抗旱性分析. 福建农林大学硕士学位论文, 福建福州, 2005 Chen Y Q. Screening and analysis of the sugarcane drought resistant germplasm and the inte-rgeneric hybrids from crossing ofL. andJeswiet.MS Thesis of Fujian Agriculture and Forestry University, Fuzhou, Fujian, China, 2005 (in Chinese with English abstract)
[18] 黄珑, 苏炜华, 张玉叶, 黄宁, 凌辉, 肖新换, 阙友雄, 陈如凯. 甘蔗基因的同源克隆与表达. 作物学报, 2015, 41: 499–506 Huang L, Su W H, Zhang Y Y, Huang N, Ling H, Xiao X H, Que Y X, Chen R K. Cloning and expression analysis ofgene in sugarcane., 2015, 41: 499–506 (in Chinese with English abstract)
[19] Gandonou B, Agbangla C, Ahanhanzo C, Errabii T, Idaomar M, Abrini J, Skalisenhaji N. In vitro culture techniques as a tool of sugarcane bud germination study under salt stress., 2008, 7: 3680–3682
[20] Koehler P H, Moore P H, Jones C A, Cruz A D, Maretzki A. Response of drip-irrigated sugarcane to drought stress., 1982, 74: 906–911
[21] Guo J L, Xu L P, Fang J P, Su Y C, Fu H Y, Que Y X, Xu J S. A novel dirigent protein gene with highly stem-specific expression from sugarcane, response to drought, salt and oxidative stresses., 2012, 31: 1801–1812
[22] Su Y C, Xu L P, Xue B T, Wu Q B, Guo J L, Wu L G, Que Y X. Molecular cloning and characterization of two pathogenesis- related β-1,3-glucanase genesandfrom sugarcane infected by., 2013, 32: 1503–1519
[23] Begcy K, Mariano E D, Gentile A, Lembke C G, Zingaretti S M, Souza G M, Menossi M. A novel stress induced sugarcane gene confers tolerance to drought, salt and oxidative stress in transgenic tobacco plants., 2012, 7: e44697
[24] Chen Y, Ma J J, Zhang X, Y Yang Y T, Zhou D G, Yu Q, Que Y X, Xu L P, Guo J L. A novel non-specific lipid transfer protein gene from sugarcane (), obviously responded to abiotic stresses and signaling molecules of SA and MeJA., 2016, 19: 1–9
[25] 苏炜华, 刘峰, 黄珑, 苏亚春, 黄宁, 凌辉, 吴期滨, 张华, 阙友雄. 甘蔗Ca2+/H+反向运转体基因的克隆与表达分析. 作物学报, 2016, 42: 1074–1082 Su W H, Liu F, Huang L, Su Y C, Huang N, Ling H, Wu Q B, Zhang H, Que Y X. Cloning and expression analysis of a Ca2+/H+antiporter gene from sugarcane., 2016, 42: 1074–1082 (in Chinese with English abstract)
[26] Huang J, Kim C M, Xuan Y H, Park S J, Hai L P, Je B I, Liu J M, Kim T H, Kim B K, Han C D. OsSNDP1, a Sec14-nodulin domain-containing protein, plays a critical role in root hair elongation in rice., 2013, 82: 39–50
[27] Kiełbowiczmatuk A, Banachowicz E, Turskatarska A, Rey P, Rorat T. Expression and characterization of a barley phosphatidylinositol transfer protein structurally homologous to the yeast Sec14p protein., 2016, 246: 98–111
[28] Guo J L, Ling H, Wu Q B, Xu L P, Que Y X. The choice of reference genes for assessing gene expression in sugarcane under salinity and drought stresses., 2014, 4: 7042
[29] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-delta delta C(T)) Method., 2001, 25: 402–408
[30] 罗明武, 邓柳红. 巴西橡胶树磷脂酰肌醇转移蛋白cDNA的克隆及其序列分析. 基因组学与应用生物学, 2010, 29: 164–169 Luo M W, Deng L H. Cloning and sequence analysis of phosphatidylinositol transfer protein cDNA from., 2010, 29: 164–169 (in Chinese with English abstract)
[31] Domain T L S. The lipid-binding SEC 14 domain., 2007, 1771: 719–726
[32] Huang J, Ghosh R, Bankaitis V A. Sec14-like phosphatidylinositol transfer proteins and the biological landscape of phosphoinositide signaling in plants., 2016, 1861: 1352–1364
[33] 莫萍丽. 拟南芥两个在花中特异表达的Sec14-like磷脂酰肌醇转移蛋白的分子生物学研究. 厦门大学博士学位论文, 福建厦门, 2006 Mo P L.Molecular biology of two Sec14-like phosphatidylinositol transfer proteins that specifically expressed in flowers ofPhD Dissertation of Xiamen University, Xiamen, Fujian, China, 2006 (in Chinese with English abstract)
[34] 刘岩, 彭学贤. 植物抗渗透胁迫基因工程研究进展. 中国生物工程杂志, 1997, 17(2): 30–37 Liu Y, Peng X X. Advances in genetic engineering of plant osmotic stress resistance., 1997, 17(2): 30–37 (in Chinese)
[35] Kang G, Li G, Guo T. Molecular mechanism of salicylic acid-induced abiotic stress tolerance in higher plants., 2014, 36: 2287–2297
[36] Berridge M J, Irvine R F. Inositol phosphates and cell signalling., 1989, 341: 197–205
[37] 蔡囊, 李吉跃, 李永杰. 土壤重金属污染下植物效应研究进展. 林业与环境科学, 2009, 25(2): 71–77 Cai N, Li J Y, Li Y J. Advances on the effect of heavy metal containated soils on plant., 2009, 25(2): 71–77 (in Chinese with English abstract)
[38] Hsuan J, Cockcroft S. The PITP family of phosphatidylinositol transfer proteins., 2001, 2: REVIEWS3011
A Sugarcane Phosphatidylinositol Transfer Protein GeneResponds to Drought and Salt Stresses
MAO Hua-Ying, LIU Feng, SU Wei-Hua, HUANG Ning, LING Hui, ZHANG Xu, WANG Wen-Ju, LI Cong-Na, TANG Han-Chen, SU Ya-Chun, and QUE You-Xiong*
Key Laboratory of Sugarcane Biology and Genetic Breeding (Fujian), Ministry of Agriculture, Fujian Agriculture and Forestry University / Sugarcane Research & Development Center, China Agricultural Technology System, Fuzhou 350002, Fujian, China
Sec14-like phosphatidylinositol transfer proteins are present in all eukaryotic genomes and involved in a variety of biological activities, such as metabolism of inositol phosphate, membrane transportation, polar growth, signal transduction and stress responses. The responses of Sec14-like gene to drought and salt stresses have not been reported in sugarcane. In this study, agene sequence was obtained in the sugarcane transcription database infected by, and the full length cDNA sequence of a sugarcanegene was obtained by RT-PCR technology and named as(GenBank accession number: MG571103). Bioinformatics analysis showed a full length of 1617 bp ingene containing a complete open reading frame of 1008 bp and encoding 335 amino acid residues. ScSEC14 is an unstable hydrophilic protein with no signal peptide. The secondary structure of ScSEC14 protein is mostly α-helices, with a typical SEC14 domain and a CRAL_TRIO_N domain. Phylogenetic tree analysis showed that ScSEC14 belonged to SSH (soybean Sec14 homolog group) subfamily of Sec14-like protein family. Subcellular localization experiment showed that ScSEC14 protein was mainly localized in the plasma membrane. Real-time quantitative PCR analysis showed thatgene was constitutively expressed in sugarcane, with the lowest expression level in skin, and the highest in leaf, which was 4.9 times of that in skin. The expression ofgene was up-regulated under the stresses of PEG, NaCl, CaCl2and salicylic acid (SA). We speculate thatplays an important role in response to drought and salt stresses, and may be involved in the stress response signaling pathway mediated by Ca2+and SA.
sugarcane; Sec14-like phosphatidylinositol transfer protein;; drought; salt stress
2017-12-10;
2018-03-15;
2018-03-19.
10.3724/SP.J.1006.2018.00824
阙友雄, E-mail: queyouxiong@126.com
E-mail: 1297415212@qq.com
本研究由国家自然科学基金项目(31671752), 福建省杰出青年基金项目(2015J06006)和国家农业产业技术体系建设专项(CARS-17)资助。
This study was supported by the National Natural Science Foundation of China (31671752), the Natural Science Foundation of Fujian Province for Distinguished Young Scholars (2015J06006), and the China Agriculture Research System (CARS-17).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20180317.1633.002.html
