pMMR和MSS表型的Ⅱ期普危结肠癌、高位直肠癌单药辅助化疗的探讨
2018-06-15宫爱民任明智孙静阳刘斌赵长林张晓飞王俊松
宫爱民 任明智 孙静阳 刘斌 赵长林 张晓飞 王俊松
结直肠癌是人类高发的恶性肿瘤,其发病率和病死率分列第3位和第4位[1]。局部复发与肝转移是结直肠癌治疗的主要难题,根治性术后35~50%的结直肠癌患者会出现局部复发,80%的局部复发出现在结直肠癌根治术后2~3年内,其中Ⅰ期术后患者局部复发率为4~16%,Ⅱ期术后患者局部复发率为26%[2-3]。约30~40%的异时性肝转移发生在原发灶根治术6个月之后,其中Ⅱ期结肠癌术后患者异时性肝转移3年累计发生率为10.6%[3-5]。近年来,结直肠癌综合诊疗取得了较大的进步,对Ⅱ~Ⅲ期结肠癌患者遵循完整结肠系膜切除(complete mesocolic excision,CME),中低位直肠癌遵循全直肠肠系膜切除(total mesorectal excision,TME)原则及新辅助治疗或辅助治疗降低了局部复发率和远处转移率,增加了生存率[3,5]。近年研究发现,错配修复基因(mismatch repair,MMR)突变或者基因修饰(甲基化)可破坏MMR蛋白的功能,导致错配修复基因缺失(defective mismatch repair,dMMR)和微卫星不稳 定(microsatellite Instability,MSI)。MMR突变包括 MLH1、MSH2、MSH6、PMS2蛋白异常。免疫组织化学法(immunohistochemistry,IHC)检测 MMR 蛋白表达可确定dMMR和MMR健全型(MMR-profi cient tumors,pMMR)。PCR-毛 细管电泳法检测MSI可确定高度MSI(MSI-H)、低度MSI(MSI-L)、微卫星稳定(MSS)[6-8]。2015年版中国结直肠癌诊疗规范推荐所有的Ⅱ期结直肠癌患者都应接受组织标本 MMR或MSI检测,dMMR和MSI-H是Ⅱ期结直肠癌患者预后良好的指标,可作为Ⅱ期结直肠癌患者氟尿嘧啶类辅助化疗无效的预测标志物,但并未推荐Ⅱ期普危(T3 N0)结肠癌、高位直肠癌患者可以不接受辅助化疗[7-8]。因此,目前对具有pMMR/MSS表型的Ⅱ期普危结肠癌、高位直肠癌患者是否做辅助化疗还存在一些争议。本研究旨在探讨pMMR/MSS表型的Ⅱ期普危结肠癌、高位直肠癌患者单药辅助化疗是否能获益。
资料与方法
一、一般资料
采用回顾性分析,选取大连大学附属新华医院2012年1月至2015年12月间因结肠癌、高位直肠癌接受结直肠癌根治性手术的40例Ⅱ期伴普危因素患者。普危因素指既无低危因素也无高危因素[9]。高位直肠癌指直肠原发肿瘤下缘距肛缘12 cm以上[5]。病理分期采用美国癌症协会(AJCC第7版)TNM分期标准。40例常规进行IHC检测MLH1、MSH2、MSH6、PMS2蛋白,其中20例选择性检测PCR-毛细管电泳法检测MSI。
病例入选标准:(1)术前患者经肠镜明确为结肠癌和高位直肠癌的初诊患者;(2)术前经MSI和结直肠癌根治性手术且病理组织学确认为T3N0(淋巴结检出数目≥12个)结肠癌和高位直肠癌;(3)经ICH确定为pMMR;(4)临床和病理学资料完整;(5)术前未行新辅助治疗及术后未行辅助治疗者。
病例排除标准:(1)Ⅱ期普危以上结直肠癌和中低位直肠癌;(2)林奇综合征;(3)多发肠癌和(或)合并第二恶性肿瘤;(4)术后病理报告不能满足亚组分期;(5)入组前未签署本研究知情同意书或化疗知情同意书;(6)临床和病理学资料不全和未按时随访者。
40例患者符合入选标准,中位年龄 64.5±0.8岁,其中心电图异常占55%;2型糖尿病占62.5%。病例分组:根据是否要求辅助化疗分为辅助化疗组和非辅助化疗组2组,其中辅助化疗组20例,男16例,女4例;右半结肠癌6例,左半结肠癌7例,高位直肠癌7例;高分化腺癌2例,中——低分化腺癌18例;心脏合并症11例;2型糖尿病(空腹血糖≤11 mmol/L)13例。经PCR-毛细管电泳法检测MSI表型。非辅助化疗组20例,男15例,女5例;右半结肠癌7例,左半结肠癌6例,高位直肠癌7例;高分化腺癌3例,中——低分化腺癌17例;心脏合并症11例;2型糖尿病(空腹血糖≤11 mmol/L)12例。未经PCR-毛细管电泳法检测MSI表型。本研究经大连大学附属新华医院伦理委员会审核通过,所有入组病人均签署知情同意书。
二、研究方法
1. ICH检测MMR蛋白
主要抗体和试剂:即用型鼠抗人MLH1(克隆号:G168-15)单克隆抗体、MSH2(克隆号:25D12)、鼠抗人MSH6(克隆号:44)单克隆抗体、鼠抗人PMS2(克隆号:MOR4G)单克隆抗体、即用型快捷免疫组化MaxVisionTM检测试剂盒与福建迈新公司即用型抗体配套使用。以上抗体和试剂均购自福建迈新公司。40例病例均由两名病理医师阅片,选取肿瘤组织丰富的蜡块和正常蜡块用于实验。采用MaxVisionTM即用型快速免疫组化一步法,DAB显色染色[10],即用型MLH1、MSH2、MSH6、PMS2抗体直接使用,无需稀释。只需孵育15分钟,MSH2、MSH6、PMS2预处理,EDTA热修复,MLH1预处理,柠檬酸热修复。用PBS代替一抗作染色的阴性对照,用已知的阳性染色切片作阳性对照。结果判定标准MLH1、MSH2、MSH6、PMS2蛋白阳性着色定位于肿瘤细胞及癌旁腺上皮细胞核。在核着色良好的区域内,肿瘤细胞核着色比例≥5%时计为阳性,<5%时计为局灶阳性。任何肿瘤细胞及癌旁腺上皮细胞呈阳性表达即判断为该错配修复蛋白阳性[6],如果肿瘤细胞表达很弱周围间质细胞和肿瘤一样弱,也判断为该错配修复蛋白阳性。出现上述阳性表达判定肿瘤为pMMR。肿瘤细胞核无着色时计为阴性,任何一种蛋白表达阴性则判定肿瘤为dMMR[6,10]。
2. PCR-毛细管电泳法检测MSI
PCR-毛细管电泳法主要检测DNA分子链上5个位点的MSI状态。主要试剂和方法[6]采用德国Qiagen公司的 DNA提取试剂盒(QIAamp DNA FFPE Kit)提取石蜡组织中基因组DNA。采用美国Promega公司的MSI检测试剂盒(MSI Analysis System)特异性扩增20例的NR-21、NR-24、NR-27、BAT 25、BAT 26位点。基因分析仪检测携带荧光标志物的PCR产物长度,分析检测结果。结果判定标准为MSS:5个分子标志均无检测位点偏移;MSI-L:在5个分子标志中,显示1个检测位点偏移出现长度变异;MSI-H:在5个分子标志中,显示2个或2个以上检测位点偏移出现长度变异。由于MSI-L 表型结直肠癌在临床表现和病理表现上与MSS 表型无明显差别,因此通常被归入MSS表型[10-11]。
3. 单药辅助化疗的安全性和不良反应评价
辅助化疗组患者均签署化疗知情同意书。全组患者体能状态评估按美国东岸癌症临床研究合作组织(Eastern Cooperative Oncology Group Performance Status,ECOG PS)标准得分均为0;血常规、肝功和肾脏功能正常。化疗药物选择Raltitrexed(雷替曲塞,南京正大药业股份有限公司,批号:H20090325 )单药,剂量为3 mg/m2,第1天,静点15 min,21天重复的方案用 4周期。辅助化疗的病例一般缺乏近期疗效评价指标,采用按随访结果确定生存时间评价客观有效率(objective response,OR)。依据美国国立癌症研究所(National Cancer Institute,NCI)-CTC3.0版毒性分级标准评价化疗药物急性及亚急性不良反应:由轻到重分为Ⅰ~Ⅳ度。在静点雷替曲塞前、静点约1/2量时和静点结束2小时后监测血糖变化。两组病人随访起点是行结直肠癌根治性手术日期,随访方式:电话随访、门诊或住院复查。以2年无瘤生存、出现复发或转移日期为主要内容。随访日期截止至2016年12月31日。
三、统计学分析
采用SPSS 19.0对所收集数据进行统计学处理。OR计算方法:显效例数+有效例数/病例总数×100%;复发率计算方法:复发例数/病例总数×100%。辅助化疗组和非辅助化疗复发率比较采用率的卡方检验,设定P<0.05为有统计学差异。
结 果
一、ICH检测MMR蛋白结果
40例的Ⅱ期普危结肠癌/高位直肠癌常规切片ICH检测结果显示4种MMR蛋白(MLH1、MSH2、MSH6、PMS2)均为弥漫阳性表达,按MMR蛋白ICH染色判定标准确定为pMMR。MLH1、MSH2、MSH6、PMS2蛋白表达情况(图1)。
二、PCR-毛细管电泳法检测MSI结果
从40例确定为pMMR的Ⅱ期普危结肠癌/高位直肠癌病例中,随机选择20例PCR-毛细管电泳法检测MSI的结果显示4种MMR蛋白均为弥漫阳性表达者皆判读为MSS(图2)。
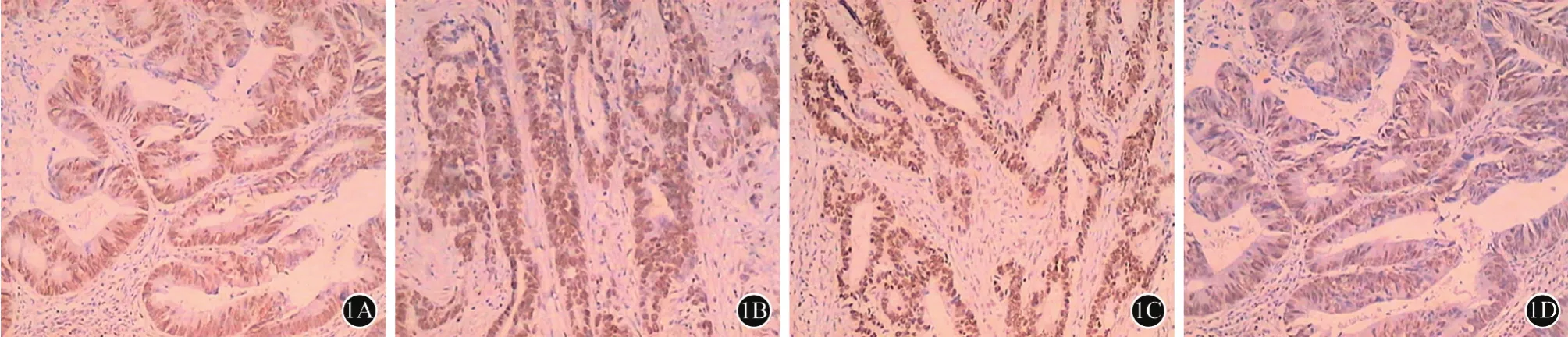
图1 Ⅱ期普危结直肠癌组织4种MMR蛋白表达。1A:MLH1;1B:MSH2;1C:MSH6;1D:PMS2均为弥漫阳性表达(×400)
MMR蛋白ICH与PCR- MSI符合率达100%(20/20)。4种MMR蛋白ICH均为阳性即可确定为MSS表型结直肠癌。

图2 PCR-毛细管电泳法检测Ⅱ期普危结直肠癌MSI状态。2A为正常组织;2B为同源癌组织,与自身的正常组织相比较,癌组织中 5 个分子标记均未出现长度变异,均无位点偏移。判读为MSS,为MSS表型结直肠癌
三、pMMR/MSS表型的Ⅱ期普危结肠癌/高位直肠癌单药辅助化疗结果
1. 雷替曲塞单药辅助化疗的安全性
辅助化疗组20例患者均完成雷替曲塞(3 mg/m2)d1,静点,q3w,4个周期辅助化疗。依据NCI-CTC3.0版毒性分级标准评价雷替曲塞单药急性及亚急性不良反应。辅助化疗组中,11例有心脏合并症的患者未发生心脏毒性反应;对13例2型糖尿病(空腹血糖≤11 mmol/L)的患者,在雷替曲塞单药静点前、静点中和静点结束后2小时监测血糖均无明显变化,不影响血糖代谢。雷替曲塞单药辅助化疗的安全性和不良反应见表1。

表1 雷替曲塞单药辅助化疗的安全性和不良反应(n=20)
2. 雷替曲塞单药辅助化疗的疗效
两组患者均获得随访,随访率为100%。随访结果为辅助化疗组OR和无瘤生存均为95.0%(19/20),非辅助化疗组无瘤生存为85.0%(17/20);复发率辅助化疗组为5.0%(1/20),非辅化组为15.0%(3/20),4例2年内复发的病例均为T3cN0,合并2型糖尿病的患者。两组复发率比较,辅助化疗组明显低于非辅助化疗组(χ2=5.556,P=0.0184)。由于本研究纳入的患者主要是2012年至2015年pMMR/MSS表型的ⅡA期结肠癌/高位直肠癌接受根治术的患者,因此没有做生存分析。
讨 论
微卫星(microsatellite)是包含1~6个碱基的重复DNA序列,广泛存在于生物基因组中,在DNA复制过程中易发生错配,需要MMR基因确保其复制正确。MMR是指在含有错配碱基的DNA分子中,使核苷酸序列恢复正常的修复方式,对修复DNA复制过程中发生的错配非常重要,该修复系统主要包括4个蛋白,即MLH1、MSH2、MSH6、PMS2,主要用来纠正DNA双螺旋上错配的碱基对。MMR的大致过程是:MMR基因识别出DNA双螺旋上错配的碱基对,切除掉不正确的核苷酸片段,然后通过DNA聚合酶III和DNA连接酶的作用,合成正确配对的双链DNA。当MMR基因发生突变或散在的获得性MLH1启动子高度甲基化导致MMR蛋白表达缺失、功能丧失时,不能修复和纠正DNA复制过程中出现的错配,即发生MSI[12-13]。MMR基因功能缺陷是结直肠癌发生的分子基础,而MSI则是结直肠癌的分子特征。MSI所引起的DNA复制错误不断积累,最终导致结直肠癌的发生[14]。MSI是结直肠癌中一种较为特殊的表型,它对结直肠癌的生物学行为、治疗等方面有着诸多影响。早期研究者先在结直肠癌中认识了MSI现象,通过PCR方法对BAT26、BAT25、D5S346、D2S123和 D17S250五个微卫星位点的检测,将结直肠癌分为MSS型、MSI-L型和MSI-H型以区别其在诊疗与预后中的差异。MSI-L型在临床表现和病理改变上与MSS肿瘤无明显差别,通常被归为MSS肿瘤。近年来,新专家共识推荐使用PCR方法对一组单核苷酸重复序列 5个 位 点(BAT-25、BAT-26、NR21、NR24、NR27)的MSI检测灵敏度和特异度更佳。现已有多项研究证实MMR蛋白ICH与PCR-MSI检测结果的符合率为97~100%,采用ICH检测4种MMR蛋白表达情况预测结直肠癌MSI状态具有高度的灵敏度和特异度,即dMMR可推断为MSI-H,pMMR 可推断为 MSS[6,15]。本研究显示,4种MMR蛋白IHC检测结果与PCR-毛细管电泳法对NR-21、NR-24、NR-27、BAT 25、BAT 26 位点检测MSI结果的符合率为100%,把握MMR蛋白表达情况可准确地预测结直肠癌MSI表型。因此,无论从蛋白水平检测MLH1、MSH2、MSH6、PMS2表达,还是在基因水平检测MSI表型均有助于诊疗结直肠癌。由于采用IHC 联合检测4种MMR蛋白确定MSI的方法,具有简便、快捷、经济、稳定等优点,便于临床应用,更便于向基层医院推广。
Ⅱ期结直肠癌病人是一个异质群体,部分复发转移风险高。在Ⅱ期结直肠癌中,MMR/MSI状态是提示治疗和预后的独立预测因子[16]。Ⅱ期结直肠癌根治术后是否需要氟尿嘧啶类辅助化疗,需要综合考虑高危因素和MMR /MSI状态。Ⅱ期高危因素包括T4(ⅡB、ⅡC)、组织学分化差(3/4级,不包括MSI-H者)、脉管浸润、神经浸润、送检淋巴结不足12枚、肠梗阻、肿瘤部位穿孔、切缘阳性或情况不明。此类病人推荐联合方案辅助化疗或氟尿嘧啶单药辅助化疗,总疗程为6个月。然而目前对Ⅱ期高危结直肠癌的定义并不恰当,许多II期高危结直肠癌患者并无复发,而一些Ⅱ期普危结直肠癌患者却有复发转移[7-8]。近年研究显示,在Ⅱ期结直肠癌中,dMMR/MSI-H表型的结直肠癌占20~22%,已有大量证据表明,dMMR/MSI-H是的Ⅱ期结直肠癌预后良好的标志,发生复发、转移的可能性小。因此,国家卫计生委,中华医学会肿瘤学分会《中国结直肠癌诊疗规范(2015版)》强烈推荐所有Ⅱ期结直肠癌患者应行MMR蛋白或MSI检测,不再认为具有dMMR/MSI-H表型,3/4级分化是Ⅱ期结直肠癌患者的高危因素,对于dMMR/MSI-H表型的Ⅱ期低危结直肠癌患者不推荐氟尿嘧啶类药物单药辅助化疗[7-8]。pMMR /MSS表型的Ⅱ期结直肠癌与dMMR/MSI-H表型的Ⅱ期低危患者相比预后较差,来自ACCENT数据的荟萃分析显示单独手术时,dMMR和pMMR的Ⅱ期结直肠癌患者的复发时间(TTR)和OS存在差异,5-FU辅助化疗能够缩小这种差异。后续的临床研究证实dMMR的Ⅱ期低危结直肠癌复发率明显低于pMMR的Ⅱ期结直肠癌。中国临床肿瘤学会(CSCO)结直肠癌诊疗指南2017版将Ⅱ期结直肠癌分层:T3N0M0伴低危因素(dMMR或MSI-H);T3N0M0伴普危因素;T3高危或T4N0M0。对Ⅱ期普危患者推荐氟尿嘧啶类单药辅助化疗或观察[9]。NCCN临床实践指南:结肠癌(2017.V2)规定对于MSS/MSI-L表型无高危因素的T3N0M0推荐临床试验或观察或考虑氟尿嘧啶类药物单药辅助化疗[16]。
肿瘤患者中Ⅱ型糖尿病发病率约为16%,Ⅱ型糖尿病患者患结直肠癌的风险增加,依赖于胰岛素的患者患结直肠癌的风险比糖代谢正常者高20~40%,Ⅱ型糖尿病患者患结直肠癌的预后也较差[17-18]。化疗药物可引起肿瘤患者血糖的波动,诱发或加重糖尿病。近年研究显示,氟尿嘧啶化疗能对人体糖代谢产生不良影响。动物实验证实氟尿嘧啶可损伤胰岛β细胞,致体内胰岛素减少,诱导高血糖症[19]。应用氟尿嘧啶化疗的结直肠癌患者约10%发生Ⅱ型糖尿病,治疗及预后呈显著的负相关,认为对氟尿嘧啶诱导Ⅱ型糖尿病的不良反应要给予高度重视[19-20]。雷替曲塞单药与氟尿嘧啶比较,其代谢途径不同,半衰期长,不需亚叶酸钙增敏,具有广泛的抗肿瘤活性,对糖代谢无影响或极少见。本试验组患者因合并2型糖尿病占62.5%,心电图异常占55%,故选用了雷替曲塞单药。结果证明,pMMR/MSS表型的Ⅱ期普危结肠癌/高位直肠癌患者采用雷替曲塞单药辅助化疗是安全、有效的,辅助化疗组复发率为5.0%,与非辅助化疗组比较有统计学差异(P=0.0184)。两组中的复发病例均为T3cN0合并2型糖尿病患者,且都是在2年内复发。初步研究结果提示,pMMR/MSS表型的Ⅱ期普危结肠癌/高位直肠癌(T3c N0)合并2型糖尿病患者易在2年内复发,应给予足够的重视。本研究观察雷替曲塞单药对pMMR/MSS表型的Ⅱ期普危结肠癌/高位直肠癌患者,特别是对合并Ⅱ型糖尿病患者的血糖无明显影响。氟尿嘧啶的心脏毒性也越来越受到关注,2014年欧洲临床肿瘤学会(The European Society for Medical Oncology,ESMO)结直肠癌指南推荐雷替曲塞作为因心脏危险因素而不适合氟尿嘧啶类药物化疗的标准替代。本研究对因心脏危险因素而不适合氟尿嘧啶类药物化疗的pMMR/MSS表型的Ⅱ期普危结肠癌/高位直肠癌患者,采用雷替曲塞单药辅助化疗未发生心脏毒性。结果表明,对pMMR/MSS表型Ⅱ期普危的结肠癌/高位直肠癌患者推荐雷替曲塞或氟尿嘧啶类单药辅助化疗具有临床价值。特别是pMMR/MSS表型的Ⅱ期普危(T3cN0)结肠癌/高位直肠癌合并Ⅱ型糖尿病患者或有心脏危险因素的患者可能在雷替曲塞单药辅助化疗中获益更大。本研究仅是单中心研究,且样本有限,有待于进一步扩大样本量来验证本研究结果。
[ 1 ] Siegel, Rebecca L, MiIIer, et al. Cancer statistics, 2016 [J]. CAA Cancer Journal for Clinicians, 2016, 66(1): 10-29.
[ 2 ] Wang Yi, Wang Jie, Xu Dongkui, et al. Analysis of 18 cases of Stage l colorectal cancer: before and after local relapse and distant metastasis [J]. Chin J Colorec Dis(Electronic Edition), 2016, 5(6):503-506.
[ 3 ] 蔡三军.结直肠肛管癌局部复发及远处转移. 循证结直肠肛管肿瘤学 [M]. 第1版.上海: 上海科学技术出版社, 2016, 400-454.
[ 4 ] 赵长林.结直肠癌肝转移转化治疗的相关问题[J/CD].中华普通外科学文献(电子版), 2014, 8(3), 6-9.
[ 5 ] 中华医学会外科分会胃肠外科学组, 中华医学会外科分会结直肠外科学组, 中国抗癌协会大肠癌专业委员会, 中国医师协会外科医师分会结直肠外科医师委员会, 中国医疗保健国际交流促进会结直肠癌肝转移治疗专业委员会.结直肠癌肝转移诊断和综合治疗指南(2016) [J]. 中华实用外科杂志, 2016, 36(8):858-869.
[ 6 ] Qin Yun, Liang Liping, Zheng Xingzheng, et al. Value of detection of DNA Mismatch repair proteins defi ciency by immunohistochemistry in predicting tumor microsatellite status [J]. Chin J Pathol, 2015,44(10): 704-708.
[ 7 ] Clinical Practice Guidelines in Oncology (NCCN Guidelines®),Colon Cancer, Version 2, 2016[OL]. www.nccn.org.
[ 8 ] 中华人民共和国卫生和计划生育委员会医政医管局, 中华医学会肿瘤学分会.结直肠癌诊疗规范(2015年版) [J]. 中华外科杂志 , 2015, 53(12): 881-894.
[ 9 ] 结直肠癌诊疗指南, 2017版[OL].中国临床肿瘤学会(CSCO),2016.12.
[ 10 ] 林秋兰, 赵丽华, 林竞, 等. MaxVision~(TM)即用型快速免疫组化一步法染色的病理应用 [J]. 诊断病理学杂志, 2008, 15(4):344-344.
[ 11 ] Alex AK, Siqueira S, Coudry R, et al. Response to Chemotherapy and Prognosis in Metastatic Colorectal Cancer With DNA Defi cient Mismatch Repair [J]. Clin Colorectal Cancer, 2017, 16(3): 228-239.
[ 12 ] 石迎雪, 郑杰.系统筛查微卫星不稳定性结直肠癌的意义和策略 [J]. 中华病理学杂志, 2015, 44(1): 9-14.
[ 13 ] Vilar E, Gruber SB. Microsatellite instability in colorectal cancer-the stable evidence [J]. Nat Rev Clin Oncol, 2010, 7(3): 53-162.
[ 14 ] Bartley AN, Luthra R, Saraiya DS, et al. Identification of cancer patients withLynch syndrome: clinically signifi cant discordances and problems in tissue-based mismatch repair testing [J]. Cancer prev Res(Phila), 2012, 5(2): 320-327.
[ 15 ] Merok MA, Ahlquist T, Ryrvik EC, et al. Microstellite instability has a positive Prognostic impact on stagell colorectal cancer after complete resection: results from a large, consecutive Norwegian series [J]. Ann Oncol, 2013, 24(5): 1274-1282.
[ 16 ] Clinical Practice Guidelines in Oncology (NCCN Guidelines®),Colon Cancer, Version 2, 2017[OL]. www.nccn.org.
[ 17 ] 张学, 季加孚, 徐兵河 主译. 结直肠癌.肿瘤遗传咨询[M].第3版.北京: 人民卫生出版社, 2016, 165-152.
[ 18 ] 程志祥, 王科明. 化疗对肿瘤患者血糖的影响及其对策 [J]. 中国肿瘤临床 , 2009, 36(20): 1194-1196.
[ 19 ] Feng JP, Chen JG, Yuan XL, et al. Mpact of 5-fiuoro uracll on glucose metabolism and pancreatic pathology in rats [J]. Zhong hua Wei Chang Wai ke Za Zhi, 2010, 13(12): 935-938.
[ 20 ] 戴月秋, 陶莉, 胡夕春, 等.化疗对恶性肿瘤合并糖尿病患者血糖的影响 [J]. 临床肿瘤学杂志, 2008, 13(3): 254-257.
