抑制MET对RAS突变型结肠癌细胞的抗肿瘤作用
2018-06-15宋娜白茗王凯李艳荣曲秀娟刘云鹏
宋娜 白茗 王凯 李艳荣 曲秀娟 刘云鹏
结直肠癌是常见的消化道恶性肿瘤,其发病率和死亡率在我国呈上升趋势。对于晚期结肠癌患者来说,化疗联合靶向治疗是标准治疗。在结肠癌的靶向药物中,单克隆抗体主要包括抗EGFR单克隆抗体(西妥昔单抗和帕尼单抗)和抗VEGF单克隆抗体(贝伐珠单抗),而小分子抑制剂只有多靶点抑制剂瑞戈非尼一种,其靶点包括VEGFR1-3、TIE2、KIT、RET、RAF1、BRAF、PDGFR 和FGFR等[1]。靶向药物因为靶点明确具有针对性的抗肿瘤作用,且口服方便,但因为存在肿瘤异质性容易出现耐药。除了已经研制的靶点,还有很多重要的癌基因参与了结肠癌的发生发展。因此,探索结肠癌更有效的治疗靶点具有重要的临床价值。
在众多的候选靶点中,跨膜酪氨酸激酶受体(receptor tyrosine kinase,RTKs)参与了多种肿瘤的发生发展,在肿瘤预后和药物耐药等方面发挥了重要作用。其中,MET受体酪氨酸激酶是近年来研究的热点靶点,其配体是肝细胞生长因子(hepatocyte growth factor,HGF)。MET自身突变或过表达,或通过与配体结合使下游信号发生级联反应,在调节细胞生长、细胞凋亡、细胞骨架形态结构,以及促进肿瘤细胞侵袭转移发生等生物行为过程中发挥重要作用[2]。研究提示,在结直肠癌中,从正常的上皮细胞到腺瘤以及结直肠癌,MET表达水平是逐步升高的[3]。MET高表达与结直肠癌的预后差相关[4],HGF/MET信号转导通路的活性是结直肠癌肝转移发生的关键因素[5-6]。另外,HGF/MET信号通路也参与了结肠癌抗EGFR单克隆抗体的耐药[7-8]。在我们的前期研究中,发现西妥昔单抗诱导相对耐药的细胞发生MET活化,并且证实了非配体依赖的MET磷酸化参与了结肠癌细胞对西妥昔单抗的耐药[8]。目前,MET抑制剂在晚期非小细胞肺癌和晚期胃癌等实体肿瘤的临床试验中显示了一定的疗效[9-10],因此MET抑制剂也极有可能用于结直肠的治疗。
对于RAS突变的结肠癌易发生肝转移且预后更差,相对的靶向治疗选择也更局限[11]。在晚期非小细胞肺癌的研究中提示,MET抑制剂tivantinib联合厄洛替尼在KRAS突变的患者中疗效更好[10],所以本研究探索了抑制MET在RAS突变型结肠癌中的抗肿瘤作用。本研究选择了4种常见的RAS突变型结肠癌细胞,应用siRNA敲除MET蛋白表达及常见MET抑制剂PHA-665752,在体内和体外实验中观察抑制MET对于RAS突变型结肠癌中的作用,为靶向MET治疗提供更多的依据。
资料与方法
一、细胞和主要试剂
人 结 肠 癌 细 胞 HCT-116、DLD-1、Lovo和HCT-15均购自中国科学院上海生物化学与细胞生物学研究所,胎牛血清购自美国Gibco公司,RPMI 1640培养基购自美国Hyclone公司。细胞生长于含有10%灭活胎牛血清、100 U/mL青霉素和100 ug/mL链霉素的RPMI 1640培养液中,于37 ℃、5% CO2的培养箱内培养。PHA-665752 购自美国Selleck公司,HGF购自美国R&D公司,噻唑蓝(MTT)购自美国Sigma公司。鼠抗人MET、兔抗人 phospho-MET、AKT、phospho-AKT、ERK1/2、Phospho-ERK1/2和Actin 抗体均购自美国Cell Signaling Technology公司。
二、MTT法检测细胞增殖抑制
在96孔板中接种HCT-116(5 000个/孔)和Lovo(8 000个/孔),设3个复孔。第二日待细胞贴壁后加入不同浓度的PHA-665752或进行MET siRNA,培养 48 h 后加入 5 mg/mL MTT 20 μl,培养4 h后加25 ul DMSO,测定570 nm的OD 值。细胞存活率(%)=(实验组OD 值-空白组OD值 )/(对照组OD值-空白组OD值)×100%。实验重复3次。
三、Western Blotting检测蛋白表达
处理细胞后加入100 μl裂解液,超声波破碎细胞,采用考马斯亮蓝方法进行蛋白定量后进行SDS-PAGE电泳。60 V恒压至蛋白进入分离胶后改为120 V恒压;采用60 V恒压转印3小时,5%脱脂牛奶封闭1小时后封闭一抗,4 ℃摇晃过夜。第二日,TBST 漂洗3次后加入辣根过氧化物酶标记的二抗,漂洗后应用增强化学发光法显像。
四、SiRNA转染敲除MET蛋白表达
在6孔板中接种HCT-116和Lovo,待细胞贴壁后,应用不含血清和抗生素的RPMI 1640培养液分别和Control siRNA/MET siRNA(5′-GCCUGAAUGAUGACAUUCU-3′)及阳离子脂质载体LipofectamineTM2000配置混合液,最后将两部分混合室温放置20分钟,加入含有1.5 mL不含血清和抗生素的RPMI 1640培养液的6孔板中,作用48小时后收取蛋白样品。
五、细胞克隆形成检测PHA-665752对细胞克隆形成的抑制作用
在12孔板中接种300个/孔HCT-116,待细胞贴壁后加入不同浓度的PHA-665752,14天后应用PBS清洗,晾干后用Giemsa染色。
六、HCT-116细胞裸鼠移植瘤的成瘤实验
8只3周龄裸鼠饲养一周后,每只皮下接种HCT-116细胞2×106个/200 μl。待瘤体积长到50 mm3[瘤体积=(肿瘤长径×肿瘤短径2)/2]后随机分为两组,一组隔日给予PHA-665752 30 mg/Kg(溶于10%聚乙二醇中)腹腔注射,一组给予等量10%聚乙二醇注射,2~3天测量小鼠体重及肿瘤大小,至第4周处死裸鼠,测量肿瘤长径和短径,称量移植瘤重量。
七、统计学分析
采用SPSS 17.0统计软件进行统计学分析。两组之间比较采用t检验,P<0.05为差异具有统计学意义。
结 果
一、RAS突变结肠癌细胞系的MET蛋白表达
选择4种RAS突变的结肠癌细胞系,包括 HCT-116、DLD-1、Lovo和 HCT-15,Western Blotting检测MET蛋白情况。结果显示四种RAS突变结肠癌细胞均表达MET蛋白(图1)。
二、siRNA敲除MET蛋白表达对RAS突变结肠癌细胞的增殖抑制作用
选择HCT-116和Lovo细胞,应用siRNA敲除MET蛋白,Western Blotting验证了敲除效率,MTT检测了敲除MET蛋白后对细胞增殖的抑制作用。HCT-116和Lovo细胞下调MET蛋白表达后细胞存活率分别变为80.4±4.5%和72.2±5.8%(图2)。
三、MET抑制剂PHA-665752对RAS突变结肠癌细胞的增殖抑制作用
选择HCT-116和Lovo细胞,应用不同浓度的MET抑制剂PHA-665752作用48小时,MTT检测PHA-665752对两种细胞的增殖抑制作用,发现PHA-665752对结肠癌细胞的增殖抑制作用呈明显的剂量依赖性。另外,应用细胞克隆形成实验检测PHA-665752对细胞克隆形成能力的影响,结果显示5μM PHA-665752作用HCT-116细胞的细胞克隆形成数目同对照组相比只有18±8%(图3)。
四、MET抑制剂PHA-665752对HCT-116细胞移植瘤的成瘤作用影响
为了进一步验证MET抑制剂PHA-665752对RAS突变的结肠癌细胞的体内作用,选择HCT-116建立裸鼠皮下移植瘤,给予腹腔注射PHA-665752观察皮下移植瘤成瘤大小。结果显示 PHA-665752可明显抑制HCT-116细胞的皮下移植瘤大小,用药第4周的肿瘤体积为300±72 mm3,对照组为608±59 mm3(t=5.731,P=0.005)(图4)。
五、MET抑制剂PHA-665752对增殖信号通路的影响
应用PHA-665752预处理细胞2 h后加入HGF刺激MET信号通路活化,Western Blotting检测MET通路主要蛋白及磷酸化表达。结果显示HGF能明显激活p-MET及下游p-AKT和p-ERK,而应用PHA-665752预处理能明显抑制HGF激活的p-MET、p-AKT和p-ERK, 提 示PHA-665752对MET/AKT/ERK信号通路有抑制作用(图5)。
讨 论
HGF/MET信号通路在多种肿瘤的增殖、存活、血管形成和侵袭转移等方面发挥了关键性的作用。另外,MET异常表达及活化会介导靶向药物耐药,导致治疗失败[12]。MET通路活化后不仅会发生下游信号的级联反应,还会与其它跨膜RTKs发生串话,增强其发挥的生物学行为[13-14]。因此,在MET异常表达的肿瘤中靶向MET治疗可能成为有前景的抗肿瘤疗法。
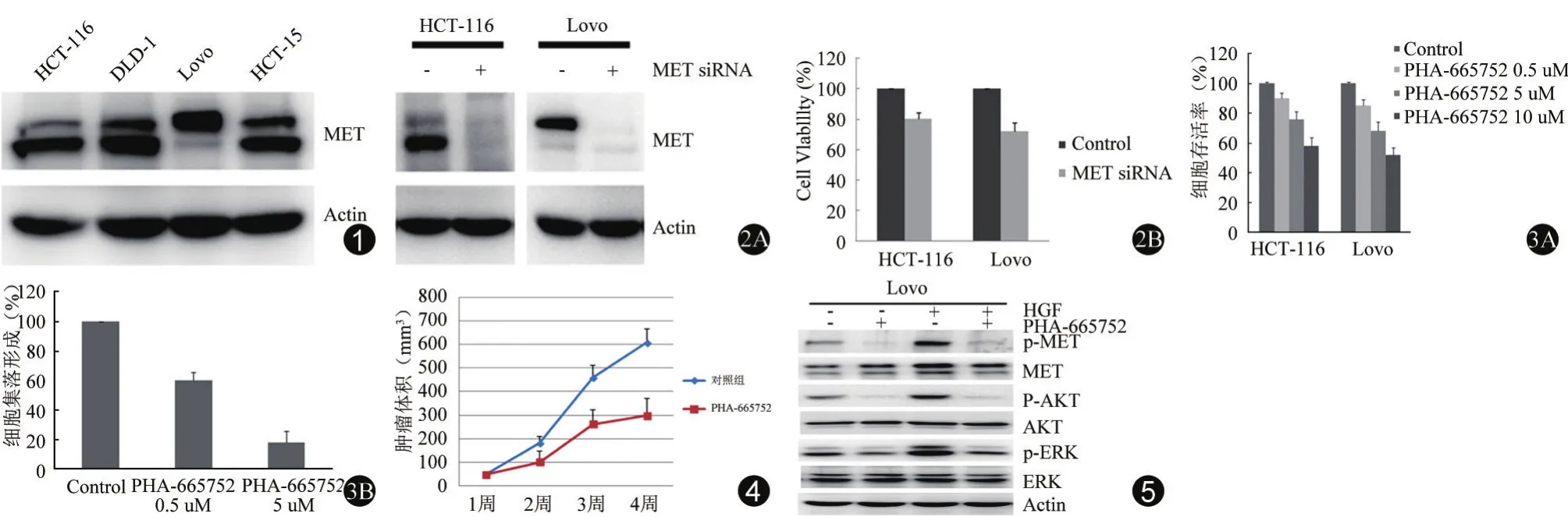
图1 4种RAS突变型结肠癌细胞系的MET蛋白表达量 图2 应用siRNA敲除MET蛋白表达对细胞增殖的影响。2A:在HCT-116和Lovo细胞中应用siRNA敲除MET蛋白表达,Western Blotting检测MET蛋白表达;2B:MTT法检测siRNA敲除MET蛋白后对细胞增殖的作用 图3 MET抑制剂PHA-665752对细胞增殖的影响。3A:在HCT-116和Lovo细胞中应用不同浓度PHA-665752作用48小时,MTT检测细胞存活;3B:在HCT-116应用不同浓度PHA-665752作用14天,染色后计数细胞克隆数目 图4 MET抑制剂PHA-665752对HCT-116裸鼠移植瘤的作用 图5 MET抑制剂PHA-665752对MET/AKT/ERK信号通路的作用。在Lovo细胞中应用PHA-665752预处理2小时后加入HGF,Western Blotting检测p-MET、p-AKT和p-ERK及本底的蛋白表达
近几年,临床上研发了多种MET抑制剂并开展了临床试验。其中比较成功的是克唑替尼(Crizotinib),它是靶向MET、ALK融合基因和ROS1的多靶点受体酪氨酸激酶,目前被批准用于EML4-ALK融合的肺腺癌患者,同时可用于MET基因扩增的肺癌患者[15]。另一种MET抑制剂(Tivantinib)联合厄洛替尼治疗二线以后非小细胞肺癌的Ⅲ期研究中,同对照组单药厄洛替尼相比,只延长了无进展生存时间(3.6个月 vs 1.9个月,P<0.001),并未提高总生存(8.5个月 vs 7.8个月,P=0.81)[16]。在结直肠癌的治疗中,开展了Tivantinib联合伊立替康和西妥昔单抗二线治疗KRAS野生型患者的Ⅱ期研究,对入组的117例患者进行分析,加入Tivantinib并未延长无进展生存时间(8.3个月 vs 7.3个月,P=0.38),亚组分析显示在免疫组化检测MET高表达PTEN低表达的患者中,Tivantinib有更好的疗效,但是由于患者例数较少不能得到明确结论[17]。本研究选择RAS突变结肠癌细胞,因为RAS突变的结肠癌患者预后更差,易发生肝转移,且靶向治疗有限,亟待研发新的有效靶点。在常见的四种RAS突变结肠癌细胞系中,均有MET蛋白表达。应用siRNA敲除MET蛋白表达对RAS突变结肠癌细胞的增殖抑制作用可达19.6~27.8%,而应用MET特异性抑制剂PHA-665752对两种细胞的增殖抑制作用呈剂量依赖性,同时细胞克隆形成实验验证PHA-665752可有效抑制长时间的细胞克隆形成。除了体外实验,本研究应用HCT-116细胞构建裸鼠皮下成瘤模型,给予PHA-665752单药腹腔注射,验证了PHA-665752可明显抑制HCT-116细胞的皮下移植瘤大小。在作用机制方面,应用MET的特异性配体HGF进行诱导刺激,证明了MET抑制剂可有效抑制MET/AKT/ERK信号通路,从而发挥肿瘤抑制作用。
本研究从体内体外实验均证实了抑制MET对RAS突变型结肠癌细胞的增殖抑制作用,为靶向MET治疗RAS突变型结肠癌患者提供了理论依据。目前关于抑制MET治疗恶性肿瘤患者的临床研究提示,并不是所有的患者对MET抑制剂有效,有限的结果提示MET基因扩增或者MET蛋白高表达的患者可能对抗MET治疗更有效,因此筛选出靶向MET治疗的优势人群是下一步的研究方向。
[ 1 ] Grothey A, Van Cutsem E, Sobrero A, et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer(CORRECT): an international, multicentre, randomised, placebocontrolled, phase 3 trial [J]. Lancet, 2013, 381 (9863): 303-312.
[ 2 ] Gherardi E, Birchmeier W, Birchmeier C, et al. Targeting MET in cancer: rationale and progress [J]. Nat Rev Cancer, 2012, 12(2):89-103.
[ 3 ] Gayyed MF, Abd E-Maqsoud NM, El-Hameed El-Heeny AA, et al.c-MET expression in colorectal adenomas and primary carcinomas with its corresponding metastases [J]. J Gastrointest Oncol, 2015,6(6): 618-627.
[ 4 ] Gao H, Guan M, Sun Z, et al. High c-Met expression is a negative prognostic marker for colorectal cancer: a meta-analysis [J]. Tumour Biol, 2015, 36(2): 515-520.
[ 5 ] Sun YL, Liu WD, Ma GY, et al. Expression of HGF and Met in human tissues of colorectal cancers: biological and clinical implications for synchronous liver metastasis [J]. Int J Med Sci,2013, 10(5): 548-559.
[ 6 ] Isella C, Mellano A, Galimi F, et al. MACC1 mRNA levels predict cancer recurrence after resection of colorectal cancer liver metastases[J]. Ann Surg, 2013, 257(6): 1089-1095.
[ 7 ] Liska D, Chen CT, Bachleitner-Hofmann T, et al. HGF rescues colorectal cancer cells from EGFR inhibition via MET activation [J].Clin Cancer Res, 2011, 17(3), 472-482.
[ 8 ] Song N, Liu S, Zhang J, et al. Cetuximab-induced MET activation acts as a novel resistance mechanism in colon cancer cells [J]. Int J Mol Sci, 2014, 15(4): 5838-5851.
[ 9 ] Kang YK, Muro K, Ryu MH, et al. A phase II trial of a selective c-Met inhibitor tivantinib (ARQ 197) monotherapy as a second- or thirdline therapy in the patients with metastatic gastric cancer [J]. Invest New Drugs, 2014, 32(2): 355-361.
[ 10 ] Sequist LV, von Pawel J, Garmey EG, et al. Randomized phase II study of erlotinib plus tivantinib versus erlotinib plus placebo in previously treated non-small-cell lung cancer [J]. J Clin Oncol, 2011,29(24): 3307-3315.
[ 11 ] De Roock W, Claes B, Bernasconi D, et al. Effects of KRAS, BRAF,NRAS, and PIK3CA mutations on the efficacy of cetuximab plus chemotherapy in chemotherapy-refractory metastatic colorectal cancer: a retrospective consortium analysis [J]. Lancet Oncol, 2010,11(8), 753-762.
[ 12 ] Corso S, Giordano S. Cell-autonomous and non-cell-autonomous mechanisms of HGF/MET-driven resistance to targeted therapies:from basic research to a clinical perspective [J]. Cancer Discov,2013, 3(9): 978-992.
[ 13 ] Dulak AM, Gubish CT, Stabile LP, et al. HGF-independent potentiation of EGFR action by c-Met [J]. Oncogene, 2011, 30(33):3625-3635.
[ 14 ] Varkaris A, Gaur S, Parikh NU, et al. Ligand-independent activation of MET through IGF-1/IGF-1R signaling [J]. Int J Cancer, 2013,133(7): 1536-1546.
[ 15 ] Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer [J]. N Engl J Med, 2014,371(23): 2167-2177.
[ 16 ] Scagliotti G, von Pawel J, Novello S, et al. Phase III Multinational,Randomized, Double-Blind, Placebo-Controlled Study of Tivantinib(ARQ 197) Plus Erlotinib Versus Erlotinib Alone in Previously Treated Patients With Locally Advanced or Metastatic Nonsquamous Non-Small-Cell Lung Cancer [J]. J Clin Oncol, 2015, 33(24):2667-2674.
[ 17 ] Eng C, Bessudo A, Hart LL, et al. A randomized, placebo-controlled,phase 1/2 study of tivantinib (ARQ 197) in combination with irinotecan and cetuximab in patients with metastatic colorectal cancer with wild-type KRAS who have received first-line systemic therapy [J]. Int J Cancer, 2016, 139(1): 177-186.
