甘丙肽及其受体在孕期应激大鼠新生子代前额叶皮层和海马脑区表达的性别差异
2018-06-14徐涛董柯梦王彤王文娇李慧石翠格杨予涛徐志卿
徐涛,董柯梦,王彤,王文娇,李慧,石翠格,杨予涛,徐志卿,4*
(1.首都医科大学基础医学院神经生物学系,北京神经修复与再生重点实验室,北京 100069;2.首都医科大学基础医学院人体解剖与组织胚胎学系,北京 100069;3.国家卫生计生委科学技术研究所,北京 100081;4.首都医科大学北京脑重大疾病研究院,科技部北京脑重大疾病重点实验室,北京 100069)
临床研究表明,孕期应激母亲所生新生儿易出现出生体重低及运动能力差等情况[1-2],且其童年可表现出抑郁、焦虑以及认知障碍等[3-4]。动物实验研究表明孕期应激可延长大鼠的怀孕周期[5]、降低新生鼠成活率和雄鼠出生体重[6]、增加子代大鼠青少年时期[7-8]或成年时期的抑郁样行为[9-14]。因此,母体孕期环境对子代脑发育及成年后神经行为具有重大影响。本研究采用大鼠孕期束缚模型,观察子代出生体重和性别比,选择与认知和情绪性疾病高度相关的两个脑区:前额叶皮层(PFC)和海马,研究子代PFC和海马甘丙肽(GAL)、甘丙肽受体(GALRs)、脑源性神经营养因子(BDNF)和酪氨酸激酶B(TrkB)的表达,并在此基础上探讨孕期应激致子代脑发育异常的性别差异,进而为今后临床胎儿和新生儿脑发育障碍的早期干预奠定基础。
材料和方法
一、实验动物和分组
6只成年雄性SD大鼠(180~200 g),12只成年雌性SD大鼠(160~180 g),由北京维通利华实验动物技术有限公司提供[许可证号:SCXK(京)2016-0011]。实验用SD大鼠领取后,先雌雄分开(3只一笼)饲养3 d,使大鼠适应新的饲养环境。动物饲养房室温保持在(23±1)℃,湿度维持在(50±5)%,12 h昼夜循环,自由进食饮水。3 d后雌雄SD大鼠合笼(两雌一雄),每日早晨8点观察有无阴道栓。以见栓日作为怀孕第1天,即孕1 d。怀孕大鼠3只一笼分开饲养,并随机分为对照组及孕期应激组(每组各6只)。本研究经首都医科大学动物伦理委员会审批通过。
二、实验方法
1. 孕期应激大鼠模型:孕期应激组雌鼠孕8 d至孕21 d,每日同一时间段内给予孕期应激组大鼠束缚应激2 h,1次/d。束缚后放回笼内。待临近生产时将全部孕期应激组孕鼠单笼饲养。对照组孕鼠常规饲养不做任何处理,待临近生产时单笼饲养。SD大鼠分娩日(记为子代P0 d)记录产仔数,计算雌雄比例并称量子代体重。孕鼠产后1周后依次进行糖水偏好实验、旷场实验和强迫游泳实验。为防止个体误差,入组子代来自不同的母鼠。
2. 糖水偏好实验:实验前3 d开始对大鼠进行糖水预适应。将1%蔗糖水及清水置于大鼠笼上,每12 h交换位置,使大鼠适应糖水味道。实验前对大鼠禁水12 h。实验时将大鼠单独置于干净的笼内,不放置任何食物。将事先称重的干燥糖水瓶及干燥清水瓶置于笼上,大鼠在安静无打扰的环境中自由饮水1 h。实验结束后对糖水瓶及清水瓶称重,计算每只大鼠的糖水消耗率[糖水饮用量/(糖水饮用量+清水饮用量)×100%]。
3. 旷场实验:将大鼠置于底壁黑色的旷场箱中央格内(150 cm×150 cm×60 cm),旷场箱被平均分为25个同样大小的方格。大鼠可自由在旷场箱内探索5 min。采用双盲法记录其间大鼠水平穿格次数及直立次数。
4. 强迫游泳实验:将大鼠置于玻璃缸(高70 cm,直径40 cm)中,水深约40 cm,水温(25±2)℃。每次实验持续5 min。实验过程由摄像机记录,之后经双盲法计算每只大鼠的攀爬时间(剧烈的运动伴随前爪不断的进出水面,身体常常竖直贴靠侧壁)及不动时间(大鼠停止挣扎仅漂浮在水中或仅有必要的轻微动作以保持头部在水面以上)。
5. 大鼠脑组织总RNA提取及反转录:按窝别随机取P0 d雌雄子鼠各6只,剥离整脑后,根据大鼠脑立体定位图谱迅速分离PFC、海马,并置于干冰预冷的EP管中。应用RNeasy Lipid Tissue Mini Kit试剂盒(QIAGEN,德国)提取脑组织总RNA,经紫外分光光度计(Nano Drop 2000)测定样品RNA浓度及OD260/OD280比值。应用Transcriptor First Strand cDNA Synthesis Kit试剂盒(ROCHE,瑞士)将1 μg脑组织中提取的总RNA反转为cDNA。
6. 实时定量PCR(Q-PCR):应用反转录成的cDNA及SYBR Green试剂(Life Technologies,美国)进行Q-PCR反应。Q-PCR体系分为8 μl,循环条件为:60℃ 2 min,95℃ 10 min,40个循环中包括95℃变性15 s,60℃延伸1 min。结果运用2-ΔΔCt相对Q-PCR分析方法进行分析。Q-PCR引物序列见表1。

表1 引物序列
三、统计学处理

结 果
一、孕期束缚应激对SD大鼠抑郁样行为的影响
孕鼠产后1周后开始检测产后大鼠的抑郁样行为,包括糖水偏好实验、旷场实验以及强迫游泳实验。在抑郁样行为判定的金标准糖水偏好实验中,孕期束缚组大鼠的糖水消耗率较对照组显著降低,差异有统计学意义(P<0.001)(图1A)。在旷场实验中,两组大鼠的水平运动得分及垂直运动得分均无显著性差异(P0.05)(图1B、C)。在强迫游泳实验中,孕期应激组大鼠的不动时间显著延长,而攀爬时间显著缩短,差异有统计学意义(P<0.05)(图1D、E)。
二、孕期束缚应激对SD大鼠新生子代体重的影响
孕期应激组和对照组的子代大鼠在出生日测量体重结果显示,孕期应激组P0 d的体重较对照组的子代大鼠体重显著减轻,差异有统计学意义(P<0.01)(表2)。
三、孕期束缚应激对SD大鼠产仔数及子代雌雄比的影响
两组大鼠产仔数和子代出生日性别比结果显示,孕期应激组大鼠平均产仔数及子代雌雄比有升高趋势,但差异无统计学意义(P0.05)(表3)。
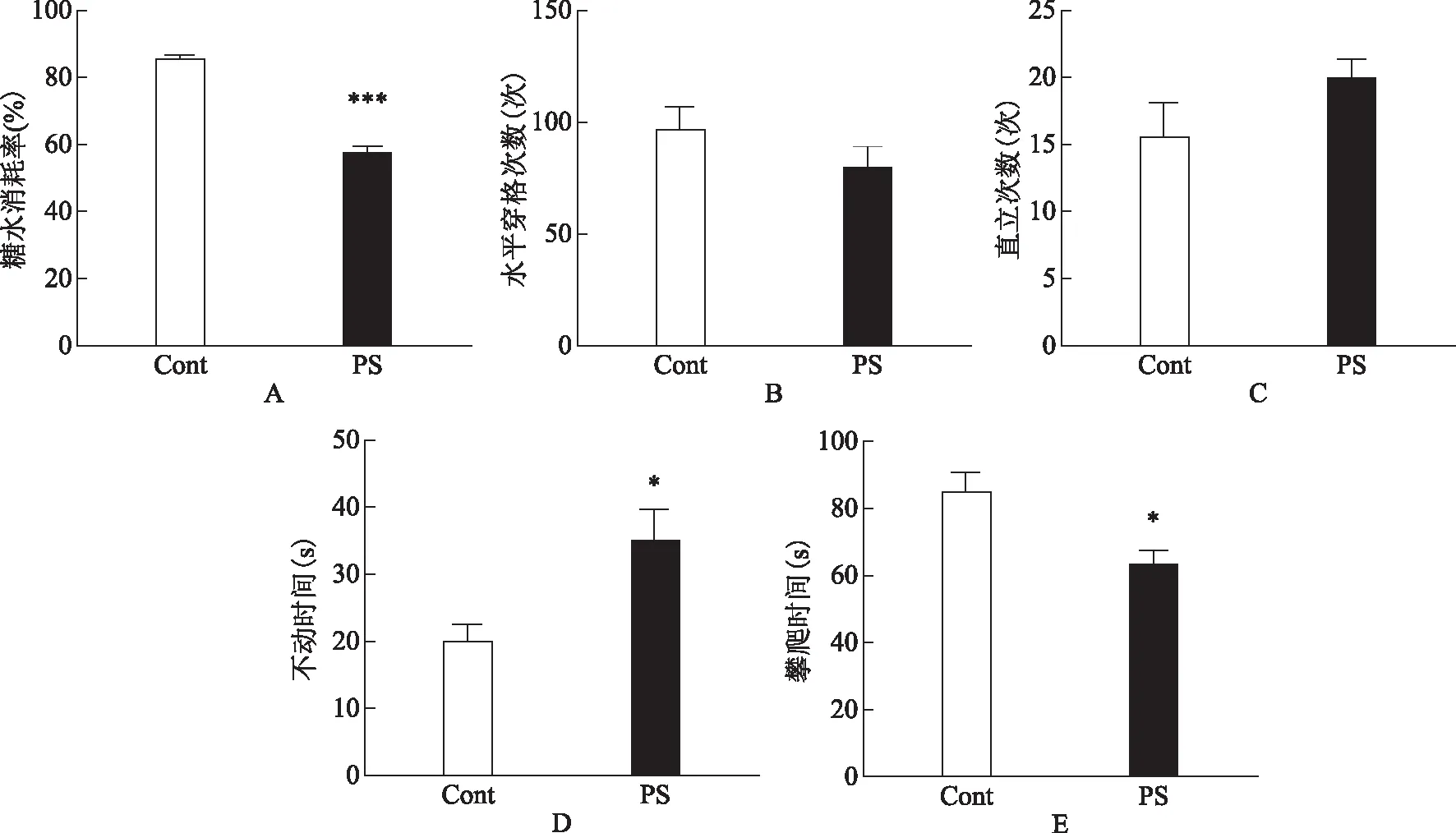
A:两组大鼠糖水偏好实验糖水消耗率比较;B:两组大鼠旷场实验水平运动得分比较;C:两组大鼠旷场实验垂直运动得分比较;D:两组大鼠强迫游泳实验不动时间比较;E:两组大鼠强迫游泳实验攀爬时间比较。Cont:对照组;PS:孕期应激组。与对照组比较,*P<0.05,***P<0.001图1 两组大鼠抑郁样行为的检测结果

组 别子代鼠数量体重(g)对照组 667.57±0.23孕期应激组776.45±0.19**
注:与对照组比较,**P<0.01

表3 两组大鼠平均产仔数和子鼠出生性别比(-±s)
四、孕期束缚应激对子代新生鼠脑组织中GAL、GALRs、BDNF、TrkB在PFC的表达影响
统计分析表明,孕期应激组子代雌性大鼠P0 d PFC中的GALR1 mRNA及BDNF mRNA表达水平较对照组显著降低[分别为(0.51±0.13)vs.(1.04±0.11)、(0.73±0.07)vs.(1.11±0.10)],差异有统计学意义(P<0.05);雄性大鼠相应基因表达水平与对照组相比差异无统计学意义(P0.05)(图2B、E)。孕期应激组子代雄性大鼠P0 d PFC中的TrkB mRNA表达水平较对照组显著升高[(1.35±0.12)vs.(1.00±0.07)],差异有统计学意义(P<0.05);雌性大鼠相应基因表达水平与对照组相比差异无统计学意义(P0.05)(图2F)。孕期应激组子代雌、雄性大鼠P0 d PFC中GAL mRNA、GALR2 mRNA、GALR3 mRNA表达水平与对照组相比差异均无统计学意义(P0.05)(图2A、C、D)。
五、孕期束缚应激对子代GAL、GALRs、BDNF、TrkB在海马中表达的影响
统计分析表明,孕期应激组子代雌性大鼠P0 d海马中的GAL mRNA表达水平较对照组显著升高[(2.51±0.18)vs.(1.00±0.11)],BDNF mRNA表达水平较对照组显著降低[(0.75±0.05)vs.(1.00±0.03)],差异有统计学意义(P<0.01);雄性大鼠相应基因表达水平与对照组比较差异均无统计学意义(P0.05)(图3A、E)。孕期应激组子代雌、雄性大鼠P0 d海马中的GALR1 mRNA、GALR2 mRNA、GALR3 mRNA及TrkB mRNA表达水平与对照组比较差异均无统计学意义(P0.05)(图3B~D、F)。
对照组;孕期对照组A:GAL mRNA的相对表达量比较;B:GALR1 mRNA的相对表达量比较;C:GALR2 mRNA的相对表达量比较;D:GALR3 mRNA的相对表达量比较;E:BDNF mRNA的相对表达量比较;F:TrkB mRNA的相对表达量比较。与对照组比较,*P<0.05图2 两组子代大鼠PFC脑区GAL、GALRs、BDNF、TrkB mRNA表达结果
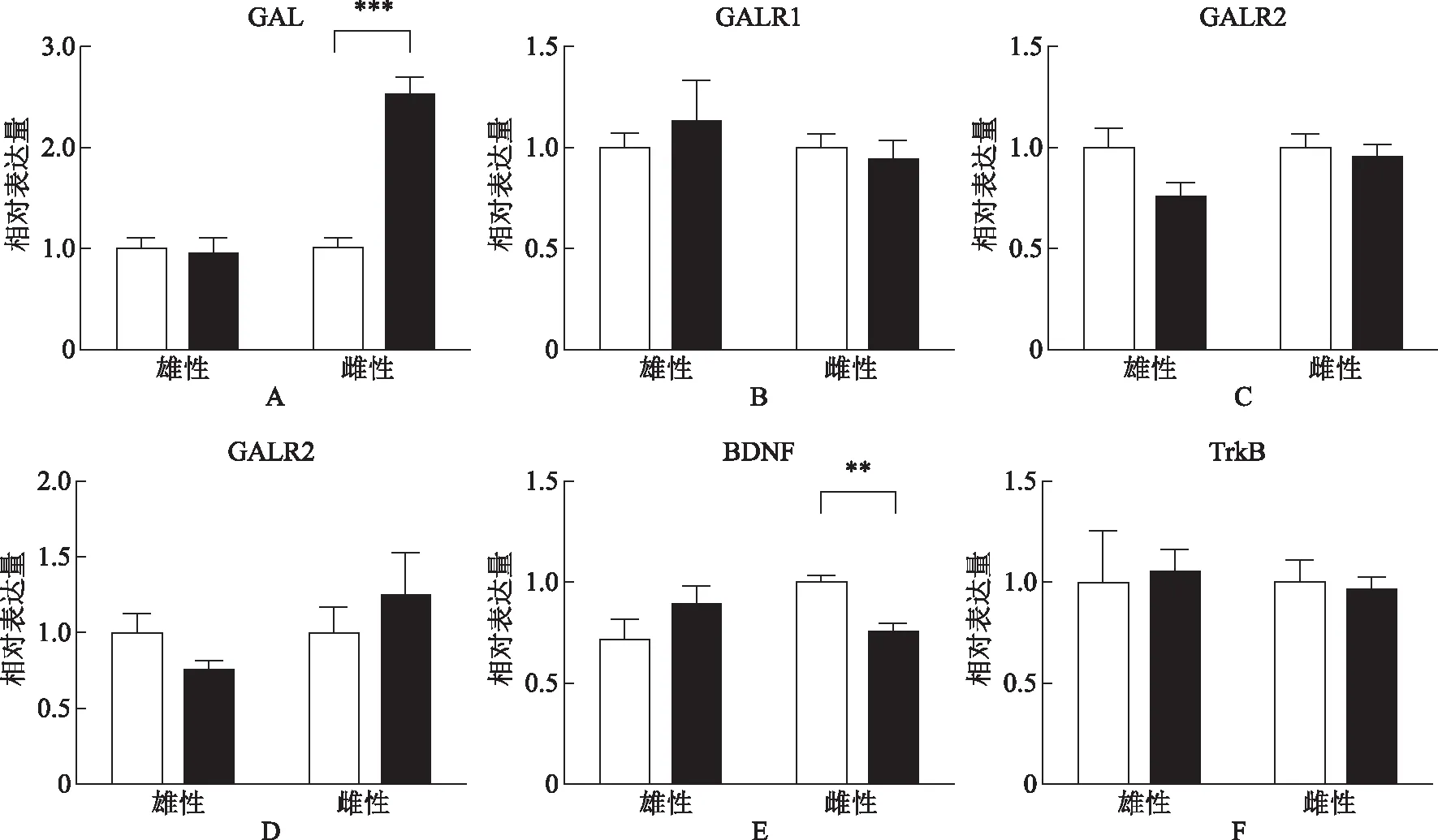
对照组;孕期对照组A:GAL mRNA的相对表达量比较;B:GALR1 mRNA的相对表达量比较;C:GALR2 mRNA的相对表达量比较;D:GALR3 mRNA的相对表达量比较;E:BDNF mRNA的相对表达量比较;F:TrkB mRNA的相对表达量比较。与对照组比较,**P<0.01;***P<0.001图3 两组子代大鼠海马脑区GAL、GALRs、BDNF、TrkB mRNA表达结果
讨 论
孕妇抑郁症患者的神经内分泌改变可直接造成胎儿脑发育异常,造成成年后一系列神经行为障碍[15]。本研究通过抑郁行为学检测,发现孕期应激组母鼠糖水偏好率、强迫游泳时间和不动时间较对照组均有显著差异(P<0.05),说明本研究中的孕鼠具有明确的抑郁行为,为我们研究子代脑发育提供了良好的病理模型。
在母鼠孕期应激过程中,可导致糖皮质激素增高,从而影响蛋白质分解转化过程,进而导致储备不足,这将破坏胎盘和胎儿的正常构建。本实验中,孕期应激组子代体重较对照组显著性降低(P<0.05),且其子代的雌雄比较对照组有增高的趋势。以上结果提示孕期应激影响了子代的发育过程。
PFC和海马是与应激和情绪性疾病高度相关的脑区[16-17]。在海马脑区:孕期应激组雌性子代鼠GAL mRNA表达水平较对照组显著增高,BDNF mRNA表达显著下降(P<0.05);在雄性子代鼠,孕期应激组与对照组几项指标比较均无显著性差异(P0.05)。相关电生理实验表明GAL能够抑制海马CA1区椎体细胞的兴奋性突触后电位,抑制海马脑区兴奋性氨基酸的释放[18]。BDNF mRNA的表达降低也提示该脑区可能存在突触可塑性降低,且GAL和BDNF可能发生了协同作用。因而,子代雌鼠脑区变化,可能在一定程度上降低了细胞的兴奋性。在PFC,雌性子代鼠GALR1和BDNF mRNA的表达显著下降,而雄鼠TrkB mRNA表达较对照显著增加(P<0.05)。GALR1主要通过激活Gi/o介导抑制功能,GAL在蓝斑中与去甲肾上腺素共存[19];在中缝背核中与五羟色胺(5-HT)共存[20-21]。PFC是蓝斑和中缝背核主要的上行投射区之一,因此雌性子代大鼠有可能成年后发生抑郁行为,雄性子代大鼠TrkB mRNA表达增加可能发挥代偿性的保护作用。关于孕期应激引起的子代神经系统发育的形态学和远期行为学改变,后期我们将继续关注并进行深入探讨。
综上所述,大鼠孕期应激可对子代大鼠脑发育产生影响,且对雌性子代的影响较雄性子代更大,具有性别差异。
【参 考 文 献】
[1] Field T,Diego M,Hernandez-Reif M. Prenatal depression effects on the fetus and newborn:a review[J].Infant Behav Dev,2006,29:445-455.
[2] Field T,Diego M,Hernandez-Reif M. Prenatal dysthymia versus major depression effects on the neonate[J].Infant Behav Dev,2008,31:190-193.
[3] Garber J,Weersing VR. Comorbidity of anxiety and depression in youth:implications for treatment and prevention[J].Clin Psychol(New York),2010,17:293-306.
[4] Van Lieshout RJ,Boylan K. Increased depressive symptoms in female but not male adolescents born at low birth weight in the offspring of a national cohort[J].Can J Psychiatry,2010,55:422-430.
[5] Wilson CA,Terry AV Jr. Variable maternal stress in rats alters locomotor activity,social behavior,and recognition memory in the adult offspring[J].Pharmacol Biochem Behav,2013,104:47-61.
[6] 石翠格,李慧,王丽丽,等.妊娠期慢性束缚对子代新生鼠发育的影响[J].生殖医学杂志,2014,23:58-60.
[7] Guan L,Jia N,Zhao X,et al. The involvement of ERK/CREB/Bcl-2 in depression-like behavior in prenatally stressed offspring rats[J].Brain Res Bull,2013,99:1-8.
[8] Jia N,Li Q,Sun H,et al. Alterations of group I mGluRs and BDNF associated with behavioral abnormity in prenatally stressed offspring rats[J].Neurochem Res,2015,40:1074-1082.
[9] Abe H,Hidaka N,Kawagoe C,et al. Prenatal psychological stress causes higher emotionality,depression-like behavior,and elevated activity in the hypothalamo-pituitary-adrenal axis[J].Neurosci Res,2007,59:145-151.
[10] Butkevich I,Mikhailenko V,Vershinina E,et al. Maternal buspirone protects against the adverse effects of in utero stress on emotional and pain-related behaviors in offspring[J].Physiol Behav,2011,102:137-142.
[11] Fujita S,Ueki S,Miyoshi M,et al. “Green odor” inhalation by stressed rat dams reduces behavioral and neuroendocrine signs of prenatal stress in the offspring[J].Horm Behav,2010,58:264-272.
[12] Glombik K,Stachowicz A,Slusarczyk J,et al. Maternal stress predicts altered biogenesis and the profile of mitochondrial proteins in the frontal cortex and hippocampus of adult offspring rats[J].Psychoneuroendocrinology,2015,60:151-162.
[13] Sickmann HM,Arentzen TS,Dyrby TB,et al. Prenatal stress produces sex-specific changes in depression-like behavior in rats:implications for increased vulnerability in females[J].J Dev Orig Health Dis,2015,6:462-474.
[14] Zohar I,Dosoretz-Abittan L,Shoham S,et al. Sex dependent reduction by prenatal stress of the expression of 5HT1A receptors in the prefrontal cortex and CRF type 2 receptors in the raphe nucleus in rats:reversal by citalopram[J].Psychopharmacology(Berl),2015,232:1643-1653.
[15] Fatima M,Srivastav S,Mondal AC. Prenatal stress and depression associated neuronal development in neonates[J].Int J Dev Neurosci,2017,60:1-7.
[16] Lai T,Payne ME,Byrum CE,et al. Reduction of orbital frontal cortex volume in geriatric depression[J].Biol Psychiatry,2000,48:971-975.
[17] Bremner JD,Narayan M,Anderson ER,et al. Hippocampal volume reduction in major depression[J].Am J Psychiatry,2000,157:115-118.
[18] Mazarati AM,Liu H,Soomets U,et al. Galanin modulation of seizures and seizure modulation of hippocampal galanin in animal models of status epilepticus[J].J Neurosci,1998,18:10070-10077.
[19] Melander T,Hokfelt T,Rokaeus A. Distribution of galaninlike immunoreactivity in the rat central nervous system[J].J Comp Neurol,1986,248:475-517.
[20] Lu X,Barr AM,Kinney JW,et al. A role for galanin in antidepressant actions with a focus on the dorsal raphe nucleus[J].Proc Natl Acad Sci U S A,2005,102:874-879.
[21] Xu ZQ,Hokfelt T. Expression of galanin and nitric oxide synthase in subpopulations of serotonin neurons of the rat dorsal raphe nucleus[J].J Chem Neuroanat,1997,13:169-187.
