亚砷酸钠对胚胎p66Shc表达调控的机制研究
2018-06-14高小博张辰郑盼盼骆海燕马旭陆彩玲
高小博,张辰#,郑盼盼,骆海燕,马旭,陆彩玲*
(1.国家卫生计生委科学技术研究所遗传优生中心,北京 100081;2. 北京协和医学院研究生院,北京 100005)
砷是环境中普遍存在的一种类金属元素,其在环境中以有机砷化合物和无机砷化合物的形式存在,无机砷化合物主要以三价砷和五价砷化合物为主[1]。亚砷酸钠暴露严重影响胚胎神经、心血管等多个系统的正常发育,从而导致胚胎发育迟缓甚至出现畸形[2-3]。有研究认为氧化应激是亚砷酸钠诱导的胚胎以及细胞毒性的可能机制之一,亚砷酸钠通过降低过氧化氢酶的活性,增加超氧化物歧化酶活性,打破细胞内的氧化还原平衡,从而使得细胞内活性氧(ROS)水平升高[4]。
p66Shc是调控细胞氧化应激的关键蛋白,对线粒体ROS代谢起重要的调控作用[5]。我们实验室前期报道显示小鼠胚胎经亚砷酸钠处理后,卵裂受到明显的抑制,滞留在2-细胞期的胚胎比例升高,而发育至囊胚期的胚胎数量明显降低,进一步研究发现亚砷酸钠通过扰乱p66Shc相关的氧化还原平衡状态,使谷胱甘肽(GSH)水平降低,ROS水平升高,引起胚胎毒性[6]。原核注射p66Shc siRNA降低胚胎ROS水平,促进胚胎从2-细胞期向桑葚期的发育过程,从而缓解亚砷酸钠引起的小鼠胚胎育异常[7]。亚砷酸钠暴露导致斑马鱼胚胎神经发育迟缓、心脏环化异常、心包水肿、躯干弯曲以及尾部发育异常,而抗氧化剂叶酸能够缓解亚砷酸钠引起的发育异常,进一步的体外实验结果表明叶酸通过抑制p66Shc的表达,降低细胞ROS水平,从而拮抗亚砷酸钠引起的生长发育相关基因表达的下调[8-9]。朱海英等[10]在研究中发现亚砷酸钠刺激引起心肌细胞ROS水平升高,p66Shc表达上调,第36位丝氨酸磷酸化水平升高。以上研究表明p66Shc在亚砷酸钠诱导的氧化应激机制中发挥重要的作用。然而,亚砷酸钠引起胚胎p66Shc表达上调的分子机制尚不明确。
Sirtuin 1(Sirt1)是一种高度保守的烟酰胺腺嘌呤二核苷酸(NAD+)依赖的Ⅲ型组蛋白去乙酰化酶。Sirt1在体内能够参与衰老、免疫、发育、代谢等多种重要的生理活动。一些研究表明Sirt1对小鼠胚胎滋养细胞的正常分化、胚胎干细胞干性的维持以及心脏发育过程中心肌细胞的双核化有重要的调控作用[11-13]。Kumar等[14]研究发现Sirt1通过调控p66Shc的赖氨酸乙酰化介导了糖尿病诱导的血管氧化应激和内皮功能障碍。Zhou等[15]报道显示在高糖暴露的人脐静脉内皮细胞中Sirt1通过与p66Shc启动子区域相结合,引起与p66Shc启动子区域结合的组蛋白H3的乙酰化程度降低,从而负调控p66Shc的表达。由此可见Sirt1在氧化应激引起的组织细胞损伤过程中发挥重要的作用,但是在亚砷酸钠诱导的氧化应激机制中,Sirt1发挥的作用以及与p66Shc之间的表达调控关系未见报道,因此本研究以Sirt1为切入点,探究了亚砷酸钠对胚胎p66Shc表达调控的分子作用机制。
材料和方法
一、实验材料
HEK293ET细胞属于人胚胎肾上皮细胞系,购自北京协和医学院细胞中心。培养在37℃、5%CO2的饱和湿度条件下,用含10%胎牛血清的高糖DMEM培养基(Hyclone,美国)培养。待细胞生长至90%左右时,用浓度为0.25%的胰蛋白酶消化细胞,1/3传代继续培养;2/3接种于细胞培养板内待细胞生长至对数生长期时进行实验。
二、研究方法
1. 药物及试剂的配制:亚砷酸钠用灭菌水将其配成1 mol/L的贮存液,贮存于-80℃冰箱,分装备用。实验时利用培养基将其稀释成5 μmol/L的使用浓度。根据Silencer select Pre-designed siRNA说明书操作步骤,向包含siRNA粉末的管中加入50 μl无RNA酶水,配制成终浓度为50 μmol/L siRNA储备液,分装后-80℃保存,转染时利用Opti-MEM培养基稀释至100 nmol/L的工作浓度。
2. siRNA转染细胞:Sirt1-siRNA和对照siRNA均购自于美国Invitrogen公司,Sirt1 siRNA转染设为实验组,对照siRNA转染为对照组。其中Sirt1-siRNA序列为:sense:5′-CCCUGUAAAGCUUUCAGAA(dTdT)-3′;antisense:5′-UUCUGAAAGCUUUACAGGG(dTdT)-3′。HEK293ET细胞被种植于12孔板内,待细胞生长至50%~60%融合时根据转染试剂lip2000(Thermo,美国)说明书建议的操作步骤进行转染。siRNA工作浓度为100 nmol/L,转染24 h后收集细胞样品提取蛋白质进行Western Blot检测。
3. 亚砷酸钠处理细胞:HEK293ET细胞生长到70%~80%融合时加入5 μmol/L亚砷酸钠培养基处理24 h,对照组未经亚砷酸钠处理,收集细胞样品进行检测。对于siRNA转染的HEK293ET细胞,待siRNA转染24 h后,更换培养基,加入5 μmol/L亚砷酸钠培养基处理24 h,收集细胞样品进行检测。
4. Western Blot检测:HEK293ET细胞样品收集后加入细胞裂解液50 μl,冰上裂解0.5 h,12 000 rpm离心15 min,收集上清。二喹啉甲酸法定量蛋白浓度,12%聚丙烯酰氨凝胶分离蛋白,300 mA湿转2 h至硝酸纤维素膜。5%脱脂牛奶封闭1 h,加入适量稀释比例的一抗p66Shc(兔多克隆抗体,Santa Cruz,美国,1∶800)、Sirt1(兔多克隆抗体,Santa Cruz,美国,1∶1 000)、β-actin(小鼠单克隆抗体,Sigma,美国,1∶2 000),4℃孵育过夜,1×TBST洗膜3次,1∶2 000稀释二抗[辣根过氧化物酶(HRP)标记的山羊抗兔IgG和山羊抗小鼠IgG(北京中杉金桥生物)],室温孵育1 h,1×TBST 洗膜3次,增强化学发光法(ECL)显影,用Image J软件定量分析蛋白条带灰度值。
5.细胞RNA的提取以及实时定量PCR(Q-PCR)分析检测:HEK293ET细胞经亚砷酸钠处理后收集细胞样品,加入RNA提取试剂TRIzol(Invitrogen,美国)提取RNA。取1 μg RNA,利用反转录试剂盒(TAKARA,日本)将RNA反转录为cDNA。以cDNA作为模板,采用Q-PCR仪器(ABI Prism 7500,美国)检测细胞p66Shc和β-actin mRNA的水平,其中β-actin为内参对照。p66Shc和β-actin的Q-PCR引物序列如表1所示,Q-PCR引物均由华大基因公司(中国)合成。

表1 PCR引物序列
三、统计学分析
数据分析采用GraphPad Prism 5.0软件进行统计学分析,两组之间数据比较采用t检验,P<0.05为差异有统计学意义。
结 果
一、亚砷酸钠处理引起p66Shc转录水平升高
我们课题组前期研究表明亚砷酸钠处理引起胚胎p66Shc表达水平的升高,为了进一步探究分子机制,我们利用HEK293ET细胞,检测亚砷酸钠对p66Shc转录水平的影响。结果显示,与对照组相比,5 μmol/L亚砷酸钠处理组p66Shc转录水平显著升高,差异具有统计学意义(P<0.001)(图1)。

与未经亚砷酸钠处理组比较,***P<0.001图1 亚砷酸钠处理引起p66Shc转录水平升高
二、亚砷酸钠抑制Sirt1的表达
为了探究亚砷酸钠暴露条件下Sirt1和p66Shc的表达调控关系,我们检测了亚砷酸钠对Sirt1表达情况的影响。结果显示,与对照组相比,5 μmol/L亚砷酸钠处理组Sirt1的蛋白水平显著降低(图2 A),灰度分析结果显示5 μmol/L亚砷酸钠处理组Sirt1的蛋白表达水平较对照组降低约60%,差异具有统计学意义(P<0.001)(图2 B)。

A:Western Blot检测亚砷酸钠处理后Sirt1的表达情况;B:Sirt1的灰度分析柱状图;与未经亚砷酸钠处理组比较,***P<0.001图2 亚砷酸钠抑制Sirt1的表达
三、siRNA抑制Sirt1的表达
为了检测亚砷酸钠处理后Sirt1对p66Shc表达情况的影响,需要对Sirt1进行敲低,100 nmol/L对照siRNA和Sirt1 siRNA分别转染HEK293ET细胞,转染24 h后收集细胞进行检测。结果显示,对照siRNA转染组与未转染组相比,Sirt1的表达未出现明显的变化,Sirt1 siRNA转染组与对照siRNA转染组相比Sirt1的表达显著降低(图3A),灰度分析结果显示Sirt1 siRNA转染组Sirt1的表达水平较对照siRNA转染组降低约80%,差异具有统计学意义(P<0.001)(图3 B)。

A:Western Blot检测未转染组、对照 siRNA转染组和Sirt1 siRNA转染组细胞Sirt1的表达情况;B:未转染组、对照 siRNA转染组和Sirt1 siRNA转染组Sirt1的灰度分析柱状图;Con:未转染对照组;si-NC:对照siRNA转染组;si-Sirt1:Sirt1 siRNA转染组;与si-NC组比较,***P<0.001图3 siRNA抑制Sirt1的表达
四、亚砷酸钠通过Sirt1调控p66Shc的表达
为了检测亚砷酸钠处理后Sirt1对p66Shc表达的影响,100 nmol/L对照siRNA和Sirt1 siRNA分别转染细胞,转染24 h后更换培养基,加入含有5 μmol/L亚砷酸钠的培养基处理24 h,收集细胞样品进行检测。结果显示,在5 μmol/L亚砷酸钠暴露的条件下,Sirt1 siRNA转染组Sirt1的表达较对照siRNA转染组明显降低,而p66Shc的表达明显升高(图4A),灰度分析结果显示亚砷酸钠暴露的条件下,与对照siRNA转染组相比,Sirt1 siRNA转染组Sirt1的表达水平降低幅度超过90%,差异具有统计学意义(P<0.001)(图4 B),而Sirt1 siRNA转染组p66Shc的表达水平是对照siRNA转染组的约1.9倍,差异具有统计学意义(P<0.001)(图4 C)。
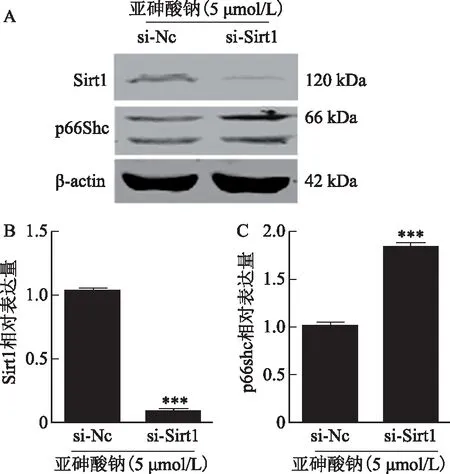
A:Western Blot检测在亚砷酸钠暴露的条件下,对照 siRNA和Sirt1 siRNA转染后细胞Sirt1和p66Shc的表达情况;B:对照 siRNA和Sirt1 siRNA组Sirt1的灰度分析柱状图;C:对照 siRNA和Sirt1 siRNA组p66Shc的灰度分析柱状图;si-NC:对照siRNA转染组;si-Sirt1:Sirt1 siRNA转染组;与si-NC组比较,***P<0.001图4 亚砷酸钠通过Sirt1调控p66Shc的表达
讨 论
诸多的报道已经证实亚砷酸钠具有胚胎毒性,如 Senuma等[16]报道显示亚砷酸钠影响胎鼠脑部5-羟色胺能神经元的早期发育。McCollum等[17]研究发现斑马鱼胚胎经亚砷酸钠处理后表现出严重的血管发育异常。一些研究认为亚砷酸钠通过扰乱氧化还原平衡,引起细胞组织氧化损伤,如Li等[18]报道显示亚砷酸钠处理人肝脏HHL-5细胞后,细胞内ROS水平、凋亡率呈剂量依赖式升高,细胞色素c和促凋亡蛋白Bax的表达升高。Gong等[19]报道亚砷酸钠暴露显著增加人上皮细胞ROS水平,降低细胞谷胱甘肽(GSH)水平,降低细胞色素c氧化酶活性和线粒体膜电位,导致线粒体功能障碍,进而激活一系列炎症相关信号通路,引发细胞损伤。Sirt1作为一种参与细胞内多种重要生理活动的组蛋白去乙酰化酶,近年来很多研究表明Sirt1与氧化损伤存在密切的联系。如,Gay等[20]报道显示Sirt1在过氧化氢诱导的神经元细胞氧化损伤模型中表达发生下调。Li等[21]研究发现咖啡酸苯乙酯能够通过激活Sirt1/内皮细胞性一氧化氮合酶(eNOS)通路,恢复Sirt1的表达,从而缓解缺氧/复氧引起的大鼠心肌细胞的氧化损伤。本研究发现亚砷酸钠处理引起Sirt1的表达显著降低,提示Sirt1对亚砷酸钠诱导的氧化损伤可能具有重要的作用。
报道显示p66Shc能够通过氧化细胞色素c介导线粒体ROS的产生[22]。我们课题组前期研究发现亚砷酸钠处理引起小鼠胚胎p66Shc表达上调和ROS水平升高,原核注射p66Shc siRNA能抑制砷引起的ROS升高和胚胎毒性[6-7]。另外,我们体外研究表明亚砷酸钠通过上调细胞p66Shc的表达,诱导细胞ROS水平升高,抑制细胞活力[8]。Zhou等[15]报道Sirt1在转录水平上抑制p66Shc的表达。本研究发现亚砷酸钠处理细胞后,p66Shc转录水平升高,而Sirt1的蛋白水平降低,进一步研究发现在亚砷酸钠暴露的细胞内,利用siRNA抑制Sirt1的表达显著上调p66Shc的表达。由此可见Sirt1对p66Shc的表达具有负调控作用,提示亚砷酸钠可能通过抑制Sirt1的表达而上调胚胎p66Shc的表达,但仍需进一步验证。
Trinei等[23]报道显示p53通过上调p66Shc的表达介导过氧化氢引起的细胞氧化损伤。高糖诱导下细胞p53和Sirt1均可以通过影响p66Shc的表达而调控细胞ROS水平[24]。此外,有报道显示Sirt1的转录能够被p53调控,被激活的p53能够与Sirt1启动子区域上两个p53相应元件结合,从而调控Sirt1的表达[25-26]。因此,亚砷酸钠引起的p66Shc表达变化的分子机制以及Sirt1和p66Shc在亚砷酸钠诱导的氧化应激机制中发挥的作用还有待进一步探究。
综上,本研究发现亚砷酸钠处理后p66Shc转录水平升高,Sirt1表达发生下调,而敲低Sirt1后p66Shc的表达明显升高,提示亚砷酸钠通过抑制Sirt1促进p66Shc的表达,提出了亚砷酸钠对胚胎p66Shc表达调控的一种可能机制。
【参 考 文 献】
[1] Valko M,Morris H,Cronin MT. Metals,toxicity and oxidative stress[J].Curr Med Chem,2005,12:1161-1208.
[2] Song G,Cui Y,Han ZJ,et al. Effects of choline on sodium arsenite-induced neural tube defects in chick embryos[J].Food Chem Toxicol,2012,50:4364-4374.
[3] 林元,庄凌梓,马宏,等. 孕前/孕期砷暴露致胎鼠先天性心脏异常的研究[J].卫生研究,2016,45:93-97.
[4] Lee TC,Ho IC. Modulation of cellular antioxidant defense activities by sodium arsenite in human fibroblasts[J].Arch Toxicol,1995,69:498-504.
[5] Cosentino F,Francia P,Camici GG,et al. Final common molecular pathways of aging and cardiovascular disease:role of the p66Shc protein[J].Arterioscler Thromb Vasc Biol,2008,28:622-628.
[6] Zhang C,Liu C,Li D,et al. Intracellular redox imbalance and extracellular amino acid metabolic abnormality contribute to arsenic-induced developmental retardation in mouse preimplan-tation embryos[J].J Cell Physiol,2010,222:444-455.
[7] Ren K,Li X,Yan J,et al. Knockdown of p66Shc by siRNA injection rescues arsenite-induced developmental retardation in mouse preimplantation embryos[J].Reprod Toxicol,2014,43:8-18.
[8] Ma Y,Zhang C,Gao XB,et al. Folic acid protects against arsenic-mediated embryo toxicity by up-regulating the expression of Dvr1[J].Sci Rep,2015,5:16093.
[9] Li D,Lu C,Wang J,et al. Developmental mechanisms of arsenite toxicity in zebrafish(Danio rerio)embryos[J].Aquat Toxicol,2009,91:229-237.
[10] 朱海英,高小博,骆海燕,等. p66Shc对亚砷酸钠诱导心肌细胞氧化应激的影响[J].生殖医学杂志,2017,26:578-584.
[11] Arul Nambi Rajan K,Khater M,Soncin F,et al. Sirtuin1 is required for proper trophoblast differentiation and placental development in mice[J].Placenta,2018,62:1-8.
[12] Tang S,Fang Y,Huang G,et al. Methionine metabolism is essential for SIRT1-regulated mouse embryonic stem cell maintenance and embryonic development[J].EMBO J,2017,36:3175-3193.
[13] Shin AN,Han L,Dasgupta C,et al. SIRT1 increases cardiomyocyte binucleation in the heart development[J].Oncotarget,2018,9:7996-8010.
[14] Kumar S,Kim YR,Vikram A,et al. Sirtuin1-regulated lysine acetylation of p66Shc governs diabetes-induced vascular oxidative stress and endothelial dysfunction[J].Proc Natl Acad Sci U S A,2017,114:1714-1719.
[15] Zhou S,Chen HZ,Wan YZ,et al. Repression of P66Shc expression by SIRT1 contributes to the prevention of hyperglycemia-induced endothelial dysfunction[J].Circ Res,2011,109:639-648.
[16] Senuma M,Mori C,Ogawa T,et al. Prenatal sodium arsenite affects early development of serotonergic neurons in the fetal rat brain[J].Int J Dev Neurosci,2014,38:204-212.
[17] McCollum CW,Hans C,Shah S,et al. Embryonic exposure to sodium arsenite perturbs vascular development in zebrafish[J].Aquat Toxicol,2014,152:152-163.
[18] Li Y,Zhang Y,Gao Y,et al. Arsenic induces thioredoxin 1 and apoptosis in human liver HHL-5 cells[J].Biol Trace Elem Res,2018,181:234-241.
[19] Gong X,Ivanov VN,Davidson MM,et al. Tetramethylpyrazine(TMP)protects against sodium arsenite-induced nephrotoxicity by suppressing ROS production,mitochondrial dysfunction,pro-inflammatory signaling pathways and programed cell death[J].Arch Toxicol,2015,89:1057-1070.
[20] Gay NH,Phopin K,Suwanjang W,et al. Neuroprotective effects of phenolic and carboxylic acids on oxidative stress-induced toxicity in human neuroblastoma SH-SY5Y cells[J].Neurochem Res,2018,43:619-636.
[21] Li D,Wang X,Huang Q,et al. Cardioprotection of CAPE-oNO2 against myocardial ischemia/reperfusion induced ROS generation via regulating the SIRT1/eNOS/NF-kappaB pathway in vivo and in vitro[J].Redox Biol,2018,15:62-73.
[22] Giorgio M,Migliaccio E,Orsini F,et al. Electron transfer between cytochrome c and p66Shc generates reactive oxygen species that trigger mitochondrial apoptosis[J].Cell,2005,122:221-233.
[23] Trinei M,Giorgio M,Cicalese A,et al. A p53-p66Shc signalling pathway controls intracellular redox status,levels of oxidation-damaged DNA and oxidative stress-induced apoptosis[J].Oncogene,2002,21:3872-3878.
[24] Wils J,Favre J,Bellien J. Modulating putative endothelial progenitor cells for the treatment of endothelial dysfunction and cardiovascular complications in diabetes[J].Pharmacol Ther,2017,170:98-115.
[25] Hwang JW,Yao H,Caito S,et al. Redox regulation of SIRT1 in inflammation and cellular senescence[J].Free Radic Biol Med,2013,61:95-110.
[26] Luo J,Li M,Tang Y,et al. Acetylation of p53 augments its site-specific DNA binding both in vitro and in vivo[J].Proc Natl Acad Sci U S A,2004,101:2259-2264.
