早补救ICSI在部分受精失败患者中的临床应用
2018-06-14蒋益群王珊珊徐志鹏张宁媛
蒋益群,王珊珊,徐志鹏,张宁媛
(南京大学医学院附属鼓楼医院生殖医学中心,南京 210008)
我国生育年龄的夫妇发生不孕不育的比例越来越高,常规IVF是治疗不孕不育的有效手段。IVF受精率低甚至受精完全失败的情况不可避免,不仅会影响妊娠结局,也会给不孕患者带来经济及身心负担。最早,晚补救ICSI(R-ICSI)被应用于第1天的未受精卵母细胞。然而,考虑到较低的胚胎发育潜能和临床妊娠率,晚R-ICSI逐渐被淘汰[1-2]。2003年Chen和 Kattera[3]首次将早R-ICSI用于临床,在IVF 6 h后观察有无排出第二极体,判断受精状况,并对无第二极体的卵母细胞行早R-ICSI,可有效避免完全受精失败。张宁媛等[4-5]通过短时受精联合早R-ICSI显著改善了常规IVF周期中完全受精失败患者的临床结局。Chen等[6]和Huang等[7]进一步论证了早R-ICSI用于完全受精失败患者其围产期结局安全有效。
然而,临床上也会出现部分受精失败的病例。对于部分受精失败患者,如果卵母细胞未受精比例较少且有可移植胚胎,是可以接受的。但如果卵母细胞未受精比例较高,会导致胚胎利用率降低,甚至造成患者取消移植周期。因此,本研究回顾性分析部分受精失败的病例行早R-ICSI后的胚胎发育潜能以及临床妊娠结局。
资料与方法
一、研究对象
对2013~2015年在本院生殖医学中心行常规IVF,部分受精失败行早R-ICSI的320例患者(320个周期)的临床资料进行回顾性分析。根据短时受精后双极体(2PB)率分为3组:A组2PB率<25%(n=113);B组25%≤2PB率<50%(n=151);C组2PB率≥50%(n=56)。比较3组R-ICSI来源卵母细胞的受精率、卵裂率、优质胚胎率以及临床妊娠率。
二、控制性促排卵方案
采用促性腺激素释放激素激动剂(GnRH-a,曲普瑞林,Ferring,德国)降调节后,注射基因重组促卵泡激素(Gonal-F,果纳芬,雪兰诺,瑞士),当发现至少1个卵泡直径>18 mm时,注射HCG(Serono,瑞士),并于35~36 h后经阴道B超引导下穿刺取卵。
三、精液处理
手淫法收集精液,液化后用精子梯度离心液400g离心20 min,将沉淀置于3 ml精子洗涤液(Vitrolife,瑞典)中,200g离心10 min弃去上清,加受精培养液(Vitrolife,瑞典)0.5 ml上游。0.5 h后,调节精子浓度至 1×106/ml等待受精。
四、短时受精及早R-ICSI
卵泡穿刺获得卵冠丘复合物,置于受精培养液(Vitrolife,瑞典)中培养3 h,按10 000精子/卵母细胞的比例加精,精卵共孵育4~5 h后脱颗粒细胞。根据是否存在第二极体判断受精情况,若2PB数相对成熟卵母细胞数的比例<60%,在6 h后对未受精卵母细胞行早R-ICSI。然后转移至卵裂培养液(Vitrolife,瑞典)。16~18 h后观察原核(PN)形成情况。受精后第2天(D2)及D3评估分裂胚质量。然后转移至囊胚培养液(Vitrolife,瑞典)中,受精后D5和D6在倒置显微镜下评估囊胚质量。
五、胚胎评估
根据我中心常规评分方法进行分裂胚及囊胚的评估[8],挑选优质胚胎移植或冷冻保存。
六、胚胎移植与妊娠结局判断
取卵后D3挑选两枚优质分裂胚,于B超引导下进行宫腔内胚胎移植,予以常规黄体支持。移植后剩余的优质胚胎冷冻保存或继续培养至D5/D6形成囊胚后冷冻保存。胚胎移植后14 d检测血清HCG指标,阳性结果确定为生化妊娠。移植后28 d行B超检查,见宫腔内有妊娠囊者确诊为临床妊娠。
七、统计学处理
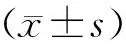
结 果
一、患者的一般资料比较
A、B、C 3组患者的女方年龄、不育年限、体重指数(BMI)、促性腺激素(Gn)用量、Gn天数、获卵数、成熟卵母细胞数比较均无显著性差异(P0.05)(表1)。
二、不同2PB率对受精及胚胎发育潜能的影响
A、B、C 3组患者的早R-ICSI正常受精率[即观察到双原核(2PN)率]比较无显著性差异(P0.05),A组的异常受精率(即≥3PN率)显著低于B、C两组(P<0.05),C组的2PN卵裂率和优质胚胎率显著低于A、B两组(P<0.05),3组囊胚形成率及优质囊胚率比较无显著性差异(P0.05)。A、B、C 3组中早R-ICSI来源胚胎用于移植的比例两两比较有显著性差异(P<0.05),且早R-ICSI来源胚胎中优质胚胎的比例两两比较亦有显著性差异(P<0.05)(表2)。
三、3组患者移植胚胎来源及妊娠结局的比较
3组中因存在卵巢过度刺激综合征(OHSS)发生风险及无可用胚胎放弃移植的例数见表3。A、B、C 3组患者的临床妊娠率、种植率、流产率及异位妊娠率比较均无显著性差异(P0.05),A、B、C 3组患者移植两枚早R-ICSI来源胚胎的周期比例两两比较有显著性差异(P<0.05),移植两枚IVF来源胚胎的周期比例两两比较亦有显著性差异(P<0.05);IVF和早R-ICSI各移植1枚的周期比例C组显著低于A、B组(P<0.05)(表3)。

表1 各组患者一般临床资料比较(-±s)
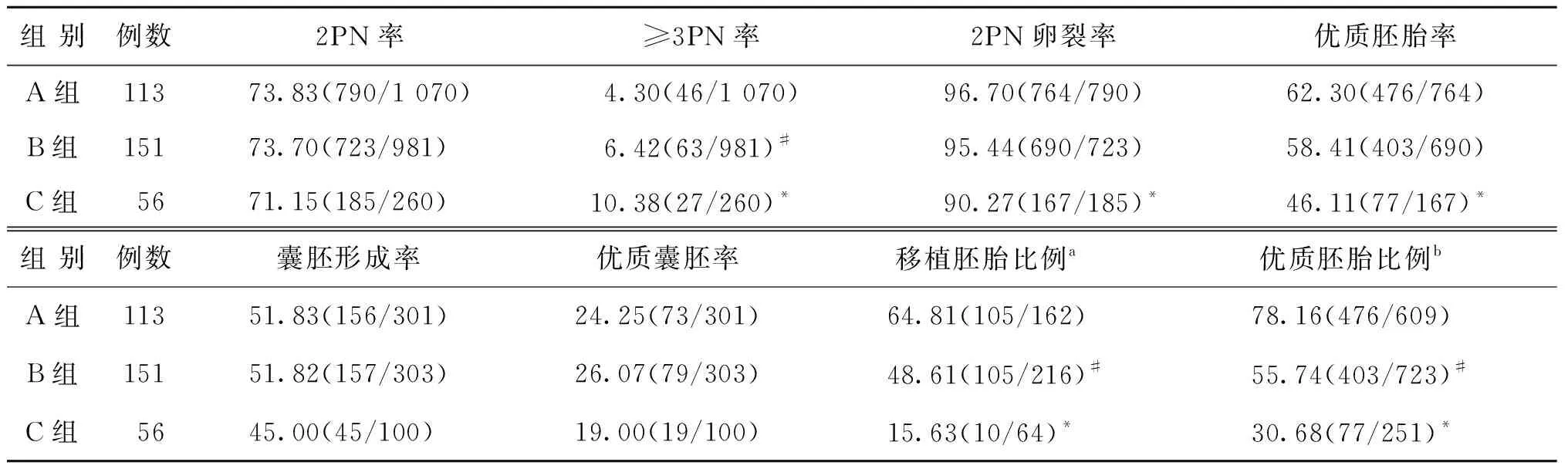
表2 各组患者行早R-ICSI卵母细胞的受精及胚胎发育情况比较(%)
注:与A、B两组比较,*P<0.05;与A组比较,#P<0.05。a早R-ICSI移植胚胎比例=早R-ICSI移植胚胎数/(早R-ICSI移植胚胎数+IVF移植胚胎数);b早R-ICSI优质胚胎比例=早R-ICSI优质胚胎数/(早R-ICSI优质胚胎数+IVF优质胚胎数)
表3 各组患者移植胚胎来源及临床妊娠结局比较(n,%)
注:与A、B两组比较,*P<0.05;与A组比较,#P<0.05
讨 论
受精过程包括精子和卵母细胞接触与识别、精子穿入的调节、受精卵激活、卵母细胞对精子处理、原核形成过程[9]。受精失败的主要原因是精子与透明带结合失败或精子未成功穿入透明带,另一个原因是精子穿入透明带后受精终止,若卵母细胞完成受精,在其内精子的穿入过程和正确的信号级联反应尤为重要[10-12]。对于部分受精失败者,精子功能的缺陷仍然是受精失败的主要原因[13-14],卵母细胞质量的缺陷对受精的影响可能更明显[15]。刘兰兰等[16]的研究显示:R-ICSI与常规IVF相比,原发性不育因素比例较高,不育年限较长,提示R-ICSI患者自身的卵母细胞或精子质量可能存在缺陷,影响受精。刘琨等[17]的研究表明高Gn用量可能导致胞质发育不成熟或核质发育不同步,损伤卵母细胞内部结构,影响受精状况。如果受精失败是在精子与透明带结合时造成的,则R-ICSI可能起作用;如果精子能够成功地穿透卵母细胞,但在随后的卵母细胞激活和原核形成过程中遇到困难,则R-ICSI将是无效的[18]。
本研究结果显示,B、C组的异常受精率显著高于A组,可能是由于在部分受精失败的病例中,碎片化的极体或者假双极体都会增加判断受精的难度;C组卵裂率和优质胚胎率均显著低于A、B两组,也提示随着2PB率的增加,3组未受精卵母细胞的胞质成熟状况将逐渐变差,其染色体异常风险可能有所提高。Cao等[19]认为对于IVF受精率超过25%的患者,不推荐使用ICSI,因为可能与多倍体风险及胚胎利用率低有关。本研究结果中:B组早R-ICSI来源的胚胎提供了48.61%的移植胚胎,55.74%的优质胚胎。在B组108个移植周期中,有25个周期(23.15%)移植两枚早R-ICSI胚胎,有55个周期(50.93%)移植1枚早R-ICSI胚胎;而C组中早R-ICSI来源的胚胎比例较低,认为早R-ICSI对C组的妊娠结局贡献较小。因此,认为当短时受精后2PB率<50%时,早R-ICSI可以获得较理想的优质胚胎率及妊娠结局。C组患者早R-ICSI胚胎的异常受精率显著增高,卵裂率和优质胚胎率显著降低,可能与未受精卵母细胞的染色体异常,促排卵过程使卵母细胞发生纺锤体异常,第一、二极体的排出障碍,卵母细胞不成熟或成熟阻滞有关[20],也有研究认为受精失败的发生与卵母细胞过度成熟有关[21]。
张微等[22]的研究显示:只有一个极体出现的卵母细胞,6 h受精卵皮质反应出现率为66.67%,其受精率也达到37.50%。同时,当IVF受精率越高,早R-ICSI的异常受精率也越高,极体发生碎裂或出现假的双极体时,可结合胞浆的皮质反应情况、卵周间隙的改变等综合判断卵母细胞受精情况,如果极体延迟排出,只能延长观察时间。这将增加额外的工作量,同时反复的体外观察,也会对胚胎质量有一定影响。Nagy等[23]的研究结果表明,在卵母细胞失去发育潜能之前进行R-ICSI更有效。Liu等[24]的研究也表明,R-ICSI时机越早,其临床结局越好。因此,提高IVF术后短时间识别未受精卵母细胞的准确度,尤其重要。
偏振光显微成像技术能够提高早R-ICSI结果,该技术能辨别显示单极纺锤体(MⅡ)和双极纺锤体的卵母细胞(可能表现为精子穿入)。对只显示1个纺锤体的未受精卵母细胞进行注射,其正常受精率更高,从而提高整体治疗效果[25]。Guo等[26]的研究表明,在受精后的5 h内,偏振光显微成像技术与早R-ICSI相结合,可以有效地减少多倍体发生,同时减少体外观察时间。因此,偏振光显微成像技术可能对获卵较少的病例或者2PB比例大于50%的病例中受精判断困难的情况有一定的帮助。
本研究中部分受精失败的样本量较少,且混合移植的存在造成难以对妊娠及围产期结局进行分析,因此本文着重于对IVF来源和早R-ICSI来源胚胎的使用进行比较。在以后的工作中,将大样本调查单胚胎移植中早R-ICSI患者的围产期结局,以进行安全性评估。
【参 考 文 献】
[1] Yuzpe AA,Liu Z,Fluker MR. Rescue intracytoplasmic sperm injection(ICSI)-salvaging in vitro fertilization(IVF)cycles after total or near-total fertilization failure[J].Fertil Steril,2000,73:1115-1119.
[2] Morton PC,Yoder CS,Tucker MJ,et al. Reinsemination by intracytoplasmic sperm injection of 1-day-old oocytes after complete conventional fertilization failure[J].Fertil Steril,1997,68:488-491.
[3] Chen C,Kattera S. Rescue ICSI of oocytes that failed to extrude the second polar body 6h post-insemination in conventional IVF[J].Hum Reprod,2003,18:2118-2121.
[4] 张宁媛,孙海翔,胡娅莉,等.完全受精失败周期应用早期补救性卵细胞胞质内单精子注射术的安全性评估[J].中华男科学杂志,2010,16:158-160.
[5] 张宁媛,孙海翔,胡娅莉,等.短时受精联合早期补救性卵细胞胞质内单精子注射在完全受精失败周期的临床应用[J].中华男科学杂志,2009,15:538-541.
[6] Chen L,Xu Z,Zhang N,et al. Neonatal outcome of early rescue ICSI and ICSI with ejaculated sperm[J].J Assist Reprod Genet,2014,31:823-828.
[7] Huang B,Qian K,Li Z,et al. Neonatal outcomes after early rescue intracytoplasmic sperm injection:an analysis of a 5-year period[J].Fertil Steril,2015,103:1432-1437.
[8] 蒋益群,王珊珊,徐志鹏,等.商品化培养液对人类胚胎发育及妊娠结局的影响[J].中国医药导报,2016,13:72-75.
[9] Beck-Fruchter R,Lavee M,Weiss A,et al. Rescue intracytoplasmic sperm injection:a systematic review[J].Fertil Steril,2014,101:690-698.
[10] Rawe VY,Olmedo SB,Nodar FN,et al. Cytoskeletal organization defects and abortive activation in human oocytes after IVF and ICSI failure[J].Mol Hum Reprod,2000,6:510-516.
[11] Mahutte NG,Arici A. Failed fertilization:is it predictable?[J].Curr Opin Obstet Gynecol,2003,15:211-218.
[12] Tosti E,Menezo Y. Gamete activation:basic knowledge and clinical applications[J].Hum Reprod Update,2016,22:420-439.
[13] Li LJ,Zhang FB,Liu SY,et al. Human sperm devoid of germinal angiotensin-converting enzyme is responsible for total fertilization failure and lower fertilization rates by conventional in vitro fertilization[J].Biol Reprod,2014,90:125.
[14] Goudakou M,Kalogeraki A,Matalliotakis I,et al. Cryptic sperm defects may be the cause for total fertilization failure in oocyte donor cycles[J/OL]. Reprod Biomed Online,2012,24:148-152.
[15] Coticchio G,Dal Canto M,Mignini Renzini M,et al. Oocyte maturation:gamete-somatic cells interactions,meiotic resumption,cytoskeletal dynamics and cytoplasmic reorganization[J].Hum Reprod Update,2015,21:427-454.
[16] 刘兰兰,蔡嘉力,任建枝.早期补救ICSI对首次IVF助孕周期临床结局的影响[J].生殖医学杂志,2016,25:118-122.
[17] 刘琨,胡俊平,马晓玲,等.体外授精中卵母细胞受精失败因素分析及早期补救ICSI的应用探讨[J].生殖医学杂志,2016,25:619-622.
[18] Yeste M,Jones C,Amdani SN,et al. Oocyte activation deficiency:a role for an oocyte contribution?[J].Hum Reprod Update,2016,22:23-47.
[19] Cao S,Wu X,Zhao C,et al. Determining the need for rescue intracytoplasmic sperm injection in partial fertilisation failure during a conventional IVF cycle[J].Andrologia,2016,48:1138-1144.
[20] 赵芳,吕玉珍,王娟,等.常规IVF完全/部分受精失败后行早期补救ICSI的应用价值[J].生殖医学杂志,2015,24:87-92.
[21] 黄玉玲,龙晓林,刘见桥,等.体外受精-胚胎移植中完全受精失败的原因分析[J].生殖与避孕,2011,31:455-458.
[22] 张微,宋成,成金泉,等.卵子受精早期现象的初步探讨[J].生殖医学杂志,2009,18:197-202.
[23] Nagy ZP,Rienzi LF,Ubaldi FM,et al. Effect of reduced oocyte aging on the outcome of rescue intracytoplasmic sperm injection[J].Fertil Steril,2006,85:901-906.
[24] Liu W,Liu J,Zhang X,et al. Short co-incubation of gametes combined with early rescue ICSI:an optimal strategy for complete fertilization failure after IVF[J].Hum Fertil(Camb),2014,17:50-55.
[25] Asa E,Tabatabaee R,Farrokhi A,et al. Relationship between meiotic spindles visualization and intracytoplasmic sperm injection outcomes in human oocytes[J].Anat Cell Biol,2017,50:26-32.
[26] Guo Y,Liu W,Wang Y,et al. Polarization microscopy imaging for the identification of unfertilized oocytes after short-term insemination[J].Fertil Steril,2017,108:78-83.
