山葡萄酒主发酵降酸工艺筛选及优化
2018-06-14丁玉萍高鹏飞陈琦韩诚武李春丰刘德江
丁玉萍,高鹏飞,陈琦,韩诚武,李春丰,刘德江
(佳木斯大学 生命科学学院,应用微生物研究所,黑龙江 佳木斯,154007)
山葡萄与欧亚种酿酒葡萄差异较大,产于我国东北地区[1],寒冷的地域特性造成山葡萄3大特点:一是糖度低,一般为130~150 g/L;二是酸度高,成熟果实的可滴定酸度含量在15~25 g/L(以酒石酸计)之间[2-3],是酿酒葡萄酸度规定值的3~5倍,果汁pH值在2.90~2.95之间,尤其苹果酸含量高[4];三是营养成分高,其多酚、单宁、花青素、白藜芦醇等物质含量均高于普通酿酒葡萄,这也是东北人喜欢用来酿酒的主要原因[5]。由于山葡萄苹果酸含量较高,酿制的酒酸涩,降低酸度是生产干型山葡萄酒面临的主要工艺难题。
目前,葡萄酒的降酸方法主要有3种:物理降酸、化学降酸和生物降酸[6-8],其中应用较多的是生物降酸,即苹果酸-乳酸发酵(malolactic fermentation, MLF)[9-10]。MLF是在主发酵结束后进行的二次发酵[11],由于苹果酸-乳酸发酵菌受到高酸度以及酒精的抑制作用,山葡萄酒苹果酸-乳酸发酵难以启动[12-13],所以本研究尝试将苹果酸-乳酸发酵菌应用主发酵过程中,使酒精发酵与苹果酸-乳酸发酵同时进行,旨在为降低山葡萄酒的酸度探究最佳工艺组合。
1 材料与方法
1.1 材料
1.1.1 山葡萄酒及菌株
山葡萄:佳木斯地区野生山葡萄(山葡萄汁pH 2.93±0.05,总酸度13.60±0.50,含糖量约为10.50±0.50)。
葡萄酒酵母(Y1):安琪酵母股份有限公司;降酸酵母(Y2):烟台帝伯仕商贸有限公司;乳酸菌(Lactoenos 450 PreAC[L]):烟台帝伯仕自酿机有限公司。
1.1.2 仪器与试剂
仪器:YXQ-LS-75SII高压蒸汽灭菌锅:上海博讯事业有限公司医疗设备厂;150G恒温振荡培养箱:江苏省金坛市荣华仪器制造有限公司;TDZ4-WS低速台式离心机:长沙湘仪离心机仪器有限公司;CJ-78-1A磁力加热搅拌器:上海跃进医疗器械厂; PHS-3C型精密酸度计:杭州雷磁分析仪器公司。
试剂:酵母膏、牛肉膏、胰蛋白胨、葡萄糖、硫酸镁、苹果酸钠、柠檬酸三铵、碳酸钾(食品级)、吐温-80、苹果酸、乳酸、正丁醇、冰乙酸、溴酚蓝等,试剂均为分析纯。
1.1.3 培养基
酵母培养基: 葡萄糖20 g/L,酵母浸液5 g/L,KH2PO42 g/L,MgSO41 g/L,CaCL20.3 g/L,溶于1 000 mL蒸馏水,于121 ℃灭菌20 min。
MRS培养基:葡萄糖10 g,牛肉蛋白胨10 g,酵母浸粉5 g,吐温-80 1 mL,柠檬酸氢二铵2 g,乙酸钠5 g,KH2PO42 g,MgSO40.58 g,MnSO40.25 g,121 ℃灭菌20 min。
1.1.4 纸层析液
展开剂:正丁醇∶冰乙酸∶蒸馏水为2∶1∶1。显色剂:1 L展开剂中加入0.6 g溴酚蓝。将试剂混合均匀后,倒入试剂瓶中,密封储存备用[14-15]。
1.2 方法
1.2.1 干红山葡萄酒酿制
工艺流程:
山葡萄→清洗挑选→破碎→加糖→接种→主发酵→过滤
技术要点:
山葡萄预处理:山葡萄清洗后,进行除梗分离,破碎,分装在发酵瓶中。按葡萄重量10%的量加入蔗糖。
菌种活化:将保存的酵母菌、乳酸菌菌种分别接入酵母培养基和MRS培养基中,于25 ℃活化培养48 h后备用。
接种:按所需接种量取活化液体菌种,于2 800 r/min离心10 min,弃去上清液,将离心得到的沉淀用葡萄汁洗入发酵瓶中。
发酵:放置设定温度的培养箱里发酵,每天测量失重,至恒重即主发酵结束。
过滤:用100目过滤袋进行自然过滤,得干红山葡萄酒,于4 ℃恒温储藏备用。
1.2.2 山葡萄酒主发酵降酸最佳用菌组合筛选
将葡萄酒酵母(Y1)、降酸酵母(Y2)、乳酸菌(L)按表1进行组合,接入山葡萄汁中进行发酵,通过比较发酵后山葡萄酒的pH值,筛选出最佳用菌组合。

表1 山葡萄酒最佳菌种组合的筛选方案Table 1 V.amurensis wines of the best strains combinedscreening programme
1.2.3 单因素试验
1.2.3.1 温度对山葡萄酒主发酵降酸的影响
将破碎分装后的山葡萄按酵母菌和乳酸菌为6%和4%的量接入两种菌种,分别置于室温(20~22 ℃)、25、27、30℃四组温度下进行发酵,探究温度对山葡萄酒主发酵降酸的影响。
1.2.3.2 降酸酵母与乳酸菌比例对山葡萄酒主发酵降酸的影响
将降酸酵母菌(Y2)和乳酸菌(L)分别以5%+5%、6%+4%、4%+6%和3%+7%的接种量接入葡萄酒中,于25 ℃下进行发酵,探究降酸酵母菌与乳酸菌比例对山葡萄酒主发酵降酸的影响。
1.2.4 正交试验
1.2.4.1 正交试验
在单因素试验的基础上,对山葡萄酒主发酵温度、混合菌(Y2∶L=1∶1)用量、发酵时间进行三因素三水平正交试验L9(33)。正交试验设计如表2所示。每组试验做3个重复,结果取平均值。
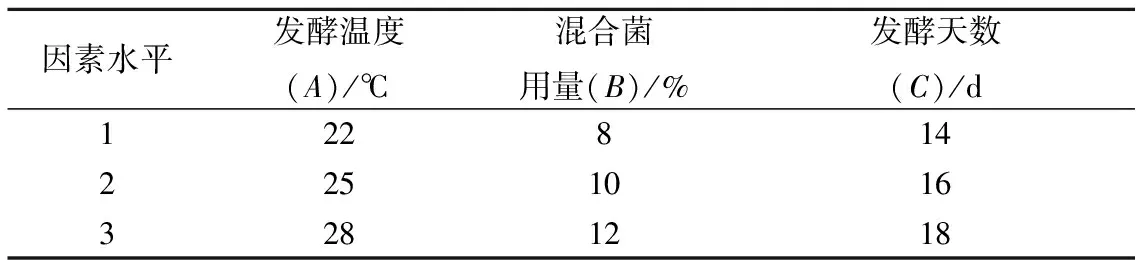
表2 正交试验设计表Table 2 Orthogonal test designs table
1.2.5 检测方法
pH值的检测采用精密酸度计测定;总糖的检测采用3,5-二硝基水杨酸法测定;苹果酸乳酸转化量的检测采用纸层析法测定。
2 结果与分析
2.1 山葡萄酒主发酵降酸最佳用菌组合筛选结果
测量接入不同菌种的山葡萄主发酵12~16 d酒液的pH值,结果如图1所示。

图1 不同菌种发酵山葡萄酒pH值的变化Fig.1 Different strains fermentation of V.amurensis wine pH value changes
从图1可看出,接入不同菌种4个试验组的pH值都有升高,随着发酵时间的延长,pH值会略有下降。只添加葡萄酒酵母的山葡萄酒pH值的平均值为2.93,在为4组中最低;在发酵第13天时pH值达到最高值2.95,与发酵前的pH值相比增加了0.08。只添加降酸酵母的山葡萄酒pH值的平均值为3.06,发酵第12天和第13天均为最大值3.07,与发酵前的pH值相比增加了0.20。同时添加葡萄酒酵母和降酸酵母的山葡萄酒pH值的平均值为3.07,在发酵第13天时达到最大值3.09,与发酵前的pH值相比增加了 0.22。同时添加降酸酵母和乳酸菌的山葡萄酒pH值的平均值为3.12,为4组中最高;在发酵第13天时pH值达到最高值3.14,与发酵前的pH值相比增加了0.27,是4组中pH值升高最多高的一组。
比较各组最大pH升高值,(Y1+L)组(0.27)>(Y1+Y2)组(0.22)>Y2组(0.20)>Y1组(0.08),即添加降酸酵母和乳酸菌组合降酸效果最好,其次为添加葡萄酒酵母和降酸酵母组合、添加单一降酸酵母组,添加单一葡萄酒酵母组降酸效果最差。
测量接入不同菌种的山葡萄主发酵12 d酒液的总糖,结果如表 3所示。

表3 不同菌种发酵的山葡萄酒总糖含量Table 3 Total sugar content of different strainsfermentation of V.amurensis wine
总糖含量小于 4 g/L为干红葡萄酒,从表3可看出,4种不同菌种发酵的山葡萄酒总糖含量均小于4 g/L,说明发酵12 d,发酵基本结束,为干红葡萄酒。
2.2 单因素试验
2.2.1 温度对山葡萄酒主发酵降酸的影响
测量山葡萄在不同温度下发酵13~17 d的pH值,结果如图2所示。

图2 温度对山葡萄酒主发酵降酸的影响Fig.2 Effect of temperature on V.amurensis wine main fermentation and deacidificatio
从图2可看出,不同温度下发酵的山葡萄酒的pH值都有升高,随着发酵时间的延长,pH值会略有下降。室温(20~22 ℃)下发酵的山葡萄酒平均pH值为 3.158,为4组中最低,在发酵第14 d时pH值达到最高值3.18,最大值与发酵前的pH值相比增加了0.23, pH升高值为4组中最小; 25 ℃下发酵的山葡萄酒平均pH值为3.202,为4组中最高,在发酵第14天时pH值达到最高值3.22,最大值与发酵前的pH值相比增加了0.27,pH升高值为4组中最大; 27 ℃下发酵的山葡萄酒平均pH值为3.184,发酵第14天时pH值达到最大值3.20,最大值与发酵前的pH值相比增加了0.25;30 ℃下发酵的山葡萄酒平均pH值为3.180,在发酵第14天时达到最大值3.20,最大值与发酵前的pH值相比也增加了0.25。
比较各组最大pH升高值为25 ℃(0.27)>27 ℃(0.25)=30 ℃(0.25)>室温(0.23)。即降酸效果最好的发酵温度,25 ℃,其次为27 ℃、30 ℃,降酸效果最差的为室温(20~22 ℃)。由此可见,主发酵温度为25 ℃时有利于山葡萄酒的降酸。
2.2.2 降酸酵母与乳酸菌比例对山葡萄酒主发酵降酸的影响
测接种不同比例的降酸酵母与乳酸菌的山葡萄发酵13~17 d的pH值,结果如图3所示。
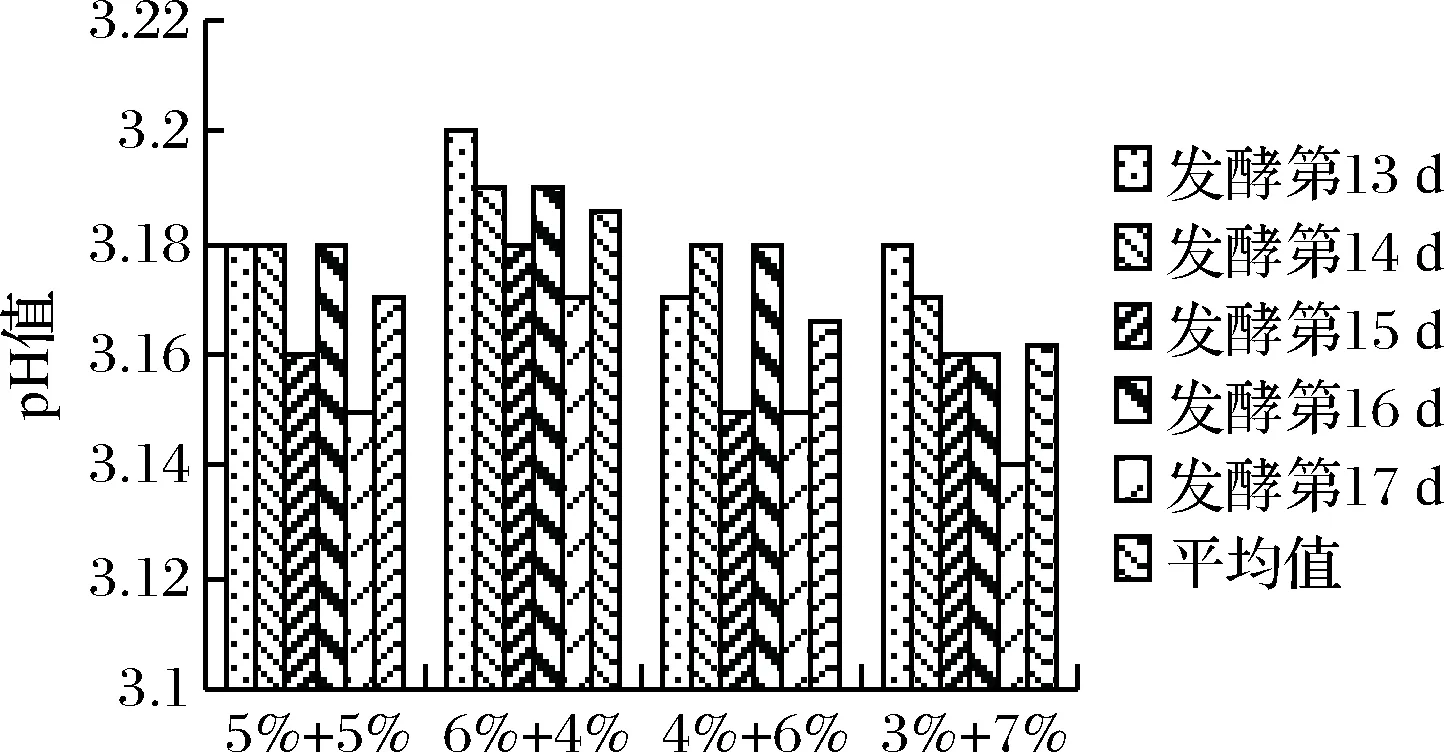
图3 酵母菌与乳酸菌比例对山葡萄酒主发酵降酸的影响Fig.3 The proportion of lactic acid bacteria and yeast effects on main fermentation of V.amurensis wine and deacidification
从图3可看出,4组设置不同酵母菌与乳酸菌比例的山葡萄酒的 pH 值整体都有升高,随着发酵时间的延长,pH 值会略有下降。
接种酵母菌和乳酸为(6%+4%)的山葡萄酒平均pH值是3.186,为4组中最高,在发酵第13天时pH值达到最高值3.20,最大值与发酵前的pH值相比增加了0.25,为4组中最大;接种酵母菌和乳酸为(5%+5%)的山葡萄酒平均pH值为3.170,在发酵第13、14、15天时pH 值均为检测5 d中的最高值3.18,最大值与发酵前的pH值相比增加了0.23;接种酵母菌和乳酸为(4%+6%)的山葡萄酒平均pH值为3.166,发酵第14、16天时pH值均为检测5 d中的最大值3.18,最大值与发酵前的pH值相比增加了0.23;接种酵母菌和乳酸为(3%+7%)的山葡萄酒平均pH值为3.162,在发酵第13天时达到最大值3.18,最大值与发酵前的pH值相比增加了0.23。
比较酵母菌与乳酸菌接种比例不同的各组平均pH值,(6%+4%)组(3.186)>(5%+5%)组(3.170)=(4%+6%)组( 3.166)=(3%+7%)组(3.162)。由此看出,降酸效果最好的组为酵母菌与乳酸菌为(6%+4%)的山葡萄酒,其次为(5%+5%)、(4%+6%),降酸效果最差的为(3%+7%)的山葡萄酒。所以,酵母菌与乳酸菌为(6%+4%)的配比组合更有利于山葡萄酒主发酵的降酸。
2.3 正交试验

表3 L9(33)正交试验结果与数据分析Table 3 L9(33)The results of orthogonal experimentand data analysis
通过对表3进行分析,比较极差R可得,RB>RA>RC,3个因素对山葡萄酒主发酵降酸的影响为:菌种接种量对山葡萄酒降酸影响最大,其次为发酵温度,发酵时间对试验结果影响最小;A因素列:K1>K2>K3,B因素列:K3>K1>K2,C因素列:K1>K2>K3,因此,正交试验结果的最优组合为A1B3C1,即发酵温度22 ℃,菌种接种量为12%,发酵时间13 d。
直接观察表3可知,6组(A2B3C1)的pH值3.19,是9个试验组中最高的。分别按6组(A2B3C1)和分析得到的最优组合Y组(A1B3C1)的条件发酵山葡萄酒,对2份酒样以及单一葡萄酒酵母发酵的山葡萄酒样(Y1J)进行纸层析对比试验,观察苹果酸、乳酸转化进程,结果如图4所示。
由图4可知,Y组和6组均有乳酸斑点出现,葡萄酒酵母发酵的山葡萄酒酒样(Y1J)无乳酸斑点出现,说明Y组和6组酒样已有苹果酸转化为乳酸,而葡萄酒酵母发酵的山葡萄酒酒样的没有苹果酸转化为乳酸,此酒样pH值为2.89,pH升高值很小,与纸层析结果相吻合。6组比Y组比较,6组苹果酸的斑点明显,说明6组的苹果酸转化比Y组的多,6组工艺为最优组合,即发酵温度25℃,菌种接种量为12%,发酵时间13d。
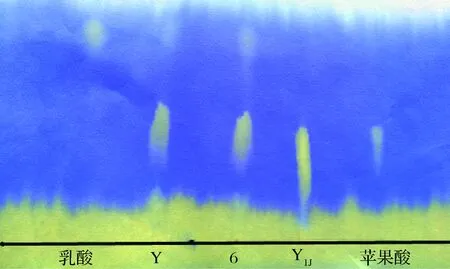
图4 验证试验酒样的苹果酸-乳酸转化进程Fig.4 Malolactic fermentation process on replication experiment wine samples
3 结论与讨论
通过对山葡萄酒主发酵降酸最佳用菌的筛选和主发酵降酸最佳工艺条件的优化试验可知,如果将降酸酵母菌和苹果酸-乳酸发酵菌同时接入山葡萄汁进行主发酵,在完成酒精发酵的同时,可以部分地将苹果酸转化为乳酸,降低山葡萄酒的酸度,而不影响酒的发酵速度和风味。山葡萄酒主发酵降酸最佳菌种组合为降酸酵母菌与乳酸菌组合,降酸酵母菌与乳酸菌最佳比例为3∶2,最佳总接种量为12%,最佳发酵温度为25 ℃,最佳发酵时间为13 d。在此条件下进行干红山葡萄酒发酵,可使葡萄酒pH值升高0.25~0.30,山葡萄原酒的酸涩味会有一定程度的减弱,适口性提高。
[1] 崔长伟, 刘丽媛,王华,等.山葡萄综合开发利用研究进展[J].食品科学, 2015, 13 (36) :276-282.
[2] 宋润刚,路文鹏,张庆田,等.酿造冰红山葡萄酒新品种北冰红的区域试验[J].中外葡萄与葡萄酒,2014(3):25-29.
[3] 高鹏飞,丁玉萍,刘东旭,等.工艺条件对寒地山葡萄酒生物降酸的影响探究[J].中国酿造,2016,35(12):90-93.
[4] 李瑞国,韩烨,周志江.葡萄酒苹果酸乳酸发酵研究进展[J].食品研究与开发,2010,31(8):228-233.
[5] LI N, DUAN J, GAO D, et al.Mutation and selection ofOenococcusoenifor controlling wine malolactic fermentation[J].European Food Research and Technology, 2014, 240(1): 93-100.
[6] RUIZ P, IZQUIERDO P, SESENA S, et al.Malolactic fermentation and secondary metabolite production byOenoccocusoenistrains in low pH wines.[J].Journal of Food Science, 2012, 77(10).
[7] 金刚.苹果酸-乳酸发酵细菌的多样性及其耐酒精分析[D].杨凌:西北农林科技大学,2015.
[8] 彭传涛,贾春雨,文彦, 等.苹果酸-乳酸发酵对干红葡萄酒感官质量的影响[J].中国食品学报,2014,2(14):261-268.
[9] 何翠婵.微生物降酸技术在青梅汁中的应用[D].广州:华南理工大学,2014.
[10] 游新勇,李琼,王国泽, 等.木瓜干酒苹果酸乳酸发酵降酸工艺技术研究[J].食品工业科技,2012,33(15):202-205.
[11] 李维新.优良MLF乳酸菌选育及其产酶特性研究与应用[D].福州:福建农林大学,2012.
[12] 金炳奎, 宗成文, 曹后男, 等.山葡萄SRAP技术体系的建立及其在品种鉴定中的应用[J].吉林农业大学学报, 2013, 35(2): 198-205.
[13] M BOUIX·S GHORBAL.Rapid assessment ofOenococcusoeniactivity by measuring intracellular pH and membrane potential by flow cytometry, and its application to the more effective control of malolactic fermentation[J].International Journal of Food Microbiology, 2015(193): 139-146.
[14] 邢玮,韩建春.沙棘果酒苹果酸-乳酸发酵影响因素研究[J].东北农业大学学报,2012,43(2):20-27.
[15] 李莹莹.酒酒球菌SD-2a活性干粉直投葡萄酒进行苹果酸-乳酸发酵的研究[D].西北农林科技大学,2015.
[16] IZQUIERDO P, GARCIA E, MARTINEZ J L, et al.Selection of lactic bacteria to induce malolactic fermentation in red wine of cv.Cencibel[J].Vitis, 2015, 43(3): 149-153.
