一种新型纽甜类似物甜味剂的合成及表征
2018-06-14李艳波马亚茹胡南邱云晏日安
李艳波,马亚茹,胡南,邱云,晏日安
(暨南大学 食品科学与工程系,广东 广州,510632)
纽甜(neotame,NTM),化学全称为N-[N-(3,3-二甲基丁基)-L-α-天冬氨胺]-L-苯丙氨酸1-甲酯,为阿斯巴甜的衍生物,但性能优于阿斯巴甜[1],其性状为白色粉末结晶,是一种低能量的新型二肽类强力甜味剂,其甜度约为蔗糖的8 000倍[2]、阿斯巴甜的40倍[2],甜味纯正,甜味特性与蔗糖相似,稳定性好、无龋齿性、安全性高[3],广泛应用于食品加工生产中[4-6]。
纽甜的类似物是为了适应未来超强甜味剂工业化发展而开发的新型产品,其分子结构与纽甜相似,也属于非营养型甜味剂。法国学者NOFRE等[7]研究了在阿斯巴甜的天冬氨酸的氨基中引入其他烷基,从而得到一系列的阿斯巴甜类似物;而日本味之素[8]的学者研究了多种在苯环上改变取代基的阿斯巴甜衍生物,从而得到大量甜度与纽甜相当或远远高于纽甜的纽甜类似物,如图1是已报道合成的纽甜及纽甜类似物结构式。
目前,市场上的甜味剂种类繁多,主要分为天然甜味剂和人造甜味剂,其中天然甜味剂有蔗糖、果糖、麦芽糖、乳糖等;人造甜味剂[9]有三氯蔗糖、阿斯巴甜、纽甜、ADVANTAME等。天然甜味剂来源于自然界,其甜度低且能量高,不适合糖尿病、高血压患者食用;而人工合成的甜味剂如ADVANTAME[3]具有天然甜味剂同样的甜味效果,甜度甚至比其高出成百上千倍,ADVANTAME的甜度约为蔗糖20 000倍[8],同时其能量低、稳定性好、安全性高[10-14],不仅适合糖尿病、高血压患者食用,同时降低了企业的生产成本,是未来甜味剂工业发展的新时代趋势。
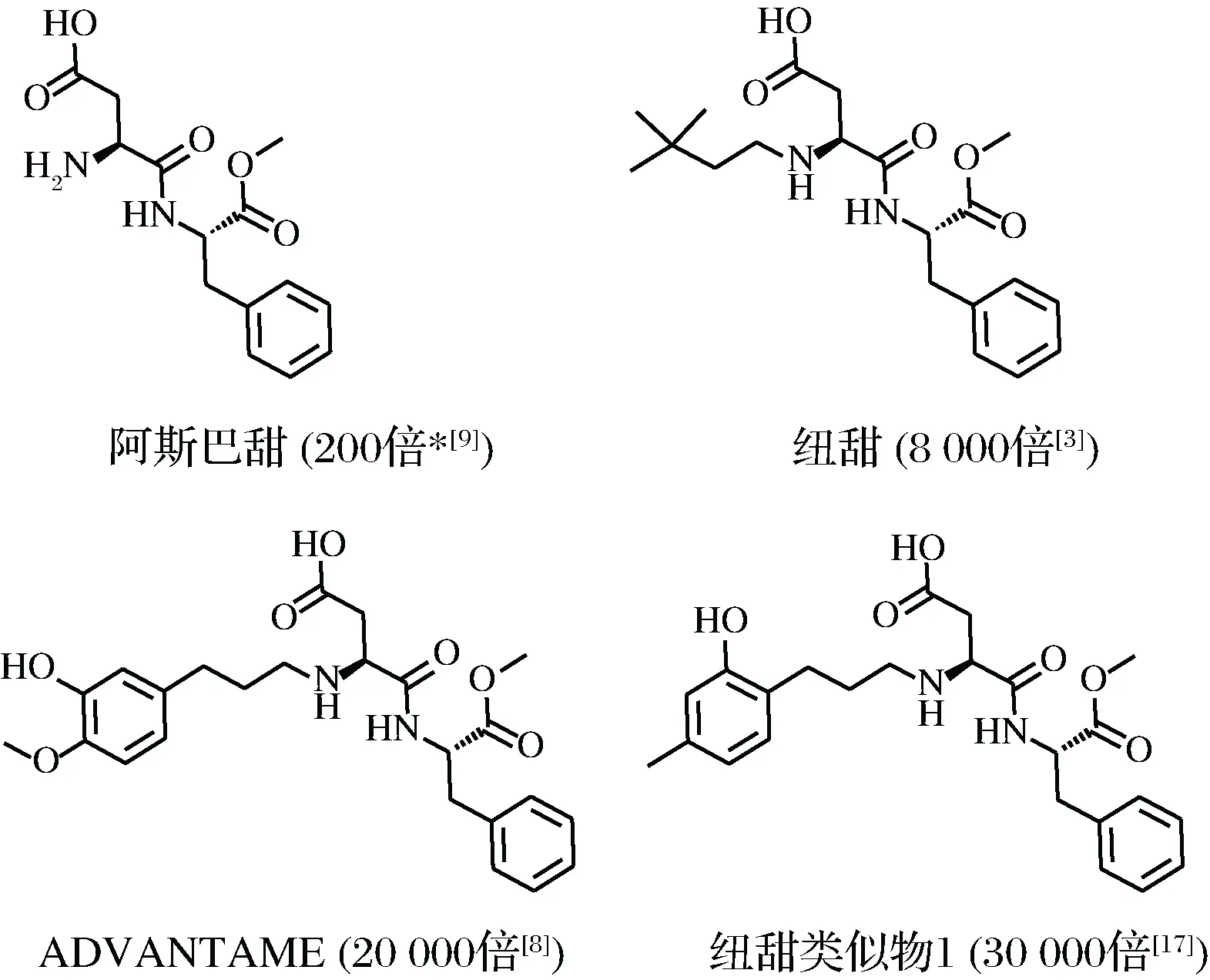
图1 纽甜及纽甜类似物的结构式Fig.1 Structure of neotame and neotame derivatives(*相对甜度以蔗糖为基准,下同)
1 材料与方法
1.1 材料与试剂
3,3-二甲基丙烯酸、2,5-二甲酚、甲烷磺酸、LiAlH4、咪唑、叔丁基二甲基氯硅烷、乙酸酐、三乙胺、4-二甲氨基吡啶、四丁基氟化铵、戴斯汀-马丁试剂、NaBH4、无水甲醇、无水四氢呋喃、无水二氯甲烷、无水N,N-二甲基甲酰(色谱纯),萨恩化学技术(上海)有限公司; 甲醇、石油醚、乙酸乙酯、浓H2SO4(分析纯),广州市光华科技股份有限公司;NaCl、Na2SO4、NH4Cl、冰乙酸(分析纯),天津市富宇精细化工有限公司。
1.2 仪器与设备
X-5控温型显微熔点测定仪,北京泰克仪器有限公司;AUTOPOL-III型旋光仪, 鲁道夫研究分析公司;MS-H-Pro磁力搅拌器,美国赛洛捷克公司;N-1300V-WB型旋转蒸发器,东京理化器械株式会社;AL204电子天平,瑞士梅特勒-托利多公司;EQUINOX-55红外光谱仪,瑞士Bruker公司;电子轰击电离质谱仪,美国Thermo公司;AVANCE-III型核磁共振波谱仪,500 MHz,瑞士Bruker公司。
1.3 实验方法
1.3.1 合成路线
新型纽甜类似物甜味剂的合成路线见图2。
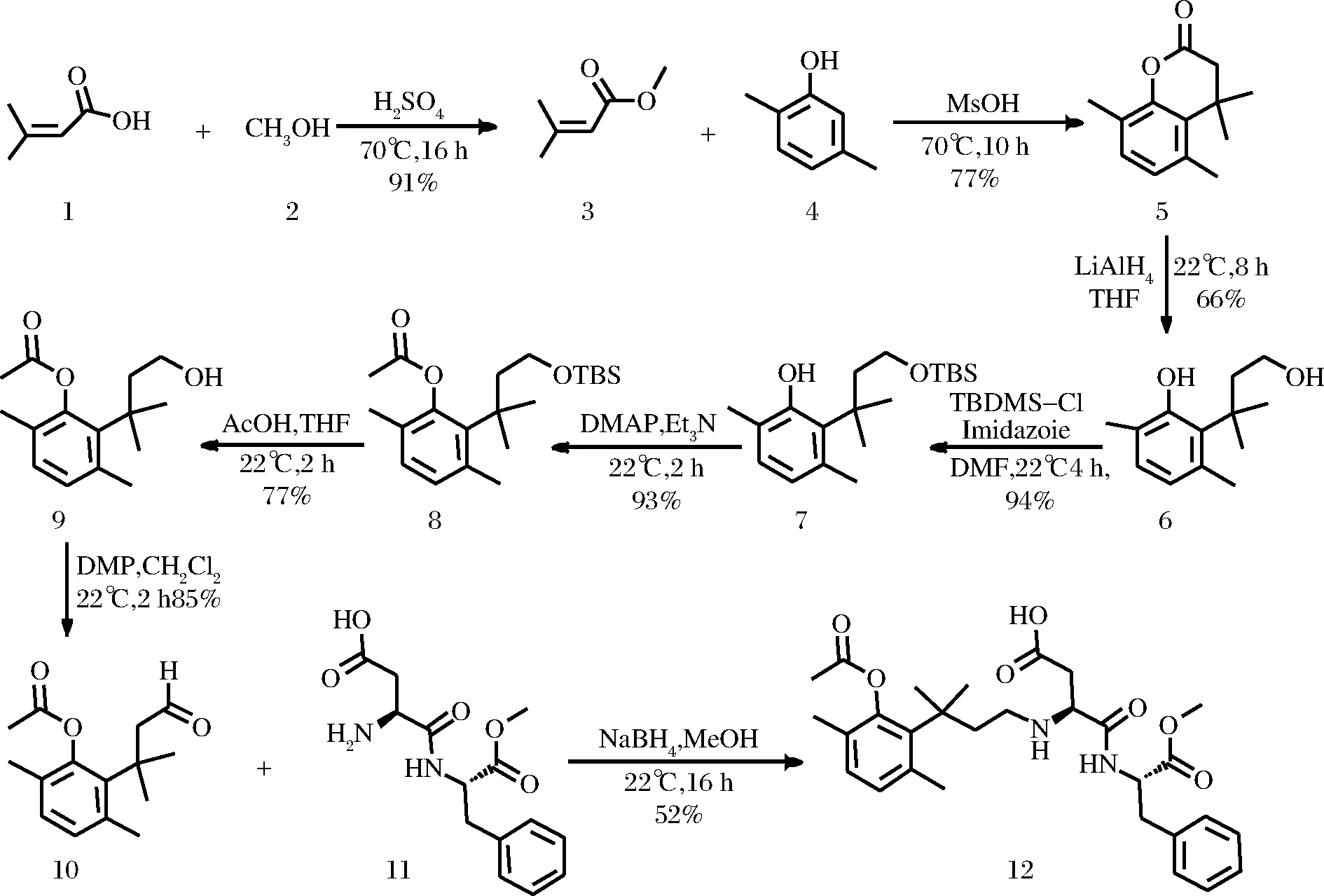
图2 N-[N-[3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁基]-L-α-天冬氨酰]-L-苯丙氨酸1-甲酯的合成路线Fig.2 Synthetic route of N-[N-[3-(2-acetyl-3,6- dimethylphenyl)-3-methylbutyl]-L-α-aspartyl]- L-phenylalanine 1-methyl ester
1.3.2 3,3-二甲基丙烯酸甲酯的制备
在冰浴条件下向100 mL圆底烧瓶中依次加入无水甲醇2 (3.20 g, 0.10 mol,1.0 equiv)、浓H2SO4(0.02 mL)和3,3-二甲基丙烯酸1(9.30 g, 0.093 mol,0.93 equiv),加热至70 ℃并冷凝回流,磁力搅拌16 h后,向反应液中依次加入H2O(20 mL)、NaHCO3(10 mL),混合液用CH2Cl2(3×10 mL)萃取有机相,合并有机相,饱和NaCl洗涤,无水Na2SO4干燥,减压蒸馏除去溶剂,柱层析纯化[洗脱剂:V(二氯甲烷)∶V(乙酸乙酯)=10∶0→9∶1],得到白色油状物化合物3(9.64 g),产率为91%。
1.3.3 4,4,5,8-四甲基-3,4-二氢香豆素的制备[20-23]
取2,5-二甲酚4(3.95 g, 32.4 mmol, 1.0 equiv)溶于甲烷磺酸(5.00 mL),室温下滴加3,3-二甲基丙烯酸甲酯3(5.9 mL,48.33 mmol, 1.5 equiv),加热至70 ℃并冷凝回流,在氮气保护下磁力搅拌10 h后,薄层层析(TLC)监测,待反应结束,依次加入H2O(20 mL)、NaHCO3(15 mL),乙酸乙酯(3×20 mL)萃取有机层,合并有机相,饱和NaCl水洗,无水Na2SO4干燥,减压蒸馏除去溶剂,柱层析纯化[洗脱剂:V(石油醚)∶V(乙酸乙酯)=10∶0→8∶2],得到白色晶体化合物5(5.12 g),产率为77%。
1.3.4 3-(2-羟基-3,6-二甲基苯基)-3-甲基丁醇的制备[20-23]
取LiAlH4(1.35 g,35.53 mmol,2.36 equiv)在冰浴下溶于无水四氢呋喃(50 mL)中,缓慢加入到装有4,4,5,8-四甲基-3,4-二氢香豆素5(3.10 g, 15.05 mmol,1.0 equiv)的无水四氢呋喃(5 mL)中,在氮气保护下室温磁力搅拌8 h,TLC板监测,待反应结束后,冰浴降温20 min,加Et2O(50 mL)稀释,再加H2O(1.35 mL),之后加入15%NaOH溶液(1.35 mL),而后加入H2O(4.05 mL),淬灭结束撤掉冰浴,抽滤前加无水Na2SO4得到滤液,并用无水Et2O清洗残渣,乙酸乙酯(3×20 mL)萃取有机相,合并有机相,饱和NaCl水洗,无水Na2SO4干燥,减压蒸馏除去溶剂,柱层析分离纯化[洗脱剂:V(石油醚)∶V(乙酸乙酯)=10∶0→7∶3],得到白色晶体化合物6(2.08 g),产率为66%。
1.3.5 2-(4-((叔丁基二甲基硅烷基)氧基)-2-甲基-2-丁基)-3,6-二甲基苯酚的制备[23]
取3-(2-羟基-3,6-二甲基苯基)-3-甲基丁醇6 (2.08 g, 10.00 mmol, 1.0 equiv)在冰浴下溶于无水N,N-二甲基甲酰胺(15 mL),缓慢加入咪唑(1.02 g,15.00 mmol,1.5 equiv)和叔丁基二甲基氯硅烷(1.80 g, 12.00 mmol,1.2 equiv),在氮气保护下室温磁力搅拌4 h,TLC板跟踪反应,待反应结束后,反应混合物加入H2O(10 mL),乙酸乙酯(3×15 mL)萃取有机相,有机相用饱和NaCl水溶液(3×10 mL)洗涤,无水Na2SO4干燥,减压蒸馏除去溶剂,柱层析分离纯化[洗脱剂:V(石油醚)∶V(乙酸乙酯)=10∶0→9∶1],得到浅棕色油状化合物7(3.02 g),产率为94%。
1.3.6 2-(4-((叔丁基二甲基硅烷基)氧基)-2-甲基-2-丁基)-3,6-二甲基乙酸苯基酯的制备[23]
取2-(4-[(叔丁基二甲基硅烷基)氧基]-2-甲基-2-丁基)-3,6-二甲基苯酚7(1.51 g, 4.68 mmol, 1.0 equiv)溶于无水CH2Cl2(10 mL),依次加入乙酸酐(0.66 mL,7.02 mmol, 1.5 equiv)、三乙胺(0.65 mL,4.68 mmol, 1.0 equiv)和4-二甲氨基吡啶(57.21 mg, 0.47 mmol, 0.1 equiv),氮气保护下室温磁力搅拌2 h,TLC跟踪监测反应,待反应结束,加入水(10 mL)、乙酸乙酯(3×10 mL)萃取,合并有机相,饱和NaCl洗涤,无水Na2SO4干燥,减压蒸馏除去溶剂,柱层析分离纯化[洗脱剂:V(石油醚)∶V(乙酸乙酯)=10∶0→8∶2],得到棕色油状化合物8(1.59 g),产率为93%。
1.3.7 3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁醇的制备[23]
取2-(4-[(叔丁基二甲基硅烷基)氧基]-2-甲基-2-丁基)-3,6-二甲基乙酸苯基酯8(300 mg, 0.824 mmol, 1.0 equiv)溶于四氢呋喃(2 mL)中,再加入H2O(2 mL)和AcOH(6 mL), 氮气保护下室温磁力搅拌2 h,TLC跟踪监测反应,待反应结束,加入水(5 mL)、乙酸乙酯(3×5 mL)萃取,合并有机相,饱和NaCl洗涤,无水Na2SO4干燥,减压蒸馏除去溶剂,柱层析分离纯化[洗脱剂:V(石油醚)∶V(乙酸乙酯)=10∶0→8∶2],得到棕色油状化合物9(158 mg), 产率为77%。
1.3.8 3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁醛的制备[23]
取3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁醇9(500 mg,2.00 mmol,1.0 equiv)溶于无水CH2Cl2(6 mL)中,冰浴下加入Dess-Martin periodinane(1.27 g, 3.00 mmol,1.5 equiv),氮气保护下室温磁力搅拌2 h,TLC监测反应,待反应结束后,加入Na2S2O3(5 mL)、NaHCO3(3 mL),水相用乙酸乙酯(3×15 mL)萃取,合并有机相,饱和NaCl洗涤,无水Na2SO4干燥,减压蒸馏除去溶剂,柱层析分离纯化[洗脱剂:V(石油醚)∶V(乙酸乙酯)=10∶0→7∶3],得到浅棕色油状化合物10(421.6 mg),产率为85%。
1.3.9N-[N-[3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁基]-L-α-天冬氨酰]-L-苯丙氨酸1-甲酯的合成[24-25]
取3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁醛10(150 mg,0.604 mmol,1.0 equiv),加入到无水甲醇(10 mL),之后缓慢分批次加入阿斯巴甜11(177.57 mg, 0.604 mmol,1.0 equiv),氮气保护下室温磁力搅拌16 h,TLC监测有新点生成后,冰浴下分批次加入NaBH4(34.27 mg,0.906 mmol,1.5 equiv),之后室温继续反应4 h,TLC监测反应,待反应结束,冰浴下加入H2O(10 mL)、NaHCO3(10 mL),用CH2Cl2(3×10 mL)萃取水相,合并有机相,饱和NaCl水洗有机相,无水Na2SO4干燥,减压蒸馏除去溶剂,柱层析分离纯化[洗脱剂:V(丙酮)∶V(甲醇)=10∶0→8∶2],得到白色晶体化合物12(165.40 mg),产率为52%。
1.4 甜度测定
1.4.1 甜度及甜味感官评价
目前对高倍甜味剂进行的甜度测定,大多数是通过感官评价[26]品尝来评判大致甜度,通过适当稀释甜味剂,与相当甜度的蔗糖溶液在等条件下比较,从而测定产物相对蔗糖的甜度,由于感官评价受到各种因素的影响,相对甜度数据之间难免有出入。
1.4.2 相对甜度测定方法
1.4.2.1 对照甜味剂溶度和待测甜味剂溶度的配置[8]
对照甜味剂的浓度配制:在25 ℃下称取1 g蔗糖溶于0.01 L蒸馏水,即为浓度100 g/L的蔗糖溶液,依次配制100、200、300……900、1 000 g/L的蔗糖溶液;再称取1 g阿斯巴甜溶于1 L蒸馏水,即为质量浓度1 g/L的阿斯巴甜溶液, 依次配制1、2、3……9、10 g/L的阿斯巴甜溶液作为对照甜味剂。
待测甜味剂溶液浓度配制:在25 ℃下称取1 mg终产物溶于1 L蒸馏水,即为质量浓度1 mg/L的样品溶液,依次配制1、2、4、6……18、20 mg/L的终产物甜味剂溶液作为待测样品。
1.4.2.2 待测甜味剂甜度计算
待测甜味剂的甜度为相对甜度,采用感官评价品尝的方式来测定,评定小组为12人(男女1∶1),组员分别进行品尝,判断系列梯度待测甜味剂中与对照甜味剂溶液相同或者相近的样品浓度,从而通过计算待测甜味剂的相对甜度,计算公式[26]如下:

(1)
在品尝2个待测甜味剂样品溶液前都要用纯净水漱口,并间隔15 min后再品尝下一个待测样品,以免保证不被前者样品残留的味感所干扰,以免对评价结果产生影响。
2 结果与分析
2.1 产物的光谱表征
2.1.1 3,3-二甲基丙烯酸甲酯的结构鉴定
1H NMR (500 MHz, CDCl3) δ 5.67(s, 1H), 3.67(s, 3H), 2.16(s, 3H), 1.88(s, 3H)。
2.1.2 4,4,5,8-四甲基-3,4-二氢香豆素的结构鉴定
1H NMR (500 MHz, CDCl3) δ 6.97(d,J=7.7 Hz, 1H), 6.81(d,J=7.7 Hz, 1H), 2.59(s, 2H), 2.46(s, 3H), 2.26(s, 3H), 1.45(s, 6H);
IR (KBr)vmax2 971, 2 946, 1 774, 1 761, 1 470, 1 309, 1 235, 1 197, 1 111, 1 045, 830, 625 cm-1;
MS (ESI, +ve) m/z 205.4 [(M+H)+,100%]。
2.1.3 3-(2-羟基-3,6-二甲基苯基)-3-甲基丁醇的结构鉴定
1H NMR (500 MHz, CDCl3) δ 6.86(d,J=7.6 Hz, 1H), 6.59(d,J=7.6 Hz, 1H), 3.60(t,J=7.1 Hz, 2H), 2.49(s, 3H), 2.24(d,J=7.1 Hz, 2H), 2.20(s, 3H), 1.58(s, 6H);
IR (KBr)vmax3 415, 2 971, 2 926, 1 462, 1 442, 1 268, 1 223, 1 046, 793 cm-1;
MS (ESI, +ve)m/z209.3 [(M+H)+, 100%]。
2.1.4 2-(4-((叔丁基二甲基硅烷基)氧基)-2-甲基-2-丁基)-3,6-二甲基苯酚的结构鉴定
1H NMR (500 MHz, CDCl3) δ 6.87 (d,J=7.6 Hz, 1H) , 6.60 (d,J=7.6 Hz, 1H), 5.79 (s, 1H), 3.63 (t,J=6.8 Hz, 2H), 2.50 (s, 3H), 2.21 (s, 3H), 2.18 (t,J=6.8 Hz, 2H), 1.61 (s, 6H), 0.91 (s, 9H), 0.05 (s, 6H);
13C NMR (126 MHz, CDCl3) δ 153.89, 135.53, 132.14, 127.83, 125.27, 122.87, 61.77, 45.03, 39.76, 32.31, 25.97, 25.64, 18.32, 16.43, -5.36;
IR (KBr)vmax3 439, 2 954, 2 927, 2 857, 1 637, 1 463, 1 384, 1 256, 1 223, 1 088, 836, 811, 794 cm-1;
MS (ESI, +ve)m/z323.3 [(M+H)+, 100%]。
2.1.5 2-(4-((叔丁基二甲基硅烷基)氧基)-2-甲基-2-丁基)-3,6-二甲基乙酸苯基酯的结构鉴定
1H NMR (300 MHz, CDCl3) δ 6.97 (d,J=7.8 Hz, 1H), 6.92 (d,J=7.8 Hz, 1H), 3.48 (t,J=7.6 Hz, 2H), 2.53 (s, 3H), 2.29 (s, 3H), 2.05 (s, 3H), 1.59 (s, 2H), 1.49 (s, 6H), 0.85 (m, 9H), -0.02 (s, 6H);
13C NMR (75 MHz, CDCl3) δ 169.47, 148.70, 137.39, 136.25, 131.19, 129.18, 128.42, 60.76, 46.15, 39.46, 31.82, 25.94, 25.25, 21.45, 18.24, 17.07, -5.33;
IR (KBr)vmax2 956, 2 928, 2 856, 1 762, 1 463, 1 384, 1 367, 1 255, 1 209, 1 090, 836, 810, 775 cm-1;
MS (ESI, +ve) m/z 365.4 [(M+H)+, 100%]。
2.1.6 3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁醇的结构鉴定
1H NMR (400 MHz, DMSO-d6) δ 6.98 (d,J=7.4 Hz, 1H), 6.91 (d,J=7.8 Hz, 1H), 4.24(s, 1H), 3.20(s, 2H), 2.48 (s, 3H), 2.28 (s, 3H), 1.96 (s, 3H), 1.99-1.90(m, 2H) 1.41 (s, 6H);
13C NMR (101 MHz, DMSO-d6) δ 169.12, 148.50, 137.30, 135.78, 130.70, 128.88, 128.16,58.19, 45.65, 38.96, 31.60, 24.75, 21.11, 16.71;
IR (KBr)vmax3 386, 2 959, 1 757, 1 462, 1 369, 1 209, 1 129, 1 033 cm-1;
MS (ESI, +Ve) m/z 273.2 [(M+Na)+, 100%]。
2.1.7 3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁醛的结构鉴定及其谱图
化合物10的氢谱和碳谱如图3所示。
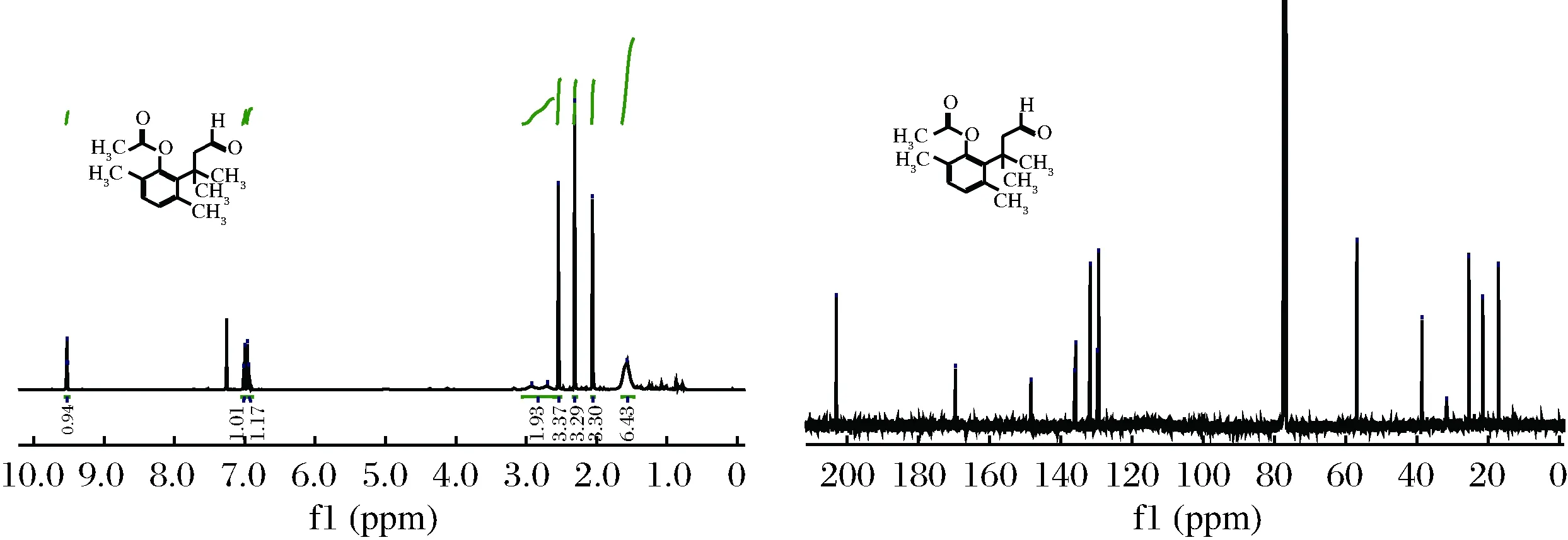
图3 化合物10的1H-NMR和13C-NMR谱图Fig.3 1H-NMR and 13C-NMR spectra of compound 10
1H NMR (400 MHz, CDCl3) δ 9.53 (t,J=2.6 Hz, 1H), 7.01 (d,J=7.7 Hz, 1H),6.95 (d,J=7.8 Hz, 1H),2.93(s, 1H),2.70 (s, 1H),2.54 (s, 3H),2.31 (s, 3H),2.06 (s, 3H),1.57 (s, 6H)。
由氢谱数据可知,δ 9.53 (t,J=2.6 Hz, 1H)为—CHO,7.01 (d,J=7.7 Hz, 1H)为苯环上的氢,6.95 (d,J=7.8 Hz, 1H) 为苯环上的氢,2.93(s, 1H)和2.70 (s, 1H)为—CH2,2.54 (s, 3H)为—CO—CH3,2.31 (s, 3H)为Ar—CH3,2.06 (s, 3H) 为Ar—CH3,1.57 (s, 6H)为—C(CH3)2。
13C NMR (101 MHz, CDCl3) δ 203.02, 169.55, 148.45, 136.12, 135.86, 131.77, 129.78, 129.34, 56.92, 38.58, 31.69, 25.46, 21.55, 17.16。
由碳谱数据可知,δ 203.02为—CHO,169.55为—CO—O,148.45, 136.12, 135.86, 131.77, 129.78, 129.34为苯环的6个碳,56.92为—CH2—CHO的亚
甲基碳和—CO—CH3的甲基碳,38.58为—C(CH3)2的季碳,31.69,和25.46为—C(CH3)2的2个甲基碳,21.55为与苯环相连的—CH3碳,17.16为与苯环相连的—CH3碳。
化合物10的红外光谱和质谱如图4所示。
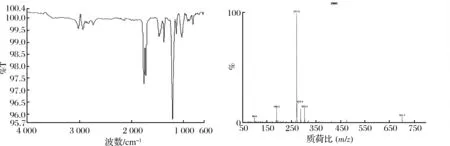
图4 化合物10的IR和ESI-MS谱图Fig.4 IR and ESI-MS spectra of compound 10
IR (KBr)vmax1 758, 1 719, 1 465, 1 368, 1 205, 1 130, 1 022, 811 cm-1。

MS (ESI, +Ve)m/z271.3 [(M+Na)+, 100%]。
由质谱数据可知,已知化合物10的分子质量为M=248,质谱图显示有271.3,满足(M+Na)+分子质量。
2.1.8N-[N-[3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁基]-L-α-天冬氨酰]-L-苯丙氨酸1-甲酯结构鉴定及其谱图
化合物12的氢屈和碳谱如图5所示。
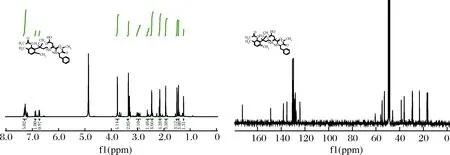
图5 化合物12的1H-NMR和13C-NMR谱图Fig.5 1H-NMR and 13C-NMR spectra of Compound 12
1H NMR (400 MHz, CD3OD) δ 7.35-7.23(m, 5H), 6.88(d,J=6.7 Hz, 1H), 6.73(d,J=7.6 Hz, 1H), 3.77(s, 4H), 3.35 (s, 3H), 3.27(d,J=4.8 Hz, 1H), 3.00(d,J=13.3 Hz, 1H), 2.94(dd,J=13.8, 10.1 Hz, 1H), 2.61(d,J=15.7 Hz, 1H), 2.46(d,J=4.9 Hz, 5H), 2.17(d,J=9.9 Hz, 4H), 1.93 (s, 3H), 1.50(s, 3H), 1.45(s, 3H), 1.25(s, 1H)。
由氢谱数据可知,δ 7.35-7.23(m, 5H)为苯丙氨酸的一取代苯环上5个氢,6.88(d,J=6.7 Hz, 1H)和6.73(d,J=7.6 Hz, 1H)为3(2-乙酰基-3,6-二甲基苯基)-3-甲基丁基苯环上2个氢,3.77(s, 4H)为苯丙氨酸中—O—CH3甲基氢和—CH—NH—中的1个氢,3.35 (s, 3H)为3(2-乙酰基-3,6-二甲基苯基)-3-甲基丁基中—CH2的氢和天冬氨酸中—CH—NH—中的1个氢,3.27(d,J=4.8 Hz, 1H), 3.00(d,J=13.3 Hz, 1H), 2.94(dd,J=13.8, 10.1 Hz, 1H), 2.61(d,J=15.7 Hz, 1H)为天冬氨酸和苯丙氨酸中—CH2的氢,2.46(d,J=4.9 Hz, 5H)为3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁基上的—CO—CH3和—CH2—C(CH3)2的亚甲基的2个氢,2.17(d,J=9.9 Hz, 4H)和1.93 (s, 3H) 为3(2-乙酰基-3,6-二甲基苯基)-3-甲基丁基苯环相连的2个—CH3和CH2的1个氢,1.50(s, 3H)和1.45(s, 3H) 为3(2--乙酰基-3,6-二甲基苯基)-3-甲基丁基中—C(CH3)2的6个氢,1.25(s, 1H)为天冬氨酸中—NH—CH2的1个氢。
13C NMR (100 MHz, CD3OD) δ 172.76, 148.95, 138.15, 135.22, 130.51, 130.37, 129.64, 129.42, 128.66, 128.07, 127.41, 124.20, 60.66, 56.05, 54.83, 52.94, 45.98, 38.72, 36.20, 29.53, 29.31, 29.17, 23.34, 16.95, 16.39。

化合物12的红外光谱和质谱如图6所示。
IR (KBr)vmax3 341, 2 951, 2 927, 1 744, 1 668, 1 581, 1 438, 1 388, 1 303, 1 254, 1 202, 1 123, 1 032, 805, 701 cm-1。

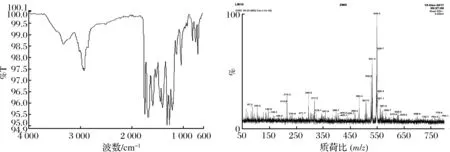
图6 化合物12的IR和ESI-MS谱图Fig.6 IR and ESI-MS spectra of compound 12
MS (ESI, +Ve)m/z549.2 [(M+Na)+, 100%]。
由质谱数据可知:已知化合物12的分子质量为M=526,质谱图显示有549.2,满足(M+Na)+分子质量。
综合以上核磁共振、质谱及红外图谱数据,最终确定合成的化合物为N-[N-[3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁基]-L-α-天冬氨酰]-L-苯丙氨酸1-甲酯。
2.2 产物的物理学属性
2.2.1 终产物N-[N-[3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁基]-L-α-天冬氨酰]-L-苯丙氨酸1-甲酯的物理学特性
2.3 产物的甜度
通过试验小组感官评价综合得到的数据,将各个对照甜味剂的浓度和等甜度的终产物浓度关系制成曲线图,通过上述计算公式,即可计算出待测物的相对甜度,曲线图如图7所示。
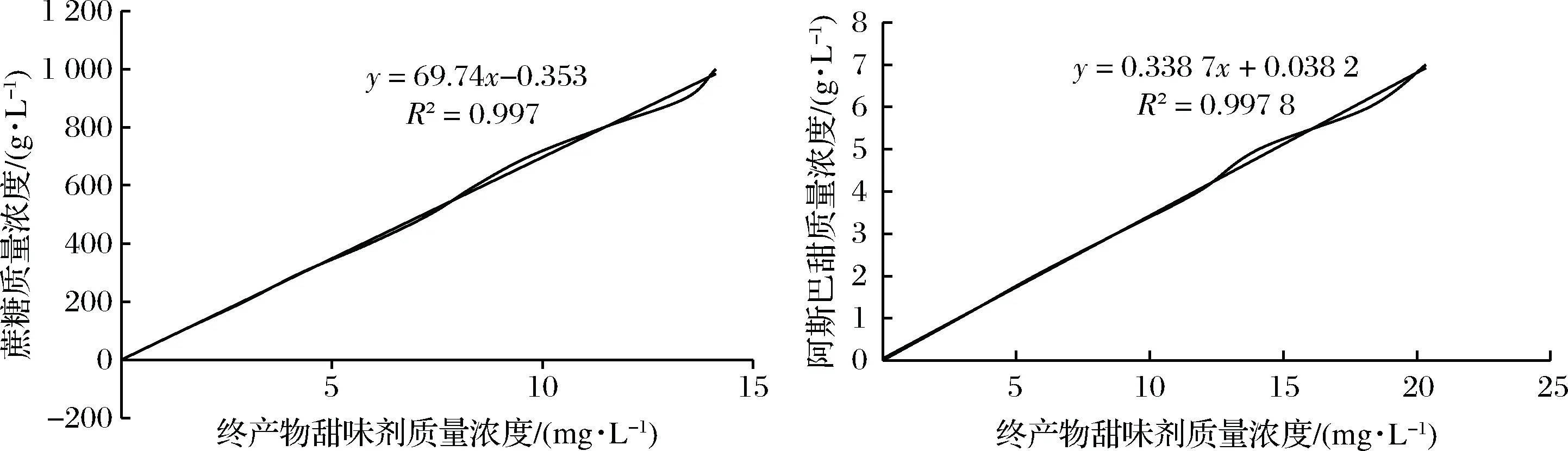
图7 蔗糖和阿斯巴甜**质量浓度与终产物甜味剂质量浓度的关系Fig.7 The concentration relationship between sucrose, aspartame and final sweetener(**阿斯巴甜的甜度约为蔗糖的200倍)
由图7可知,纽甜类似物N-[N-[3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁基]-L-α-天冬氨酰]-L-苯丙氨酸1-甲酯的甜度约为蔗糖的70 000倍,约为阿斯巴甜的338倍,其甜味出现比蔗糖要缓慢,有一定的滞后性,但是甜味持续时间比蔗糖和阿斯巴甜长,且甜味纯正,口感清新,与纽甜的口感类似,没有糖精钠、AK糖等[9]甜味剂存在的苦涩感和金属味。
3 结论
本文合成路线中,原料廉价易得、反应过程温和,通过酯化、傅克烷基化、还原、保护与去保护以及氧化等7步反应成功合成了二肽类纽甜类似物最重要的中间体醛:3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁醛,最后使用NaBH4作为还原剂使中间体醛类与阿斯巴甜发生还原胺化反应,成功合成了新型纽甜类似物甜味剂N-[N-[3-(2-乙酰基-3,6-二甲基苯基)-3-甲基丁基]-L-α-天冬氨酰]-L-苯丙氨酸1-甲酯,其结构采用红外光谱(IR)、质谱(MS)及核磁共振(NMR)进行结构鉴定和表征,确定其为最终目标产物并进行甜度测定,测得甜度约为蔗糖的70 000倍。本文合成路线是一条全新的路线,具有经济型和绿色型的双重价值,为未来新一代高倍甜味剂的工业开发提供新的参考方向,同时对于该甜味剂的安全性评价和毒理试验又是未来一个新的研究方向。
[1] SCHIFFMAN S S, SATTELY M, ELIZABETH A.Sensory properties of neotame: comparison with other sweeteners[J].ACS Symposium Series, 2008, 33: 511-529.
[2] SATYANATHI K, RAJU P B, BUPESH K V, et al.Neotame: High intensity low caloric sweetener[J].Asian Journal of Chemistry, 2010, 22(7): 5 792-5 796.
[3] NOFRE C, TINTI J-M.Neotame: Discovery, properties, utility[J].Food Chemistry, 2000, 69(3): 245-257.
[4] LIU Bo, HA M, MENG Xuan-Yu, et al.Molecular mechanism of species-dependent sweet taste toward artificial sweeteners[J].The Journal of Neuroscience, 2011, 31(30): 11 070-11 076.
[5] BANNWART G, BOLINI H, TOLEDO M, et al.Application of neotame in catchup: development of prototypes and sensory studies[J].Alimentos e Nutricao, 2007, 18(4): 357-364.
[6] MORALES C H, MONYES A H, GANTE A V.Effect of the partial substitution of sucrose by neotame on the sensory and consistency characteristics of plain yogurt[J].Revista Mexicana de Ingenieria Quimica, 2007, 6(2): 203-209.
[7] NOFRE C.N-substituted derivatives of aspartame useful as sweetening agent[P].US, 5480668.1996-01-02.
[8] AMINO Y, MORI K, TOMIYAMA Y, et al.Development of new, low calorie sweetener: new aspartame derivative[J].ACS Symposium Series, 2008, 30: 463-480.
[9] 于小颖.新型甜味剂纽甜的合成及其应用研究[D].济南:山东大学, 2016.
[10] OTABE A, FUJIADE T, MASUYAMA T, et al.Postscript on advantame-A novel high-potency low-calorie sweetener[J].Food and Chemical Toxicology, 2011, 49(1): S1.
[11] OTABE A, FUJIEDA T, MASUYAMA T, UBUKATA K, LEE C.Advantame-an overview of the toxicity data[J].Food and Chemical Toxicology, 2011, 49(1): S2-S7.
[12] UBUKATA K, NAKAYAMA A, MINHARA R.Pharmacokinetics and metabolism ofN-[N-[3-(3-hydroxy-4-methoxyphenyl) propyl]-L-α-aspartyl]-L-phenylalanine 1-methyl ester, monohydrate (advantame) in the rat, dog, and man data[J].Food and Chemical Toxicology, 2011, 49(1): S8-S29.
[13] OTABE A, FUJIEDA T, MASUYAMA T.In vitro and in vivo assessment of the mutagenic activity ofN-[N-[3-(3-hydroxy-4-methoxyphenyl) propyl]-L-α-aspartyl]-L-phenylalanine1-methyl ester, monohydrate (advantame)[J].Food and Chemical Toxicology, 2011, 49(1): S30-S34.
[14] WARRINGTON S, LEE C, OTABE A, et al, et al.Acute and multiple-dose studies to determine the safety, tolerability and pharmacokinetic profile of advantame in healthy volunteers[J].Food and Chemical Toxicology, 2011, 49(1): S77-S83.
[15] ACREE T E, LINDLEY M.Structure-activity relationship and AH-B after 40 years[J].ACS Symposium Series, 2008, 6: 96-108.
[16] CAPUA A D, GOODMAN M, AMINO Y, et al.Conformation analysis of aspartame-based sweeteners by NMR spectroscopy, molecular dynamics simulations, and X-ray diffraction studies[J].Chem Bio Chem, 2006, 7(2): 377-387.
[17] GAN Shui-feng, YAN Ri-an, LU Yu-yun.Synthesis and characterization of a novel sweetener with high sweetness strength[J].European Food Research and Technology, 2014, 238(1): 113-120.
[18] 白德发,晏日安,黄雪松.阿斯巴甜衍生物甜味剂的合成研究[J].食品科技, 2008, 33(11): 228-230.
[19] 甘水峰,晏日安,李爱军.N-[N-[3-(2-羟基-4-甲氧基苯基)丙基]-L-α-天冬氨酸]-L-苯丙氨酸1-甲酯的合成研究[J].食品工业科技, 2011, 32(8): 336-338.
[20] SANEYOSHI H, SHIMAMURA K, SAGAWA N, et al, ea al.Development of a photolabile protecting group for phosphodiesters in oligonucleotides[J].Bioorganic & Medicinal Chemistry Letters, 2015, 25(10): 2 129-2 132.
[21] SONG Xiao-ping, HE H T, SIAHAAN T J.Synthesis of cyclic prodrugs of aggrastat and its analogue with a modified phenylpropionic acid linker[J].Organic Letters, 2002, 4(4): 549-552.
[22] AMSBERRY K L, BORCHARD R T.The lactonization of 2’-hydroxyhydrocinnamic acid amides: A potential prodrug for amines [J].Journal of Organic Chemistry, 1990, 55(23): 5 867-5 877.
[23] LIAO Yuan, WANG Bing-he.Substituted coumarins as esterase-sensitive prodrug moieties with improved release rates[J].Bioorganic & Medicinal Chemistry Letters, 2009, 9(13): 1 795-1 800.
[24] TAJBAKHSH M, HOSSEINZADEH R, ALINEZHAD H, GHAHARI S, et al.Catalyst-free one-pot reductive alkylation of primary and secondary amines andN,N-dimethylation of amino acids using sodium borohydride in 2,2,2-trifluoroethanol[J].Synthesis, 2011, 3: 490-496.
[25] ZHANG Gui-ping, CHENG Jian-jun, MCCORVY J D, et al.Discovery ofN-substituted (2-phenylcyclopropyl)methylamines as functionally selective serotonin 2C receptor agonists for potential use as antipsychotic medications[J].Journal of Medicinal Chemistry, 2017, 60(14): 6 273-6 288.
[26] 吴美红,郑建仙.超高倍甜味剂N-[N-(3-(3-羟基-4-甲氧基苯基)丙基]-阿斯巴甜类似物的合成研究[J].食品与发酵工业, 2009, 35(6): 1-5.
