N-糖基化改造碱性果胶酶的热稳定性
2018-06-14昂安娜堵国成葛飞朱龙宝江志超马琪森朱龙龙陶玉贵
昂安娜,堵国成,2,葛飞,朱龙宝,江志超,马琪森,朱龙龙,陶玉贵*
1(安徽工程大学 生物与化学工程院,安徽 芜湖,241000) 2(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122)
碱性果胶酶(alkaline polygalacturonate lyase, PGL)即聚半乳糖醛酸裂解酶,可在碱性条件下(pH 8~11)通过反式消去作用断开聚半乳糖醛酸的α-1, 4糖苷键,生成不饱和的寡聚半乳糖醛酸,广泛应用于纺织、环境、造纸、食品等领域中果胶质的降解[1],是种商业价值非常高的工业酶。PGL在微生物中分布广泛,但野生型菌株生产PGL的能力普遍有限,严重限制了PGL的大规模生产[2]。近年来,研究者们开始利用基因工程技术构建重组菌,重组PGL已在大肠杆菌(Escherichiacoli)、枯草芽孢杆菌(Bacillussubtilis)和毕赤酵母(Pichiapastoris)中成功表达[3-6]。毕赤酵母由于具有遗传稳定,分泌系统强,易于高密度培养,胞外杂蛋白表达量少等优势成为最受关注的表达宿主之一[7]。但是,以往的研究主要集中于重组菌的构建和发酵条件的优化,对于从基因层面改造PGL以提高其表达效率,改善其酶学性质的研究并不多,涉及N-糖基化修饰的研究更是寥寥无几。
我们在之前的工作中发现,将PGL基因导入毕赤酵母中表达会使酶在128、185和353三个位点发生N-糖基化,于是开始对该重组酶进行N-糖基化改造。先将这3个位点的天冬酰胺分别突变成谷氨酰胺,再进行组合突变,获得了1株酶活高但热稳定性差的重组菌GS115/N185Q-N353Q[8]。本研究通过定点突变对PGL进行进一步的N-糖基化改造,以期获得酶活高热稳定性好的突变酶。
结合前期实验结果,我们猜想去除N-糖基化之所以会对PGL的热稳定性造成不利影响,可能是因为某些发生N-糖基化的天冬酰胺被谷氨酰胺取代,会破坏其与周围氨基酸间原有的作用力,从而改变蛋白质的区域结构,造成突变后能量变高。如果转换方式去除N-糖基化,例如将天冬酰胺突变成相比谷氨酰胺突变能更低的氨基酸,或者不突变天冬酰胺而是将其后面的苏氨酸突变成除丝氨酸外突变能更低的氨基酸,或许能降低对热稳定性的不良影响。这是本实验通过N-糖基化改造PGL热稳定性的第一个策略。此外,许多文献报道引入N-糖基化能提高酶的热稳定性[9-10],但这种作用具有点特异性[11]。近期有研究证明,在蛋白质的反向转角区插入具有 EAS 特征的新N-糖基化能较可靠地提高其热稳定性[12]。 EAS的氨基酸组成有3种形式:F-N-X-T、F-X-N-X-T和F-X-X-N-X-T(F 是苯丙氨酸,N是天冬酰胺,X 是除脯氨酸外任意氨基酸,T 是苏氨酸)[13-14]。相比普通的N-糖基化序列N-X-T,EAS的天冬酰胺前面1-3位置多了1个芳香族氨基酸苯丙氨酸,当该序列位于反向转角区时,苯丙氨酸会与天冬酰胺连接的糖链及苏氨酸发生相互作用并形成1个稳定该区域结构的模块,从而对蛋白质整体构象的稳定做出贡献[15]。据此,我们可以筛选PGL的反向转角区引入 EAS 来进一步提高其热稳定性,这是本实验改造PGL热稳定性的第二个策略。
在软件建模分析的基础上,通过第一个策略,PGL的半衰期被提高了176%,虽然离目标值相差甚远,但作为第一阶段的改造算是取得了一定的成果;接着,筛选出3个合适的位点分别引入具有EAS序列特征的新N-糖基化,后期又进行了组合突变,将PGL的半衰期进一步提高,达到1.35 h,与目标值接近。这两个策略不仅没有对酶的催化活力造成负面影响,反而使比酶活小幅上升,即我们在毕赤酵母中获得了具有更佳酶学性质的PGL。本研究表明:在去N-糖基化前对该位点进行氨基酸稳定性突变以确定最佳突变是有意义的;在酶的反向转角区引入具有EAS序列特征的新N-糖基化对提高其热稳定性具有显著促进作用。这些结论对于重组酶在毕赤酵母中的N-糖基化改造有具有借鉴意义。
1 材料与方法
1.1 材料与试剂
编码经N-糖基化改造的重组PGL基因N185Q-N353Q的载体E.coliTOP10 pPIC9K/N185Q-N353Q和GS115/N185Q-N353Q是本实验室在前期研究中构建好的,克隆宿主E.coliJM109和表达宿主P.pastorisGS115 (his-) 购于美国Invitrogen公司。限制性内切酶SacI和DpnI购于美国Thermo Fisher公司;Prime STAR HS DNA 聚合酶和胶回收柱回收试剂盒购于宝生物工程(大连)有限公司;G418、Kanamycin、质粒提取试剂盒和蛋白定量检测试剂盒购于生工生物工程(上海)股份有限公司;聚半乳糖醛酸(Polygalacturonic acid, PGA):分析纯,美国Sigma公司。
1.2 仪器与设备
PTC-200型基因扩增仪,美国MJ Research公司;恒温恒湿生化培养箱,山东博科生物产业有限公司;GelDoc XR凝胶成像分析系统和蛋白电泳仪,美国Bio-Rad公司;5804 R型高速冷冻离心机,德国Eppendorf公司;UV-2450型分光光度计,日本Shimadzu有限公司;AKTA蛋白纯化仪,美国GE Health公司。
1.3 方法
1.3.1 碱性果胶酶的模板确定
Discovery Studio 2017自带数据库中有两个与PGL同源性极高(同源性高达99%以上)的模板蛋白,分别是不带配体的1BN8[16]和带配体的2NZM[17],且存在区别的氨基酸位点都不在酶的催化区域或后期要引入新N-糖基化位点的反向转角区,故可直接把1BN8和2NZM作为PGL的模板进行结构分析以确定最佳突变。
1.3.2 重组表达载体的构建
根据突变体的基因序列设计引物(表1)并以pPIC9K/N185Q-N353Q为模板进行全质粒扩增,扩增条件为:95 ℃预变性5 min;34个循环(95 ℃ 30 s,60 ℃ 30 s,72 ℃ 10 min);72 ℃保温10 min。全质粒扩增的产物用DpnI处理以消化模板,回收后转化到大肠杆菌JM109感受态细胞中,后培养1 h涂板,挑选生长较好的单菌落进行提质粒和测序。

表1 实验所用引物Table 1 The primers used in this experiment
1.3.3 毕赤酵母的电转及重组子的筛选
对测序正确的菌株进行摇菌和提质粒,用SacI将质粒线性化,回收后电转至新制备好的P.pastorisGS115感受态细胞中,在MD平板上培养3~4 d,经YPD-G418(1~4 mg/mL)平板初步筛选重组子的基因拷贝数。
1.3.4 重组菌的摇瓶发酵
从YPD-G418(4 mg/mL)平板上挑取生长较好的单菌落接种于30 mL YPD培养基中,在30 ℃,220 r/min条件下培养14 h;吸取10%转接于30 mL BMGY培养基中,在相同条件下培养24 h;离心收集菌体,用生理盐水清洗菌体1~2次,转入50 mL BMMY培养基中,在22 ℃,220 r/min条件下诱导酶表达,每隔24 h添加450 μL甲醇,72 h取1次样,96 h停止发酵并离心收集上清液于4 ℃保存。
1.3.5 碱性果胶酶的提取与纯化
往各重组菌的发酵上清液中边搅拌边缓慢加入烘干后的硫酸铵粉末至浓度为50%~70%,离心得粗PGL沉淀,用5 mL A液(先配制20 mmol/L的甘氨酸溶液,再用NaOH溶液调节至pH 7.5)对粗PGL沉淀进行复溶和透析,整个提取过程确保酶处于低温环境。
纯化前先用0.22 μmol/L的滤膜将PGL的提取液过滤,再使用AKTA纯化仪和5 mL阳离子柱(HiTrapTM SP FF 2.5 cm,GE)对其进行纯化。具体纯化步骤为:用50 mL A液平衡阳离子柱,以1 mL/min的流速上样;用25 mL A液再次平衡柱子,以2 mL/min的流速用B液(先配制20 mmol/L和1 mol/L的甘氨酸-NaCl溶液,再用NaOH溶液调节至pH 7.5)进行梯度洗脱,最后根据出峰情况收集洗脱样品,将酶活最高的样品用A液透析除盐后于4 ℃保存。
1.3.6 碱性果胶酶的活性检测
为了使最后的吸光值在可读取范围内,先将待测样品稀释适当倍数再检测其酶活。PGL的具体活性检测方法为:第一步配制含钙离子的甘氨酸-NaOH缓冲液,其中甘氨酸的浓度为0.2 mol/L,CaCl2的浓度为0.44 mmol/L,用高浓度NaOH溶液调节至pH 9.4;第二步将聚半乳糖醛酸(PGA)边搅拌边缓慢加入甘氨酸-NaOH缓冲溶液中至质量浓度为2 g/L;第三步在试管中加入配制好的PGA-甘氨酸-NaOH溶液2 mL和待测稀释样品20 μL,混匀后于45 ℃水浴锅中保温15 min,在反应过程中间断地摇匀反应液;最后加入3 mL 0.03 mol/L的磷酸溶液终止反应,以无活性的PGL作为空白对照,利用分光光度计在235 nm下测定反应液中PGA的含量。PGL单位酶活(U/mL)的定义为:每分钟将PGA裂解为1 μmol不饱和的PGA所需要的酶量。
1.3.7 碱性果胶酶的酶学性质检测
用蛋白定量检测试剂盒测定各纯化样品的蛋白浓度并将它们稀释成相同且适宜的浓度,按1.3.6中方法检测其活力,即可由公式得出各突变酶的比酶活;再检测其在不同质量浓度(0.25、0.5、0.75、1、1.25、1.5、1.75、2 g/L)PGA中的活力,即可由软件GraphPad Prism 5得出各突变酶的Km值和Vmax值。
通过检测PGL的半衰期来衡量其热稳定性,将各纯化样品放入55 ℃水浴锅中保温,每隔15 min取一次样并测定其酶活,对所得数据进行统计并按照文献所述方法算出各突变酶的半衰期(t1/2)[18]。
2 结果与分析
2.1 确定最佳去N-糖基化方式
前期研究结果表明,在单点突变中,N128Q的比酶活明显下降,N185Q则显著提高,半衰期几乎均没有变化,N353Q的比酶活上升,稳定性却大大降低[8],即353位点的N-糖基化对PGL的影响具有两面性,并直接导致了组合突变株GS115/N185Q-N353的酶活高而热稳定性差。由此,我们将353位点的N-糖基化确立为第一种策略的实施对象。利用Discovery Studio 2017软件对1BN8的353和355位点分别进行氨基酸稳定性突变分析,结果如表2和表3所示。异亮氨酸和色氨酸在这两个位点的突变能最低,依据突变能最低原则,确定了N353I和T355W两个较优突变来去除353位点的N-糖基化。
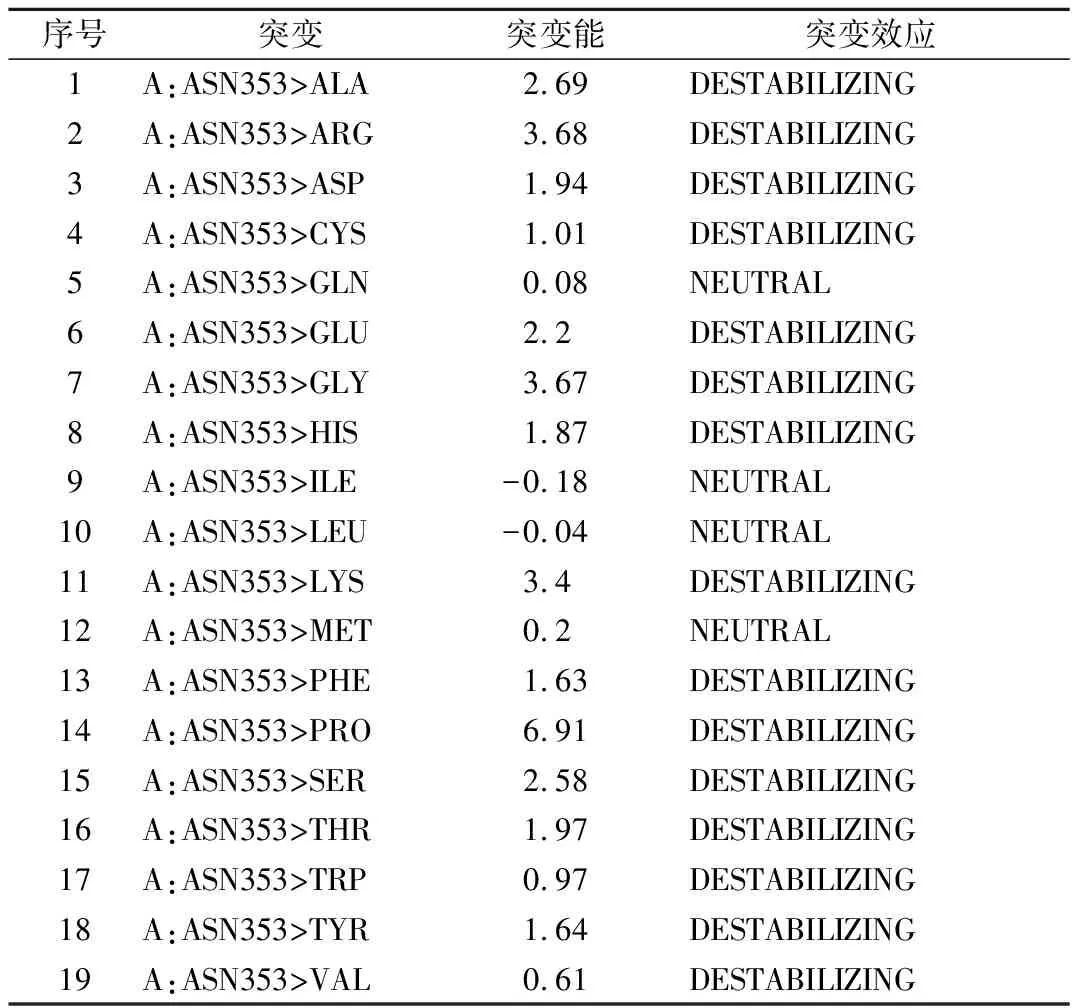
表2 ASN353的氨基酸稳定性突变结果Table 2 The result of amino acid stability mutation at ASN353
2.2 新N-糖基化位点的设计
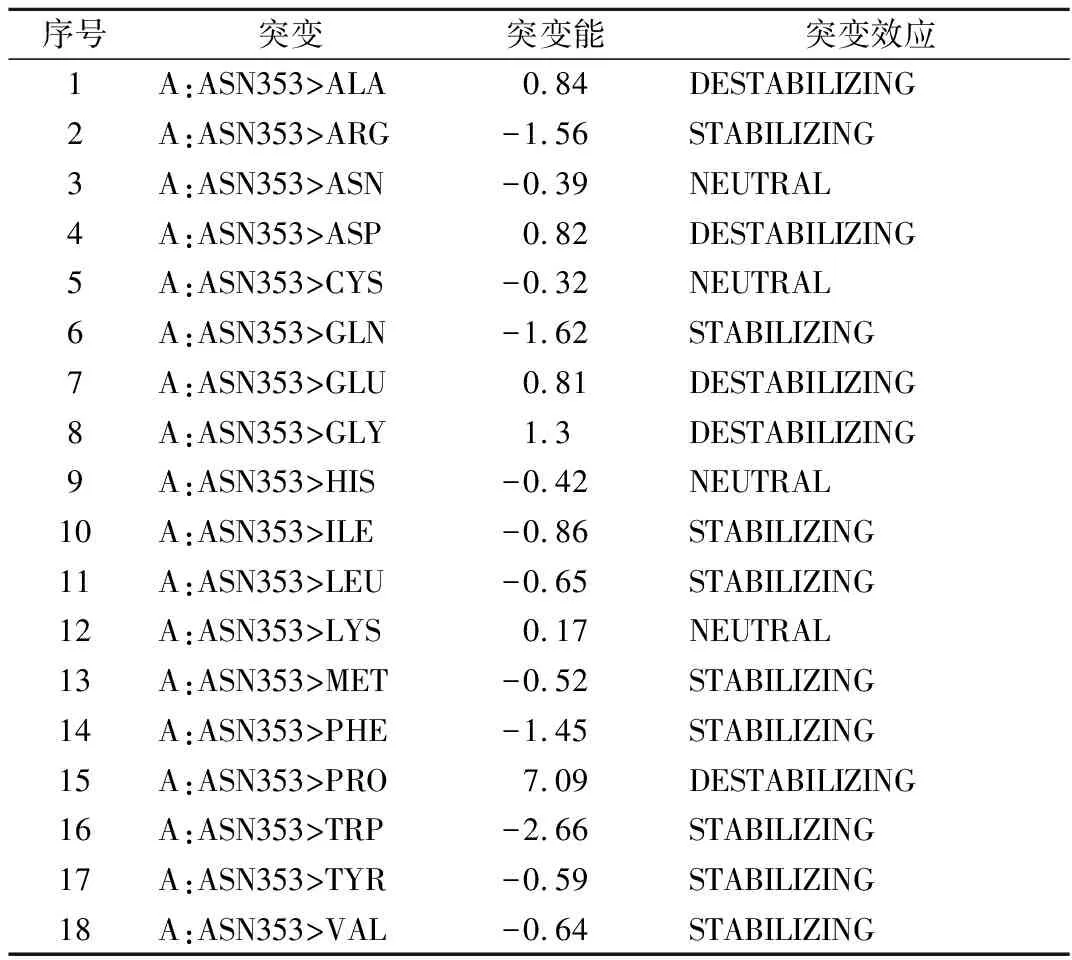
表3 THR355位点的氨基酸稳定性突变结果Table 3 The result of amino acid stability mutation atTHR355
文献报道,PGL发生催化作用需结合3个Ca2+作为媒介,而这3个Ca2+与酶的结合是由ASP184、ASP223、ASP227、ASN173、ASN180、Lys247、Arg279等支撑的,这些氨基酸即为PGL的关键氨基酸,对PGL进行N-糖基化改造时不能改变这些氨基酸或破坏其周围结构[17]。在此前提下,对1BN8进行结构分析,确定与文献描述相符合的反向转角区,以改变最少氨基酸为原则,对这些反向转角区进行筛选,最终锁定了3个合适的位点(128、137和341)引入具有EAS特征的新N-糖基化,突变分别为A127F、S134F-K139T和G341N。在这里需说明的是,128位点作为原始的N-糖基化位点,鉴于其对酶活的重要影响且周围结构符合反向转角特征,也被列入改造范围。它们的具体突变情况及在PGL中的局部形态结构和分布如表4、图1和图2。由图可看出,这3个序列符合改造成稳定模块的条件[13-14],此外,它们都位于蛋白质三维结构的表面,不会对PGL的关键氨基酸造成干扰或对活性中心产生空间位阻,进一步证明突变的的可行性。

表4 突变序列Table 4 Mutation sequences
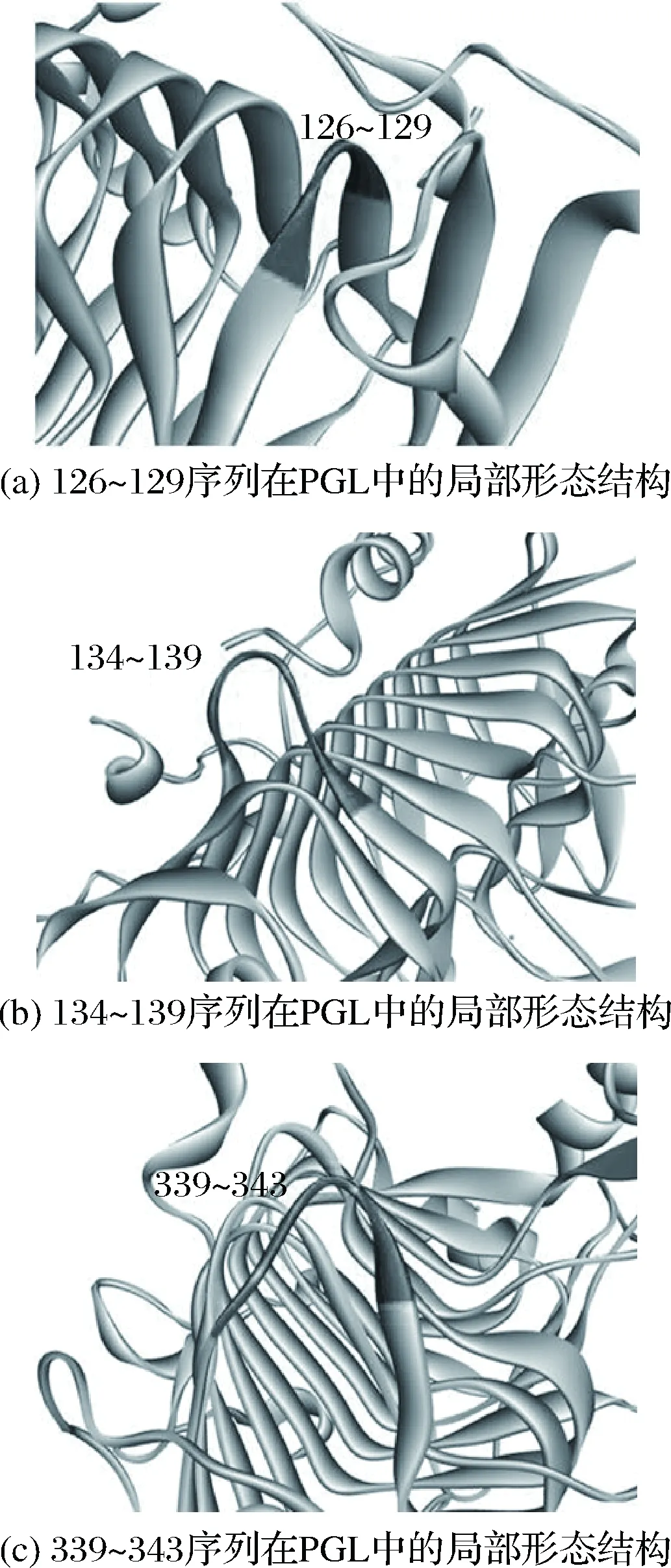
图1 三个待突变序列在PGL中的局部形态结构Fig.1 The local structure of three to-be-mutated sequences in PGL
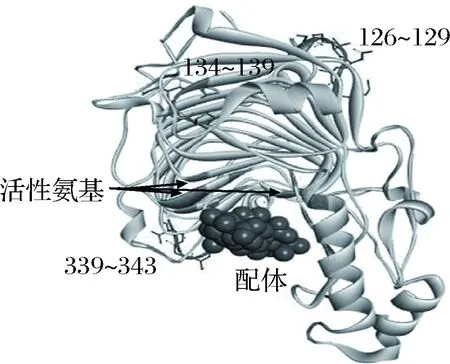
图2 三个待突变序列在PGL三维结构中的位置分布Fig.2 The distribution of three to-be-mutated sequences in the three-dimensional structure of PGL
2.3 突变酶的诱导表达
将各重组子接入摇瓶中发酵,诱导表达96 h后离心取上清液进行SDS-PAGE分析(图3)。由图3可以看出,重组子均可表达相应的突变酶,但表达量不尽相同。PGL的理论分子量为43.5 kDa,在毕赤酵母中表达的实际分子量会随N-糖基化程度的增加而增加,各突变酶条带的相对位置与其预测分子量大小相符合,说明定点突变方法成功实现了新N-糖基化的引入。对上清液进行粗酶活测定,结果显示,除N185Q-T355W-G341N、N185Q-T355W-A127F-G341N、N185Q-T355W-S134F-K139T-G341N和N185Q-T355W- A127F-S134F-K139T-G341N这4个突变酶的粗酶活较N185Q-N353Q有所下降外,其他突变酶的粗酶活并无明显变化。
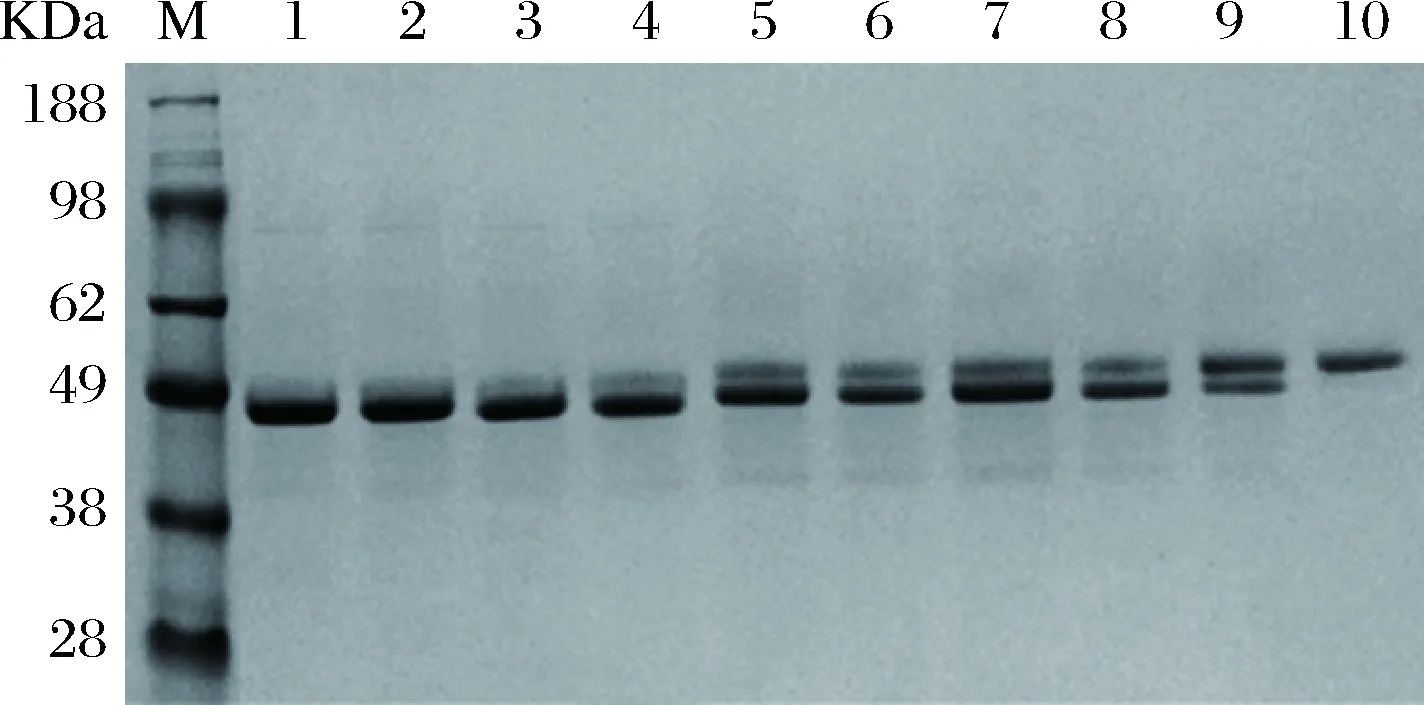
M-protein marker; 1-N185Q- N353Q; 2-N185Q-N353I; 3-N185Q-T355W; 4-N185Q-T355W-A127F; 5-N185Q-T355W-S134F-K139T;6-N185Q-T355W-G341N; 7-N185Q-T355W-A127F-S134F-K139T;8-N185Q-T355W-A127F-G341N;9-N185Q-T355W-S134F-K139T-G341N;10-N185Q-T355W-A127F-S134F-K139T-G341N图3 SDS-PAGE电泳分析Fig.3 SDS-PAGE analysis
2.4 突变酶的催化性质检测
为了验证PGL经N-糖基化改造后其催化性质是否受到影响,将各突变酶样品纯化,并对其比酶活和反应动力学常数进行测定。结果如表4所示:第一阶段改造中,突变酶N185Q-N353I和N185Q-T355W的比酶活几乎没有变化;第二阶段改造中,突变酶N185Q-T355W-A127F的比酶活略有上升,而突变酶N185Q-T355W-S134F-K139T和N185Q-T355W-G341N 的比酶活均有所下降,后者更为突出;在组合突变中,突变酶N185Q-T355W-A127F-S134F-K139T仍显示较N185Q-N353Q高的比酶活,而包含G341N突变酶的比酶活均显著降低。此外,N-糖基化改造也影响了PGL的底物亲和力,除137位点外,其他位点引入新N-糖基化均导致了底物亲和力的下降。
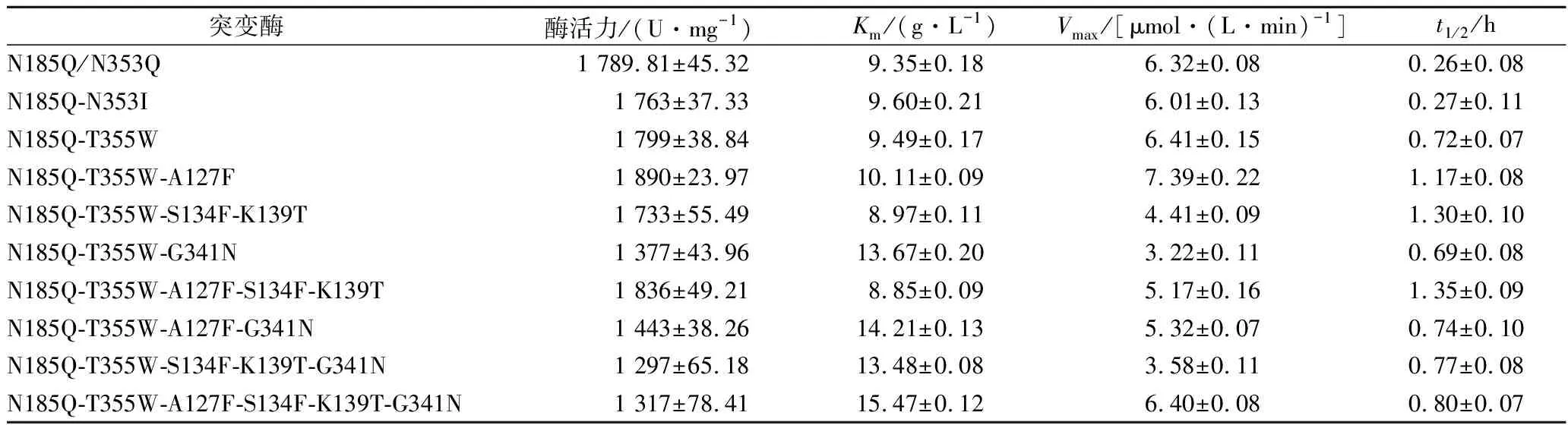
表4 突变酶的酶学性质Table 4 The enzymatic properties of mutant enzymes
2.5 突变酶的热稳定性检测
为了考察N-糖基化改造对PGL热稳定性的作用,对纯化后的各突变酶样品进行半衰期测定。结果(表4)显示:与N185Q-N353Q相比,突变酶N185Q-N353I的半衰期几乎没有改变,而突变酶N185Q-T355W有明显提高,提高了177%;在此基础上,通过在 128和137位点插入新N-糖基化使得突变酶的半衰期进一步提升,而在341位点插入新N-糖基化几乎未产生作用;对128和137位点进行组合突变,使得突变酶N185Q-T355W-A127F-S134F-K139T的半衰期再获提升,达1.35 h,与PGL在毕赤酵母中表达的原始半衰期值1.42 h接近,而包含G341N 的组合突变酶均没有在热稳定性上有所突破。
3 讨论
在第一阶段的改造中,我们根据Discovery Studio 2017的氨基酸稳定性突变结果将353位点的天冬酰胺和355位点苏氨酸分别突变成突变能低的异亮氨酸和色氨酸,这两种方式同样能去除353位点的N-糖基化,且相比直接将353位点的天冬酰胺突变成谷氨酰胺的方法更具理论说服力。然而,经过一系列的构建、表达和检测,发现只有突变酶N185Q-T355W在热稳定上有所改善,突变酶N185Q-N353I的热稳定性相比N185Q-N353Q几乎没有改变。这样的结果其实是符合预期的,因为在353位点的氨基酸稳定性突变结果中没有稳定性突变,虽然异亮氨酸的突变能相对谷氨酰胺更低,但它们同属于中性突变,而在353位点的氨基酸稳定性突变结果中有稳定性突变,故突变酶N185Q-T355W的热稳定性结果较理想。
对于新N-糖基化的引入,不同位点显示了不同影响。128和134位点的N-糖基化使PGL的热稳定性相较N185Q-N353Q得到显著提高,此外,128位点的N-糖基化还对酶活产生了积极影响,而134位点的N-糖基化使酶活略有下降,但影响较小几乎可以忽略;在341位点引入N-糖基化,不仅没有使热稳定性上升,反而使酶活也下降了。原因推测:128和134位点的新N-糖基化非常符合EAS的序列特征和反向转角区的结构特征,它们能提高PGL的热稳定性符合预期。此外,128位点原先就是N-糖基化位点,前期实验结果也表明,该位点的N-糖基化对PGL的催化活力有重要促进作用[8]。通过将128位点的N-糖基化改造成具有EAS特征的新N-糖基化,增强了这个位点的N-糖基化效率[19-20],这解释了为什么突变酶N185Q-T355W-A127F的比酶活会有所提高。341位点的N-糖基化不仅没有提升PGL的热稳定性反而严重降低了其比酶活,通过观察这个位点在PGL三维结构中的位置,发现341位点相比128和137位点距离PGL的活性中心近很多,虽然不至于影响PGL与其底物的结合,但可能会破坏关键氨基酸的周围作用力和区域结构,从而影响PGL的催化活力。
总之,本研究通过氨基酸稳定性突变和引入新N-糖基化的综合策略在N185Q-N353Q的基础上获得了热稳定性大大提高的突变酶N185Q-T355W-A127F-S134F-K139T,其半衰期达到1.35 h,几乎回复至原始值1.42 h,实现了 PGL 在毕赤酵母中的进一步改造,证明了在酶的反向转角区引入具有EAS特征的新N-糖基化对提高其热稳定性有促进作用,但在设计突变之前必须对酶的结构和关键基团及其作用机理认识充分,避免不利突变。
[1] HOONDAL G S, TIWARI R P, TEWARI R, et al.Microbial alkaline pectinases and their industrial applications: a review [J].Appl Microbiol Biot, 2002, 59(4-5): 409-418.
[2] SHARMA D C, SATYANARAYANA T.A marked enhancement in the production of a highly alkaline and thermostable pectinase byBacilluspumilusdcsr1 in submerged fermentation by using statistical methods [J].Bioresource Technol, 2006, 97(5): 727-733.
[3] LIU Y H, CHEN G Q, WANG J L, et al.Efficient expression of an alkaline pectate lyase gene fromBacillussubtilisand the characterization of the recombinant protein [J].Biotechnology letters, 2012, 34(1): 109-115.
[4] BIN Z, DU G C, WEI S, et al.Expression of aBacillussubtilispectate lyase gene inPichiapastoris[J].Biochem Eng J, 2008, 40(1): 92-98.
[5] WANG H, LI J, LIU L, et al.Increased production of alkaline polygalacturonate lyase in the recombinantPichiapastorisby controlling cell concentration during continuous culture [J].Bioresour Technol, 2012, 124(1): 338-346.
[6] LI X, WANG H, ZHOU C, et al.Cloning, expression and characterization of a pectate lyase fromPaenibacillussp.0602 in recombinantEscherichiacoli[J].BMC Biotechnology, 2014, 14(1): 1-12.
[7] POTVIN G, AHMAD A, ZHANG Z S.Bioprocess engineering aspects of heterologous protein production inPichiapastoris: A review [J].Biochem Eng J, 2012, 64(19): 91-105.
[8] 陈双全.碱性果胶酶高效表达与发酵优化[D].无锡:江南大学,2016.
[9] GUO C, LIU Y, YU H, et al.A novel strategy for thermostability improvement of trypsin based onN-glycosylation within the omega-loop region [J].Journal of microbiology and Biotechnology, 2016, 26(7): 1 163-1 172.
[10] YAO M Z, WANG X, WANG W, et al.Improving the thermostability ofEscherichiacoliphytase,appA, by enhancement of glycosylation [J].Biotechnology Letters, 2013, 35(10): 1 669-1 676.
[11] PRICE J L, SHENTAL-BECHOR D, DHAR A, et al.Correction to context-dependent effects of asparagine glycosylation on pin WW folding kinetics and thermodynamics [J].Journal of the American Chemical Society, 2012, 134(9):4 450-4 451.
[12] CHEN W, KONG L, CONNELLY S, et al.Stabilizing the CH2 domain of an antibody by engineering in an enhanced aromatic sequon [J].ACS Chemical Biology, 2016, 11(7): 1 852-1 861.
[13] PRICE J L, CULYBA E K, CHEN W T, et al.N-glycosylation of enhanced aromatic sequons to increase glycoprotein stability [J].Biopolymers, 2012, 98(3): 195-211.
[14] PRICE J L, POWERS D L, POWERS E T, et al.Glycosylation of the enhanced aromatic sequon is similarly stabilizing in three distinct reverse turn contexts [J].Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(34): 14 127-14 132.
[15] CULYBA E K, PRICE J L, HANSON S R, et al.Protein native-state stabilization by placing aromatic side chains inN-glycosylated reverse turns [J].Science, 2011, 331(6017): 571-575.
[16] PICKERSGILL R, JENKINS J, HARRIS G, et al.The structure ofBacillussubtilispectate lyase in complex with calcium [J].Nature Structural Biology, 1994, 1(10): 717-723.
[17] SEYEDARABI A, TO T T, ALI S, et al.Structural insights into substrate specificity and the anti beta-elimination mechanism of pectate lyase [J].Biochemistry-Us, 2010, 49(3): 539-546.
[18] XU Z, LIU S, LU X, et al.Thermal inactivation of a recombinant lipoxygenase fromPseudomonasaeruginosaBBE in the absence and presence of additives [J].J Sci Food Agric, 2014, 94(9): 1 753-1 757.
[19] AGUILA S, MARTINEZ-MARTINEZ I, DICHIARA G, et al.IncreasedN-glycosylation efficiency by generation of an aromatic sequon on N135 of antithrombin [J].Plos One, 2014, 9(12):e114454.
[20] MURRAY A N, CHEN W, ANTONOPOULOS A, et al.Enhanced aromatic sequons increase oligosaccharyltransferase glycosylation efficiency and glycan homogeneity [J].Chemistry & Biology, 2015, 22(8): 1 052-1 062.
