尾加压素Ⅱ对大鼠平滑肌细胞生存率的影响
2018-06-14马小青兰祖湧王晓坤汪晨净
马小青,兰祖湧,王晓坤,孙 枫,汪晨净
(西北民族大学 医学院,甘肃 兰州 730030)
动脉粥样硬化(atherosclerosis,AS)是冠心病、脑梗死、高血压等许多缺血性心脑血管疾病的主要病理基础[1].血管炎症反应、血管平滑肌细胞(vascular smooth muscle cell,VSMC)迁移、增殖及粥样斑块形成均是 AS 过程中的重要病理环节,并已成为防治AS的关键靶点[2].有关 VSMC 迁移、增殖的研究资料表明,在心血管疾病危险因素损伤血管内皮功能的始动因素下,VSMC由分化状态转变为去分化状态,并从中膜迁移至内膜;同时,一些血管活性物质或细胞因子大量合成、释放,并作用于VSMC膜受体,调控细胞内信号传导通路,最终导致核内基因表达,促使迁移至内膜的VSMC DNA合成,细胞分裂、过度增殖的病理过程正是AS 及其相关性心脑血管疾病中血管壁纤维性斑块形成、管壁增厚的主要原因[3].因此,调控VSMC 增殖及VSMC两种表型之间的相互转化的研究引起了人们的广泛关注.
尾加压素II (utrotensin II)是从鱼脊髓尾垂体中分离出的一种多肽,广泛分布于哺乳动物和人的中枢神经系统及心血管组织,是目前已知人体内最强的缩血管物质[4].已有研究表明:UII 强效的缩血管作用、致炎作用、促 VSMC 迁移、增殖及血管重塑等作用在 AS 进程中发挥着重要作用,其机制多与Rho相关激酶、丝裂原活化蛋白激酶等信号通路激活有关.Maguire等研究表明[5]:UII不仅对粥样硬化病变的血管起收缩作用,同时也能加重动脉损伤.Watanabe等的研究发现[6]:UII 能促进 VSMC 增殖,并直接或间接的参与了AS 的发生和发展.在上述研究基础上,本文采用 MTT 法观察不同浓度UII 刺激培养 VSMC 不同时间对 VSMC 生存率的影响,以进一步证实 UII 对 VSMC 的促生长作用.同时,观察UII 影响培养 VSMC 生存率过程中,对VSMC 中活性氧生成的影响,以探讨活性氧通路在UII 促 VSMC 增殖过程中的调控作用.
1 材料
1.1 动物
健康雄性Sprague-Dawley(SD)大鼠,3~4月龄,200~250 g .
1.2 药品及试剂
UII(Sigma);DMEM(Gibco);胎牛血清(Hyclone);噻唑蓝(MTT);二甲基亚砜;荧光探针2',7'-二氯二氢荧光素二乙酯.
1.3 主要仪器
CO2培养箱;Olympus相差显著镜、荧光显微镜;Bio-Rad 680酶标仪.
2 方法
2.1 VSMC培养
用0.3 %的戊巴比妥麻醉大鼠,无菌条件下迅速取出主动脉胸段,放入预冷的PBS液移入超净台,洗涤3次,仔细剥去外膜,眼科剪纵轴剖开,轻轻刮去内膜,然后移入另一盛有含20 %胎牛血清的DMEM培养皿剪碎,移入培养瓶中,均匀种植于培养瓶壁,置37 ℃孵箱中,4 h后加含有20%FBS的DMEM,使组织块完全浸泡在培养液中.放入培养箱(37 ℃,5 % CO2),4~6 d后可见梭形细胞从组织块周围爬出,此后每3~5 d换液一次,至单层细胞铺满培养瓶近80 %以上时采用酶消化法进行传代.实验采用3~8代细胞.
2.2 VSMC鉴定
相差显微镜下,VSMC 初期呈典型梭形细胞,随细胞增殖到一定时期呈“谷”和“峰”状.利用肌动蛋白(α-actin)免疫细胞化学染色对培养细胞进行鉴定.
2.3 MTT法测定 VSMC 生存率
2.3.1 MTT 溶液的配置
用5 mL PBS溶解25 mgMTT,配制成5 mg/mL的MTT溶液,并于-20 ℃避光保存.
2.3.2 MTT实验
接种于96 孔板中生长面积达70 %的VSMC,以不同浓度的UII(10-10,10-9,10-8,10-7,10-6mol/L)分别刺激0 h,24 h,48 h,72 h后做 MTT实验,测定吸光度(吸光度和细胞生存活力呈正相关).每孔加20 μlMTT溶液,在细胞培养箱内继续孵育4 h后;每孔加150 μL二甲基亚砜,震荡混匀后,在490 nm波长处测定吸光度.
2.4 活性氧含量测定
2.4.1 DCFH-DA的配置
按1∶1000 用DMEM 稀释DCFH-DA,使其终浓度为10-5M.
2.4.2 VSMC产生活性氧含量的检测
1)去除细胞培养液,加入适当体积稀释好的DCFH-DA.加入的体积以能充分盖住细胞为宜,24 孔板每孔约400 μL.
2)37 ℃细胞培养箱内孵育20 min.
3)DMEM洗涤3~5次,以充分去除未进入细胞内的DCFH-DA.
4)UⅡ(10-6 M)孵育20 min.
5)荧光显微镜下直接观察并拍照(使用488 nm激发波长,525 nm发射波长).每一个处理因素分别选择不同的5个视野,每个视野包含有15~25个细胞.
2.5 统计学处理
所得数据以均数±标准差表示.所得数据均用SPSS 10.0统计学软件进行处理,组间差异比较采集用t检验,P<0.05认为差异有显著性.
3 结果
3.1 VSMC的鉴定及纯度
相差显微镜下,培养一周时可见少量细胞自组织块周围游出,细胞呈梭形.培养三周左右局部成束的细胞平行排列,部分细胞多层重叠,呈典型高低起伏的“谷”和“峰”状(图1-a).第三代平滑肌细胞肌动蛋白免疫组化染色,大于99%的细胞染色阳性,即胞浆呈灰白反应,胞核呈黑灰色反应(图1-b).

(a)相差显微镜下第3代平滑肌细胞(×100);(b)大鼠血管平滑肌细胞 α-actin 免疫细胞化学染色(× 400).
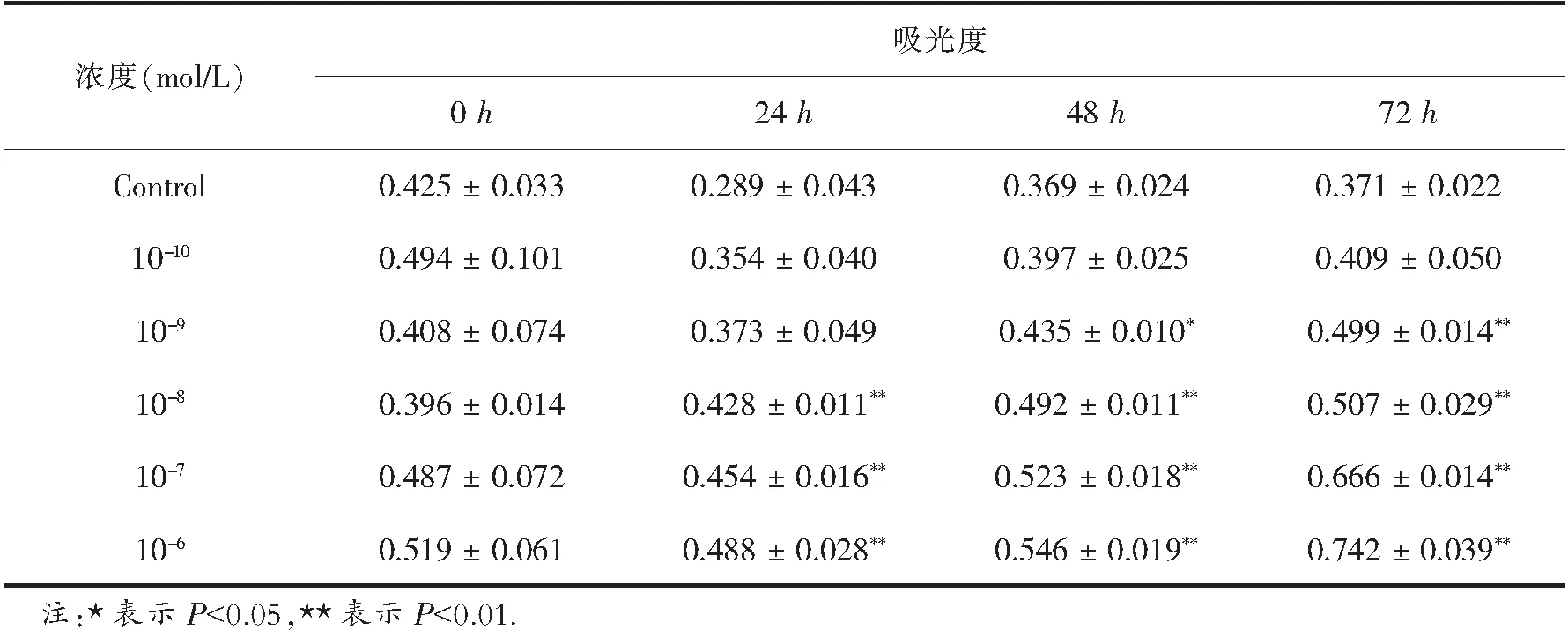
3.2 不同浓度UII刺激
MTT 法检测 VSMC 生存率结果表明(表1),UII (10-10,10-9,10-8,10-7,10-6mol/L)刺激 VSMC 不同时间(0 h,24 h,48 h,72 h),VSMC 吸光度(吸光度和细胞生存活力成正相关)随UII 刺激浓度的增加和作用时间的延长呈升高趋势.其中,10-9mol/L UII 刺激VSMC (48 h,72 h)及(10-8,10-7,10-6mol/L)UII 刺激 VSMC (24 h,48 h,72 h),VSMC吸光度较control 组比较明显升高,差异有显著性(P<0.05,P<0.01),提示(10-9,10-8,10-7,10-6mol/L)UII 可促进 VSMC 的生长、增殖.

3.3 不同浓度 UII 对 VSMC活性氧生成的影响
荧光探针标记检测结果表明(图2),(10-10,10-9,10-8,10-7,10-6mol/L)UII刺激VSMC 后,VSMC中活性氧含量随UII刺激浓度升高呈增高趋势,其中(10-8,10-7,10-6mol/L)UII刺激组 VSMC活性氧产生的增加较明显,提示UII可诱导VSMC产生活性氧.
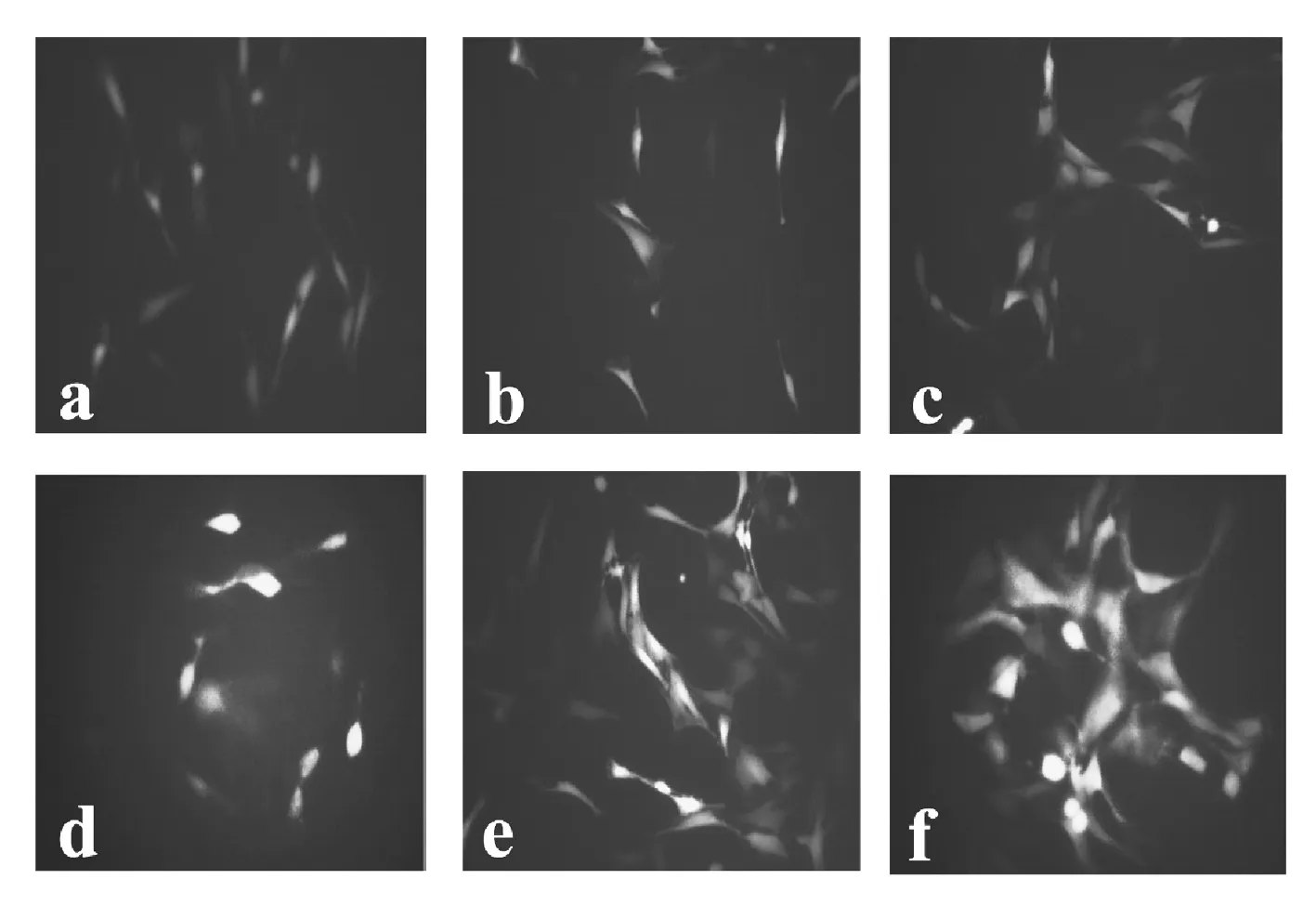
(a)Control;(b)10-10UII;(c)10-9UII;(d)10-8UII;(e)10-7UII;(f)10-6UII;
4 讨论
研究表明[7,8]:强效缩血管活性肽UII的促 VSMC 增殖作用在AS的发生、发展过程中起着重要作用.因此,深入探讨UII对VSMC 的增殖作用及其机制对 AS 相关性心脑血管疾病的防治显得尤为重要.本文中我们用 MTT的实验证实大鼠胸主动脉平滑肌细胞生存率随UII刺激浓度的升高及作用时间的延长而升高,进一步说明了UII对 VSMC 的促增殖作用.同时,荧光探针实验证实在UII提高 VSMC生存率的相同刺激浓度下,UII可增加 VSMC中活性氧的产生,说明活性氧及其相关信号转导通路可能参与了UII提高 VSMC 生存率、促 VSMC增殖作用,进而继发 AS中的血管病理变化过程.这一研究结果可进一步充实血管活性物质促 VSMC增殖效应在 AS发病机制中作用研究的相关理论,而UII提高 VMSC生存率的活性氧通路及其他信号转导通路的调控机制函有待于进一步深入研究.
[1] 刘俊田. 动脉粥样硬化发病的炎症机制的研究进展[J]. 西安交通大学学报(医学版),2015,36(02): 141-152.
[2] 罗寅,马占龙. 血管平滑肌细胞在动脉粥样硬化病变中作用的研究进展[J]. 陕西医学杂志,2012,41(03): 360-361.
[3] 任瑞军,葛志平,陈晓春. 血管平滑肌细胞与动脉粥样硬化关系研究进展[J]. 内蒙古医学杂志,2009,41(12): 1469-1472.
[4] 王慧卿,周兴建,蒋绿芝. 尾加压素Ⅱ临床研究的进展[J]. 国外医学(内科学分册),2006(10): 418-420.
[5] Maguire JJ,Kuc RE,Wiley KE,etal. Cellular distribution of immunoreactive urotensin II in human tissues with evidence of increased expression in atherosclerosis and a greaterconstrictor response of small compared to large coronary arteries[J]. Peptides,2004,25(10): 1767-1774.
[6] Watanabe T,Pakala R,Katagiri T,etal. Synergistic effect of urotensin II with mildly oxidized LDL on DNA synthesis in vascular smooth muscle cells[J].Circulation,2001,104(1): 16-18.
[7] Tsai CS,Loh SH,Liu JC,etal. Urotensin II-induced endothelin-1 expression and cell proliferation via epidermal growth factor receptor transactivation in rat aortic smooth muscle cells[J]. Atherosclerosis,2009,206(1):86-94.
[8] Zhang YG,Kuang ZJ,Mao YY,etal.Osteopontin is involved in urotensin II-induced migration of rat aortic adventitial fibroblasts[J].Peptides,2011,32(12):2452-2458.
