2009年1月-2017年6月我院肠球菌的临床分布及耐药性分析Δ
2018-06-14郑巧伟任晓东秦涛罗赛赛封卫毅魏友霞西安交通大学第一附属医院药学部西安710061
郑巧伟,任晓东,秦涛,罗赛赛,封卫毅,魏友霞(西安交通大学第一附属医院药学部,西安710061)
肠球菌广泛分布于自然环境、人类及动物消化道中,是医院感染的主要病原菌之一[1]。美国医院感染监测系统已将肠球菌列为医院感染的第二大病原菌[2]。近年来,随着抗菌药物的普遍使用,临床不断出现耐万古霉素的肠球菌感染[3-5]。2005-2014年,全国19所三级甲等医院肠球菌检出率为7.0%~9.1%,其中有1所医院检出率高达13.7%,有2所医院耐万古霉素屎肠球菌检出率由2005年的0.8%上升至2014年的10.7%[2],给临床治疗带来了严峻挑战。因此,长期动态监测肠球菌的耐药性,对指导临床合理使用抗菌药物具有重要意义。为此,笔者通过收集我院2009年1月-2017年6月临床分离的肠球菌病原学资料,回顾性分析其耐药性变迁及相关危险因素,以期为临床治疗及控制医院感染提供参考。
1 资料与方法
1.1 菌株来源
收集我院2009年1月-2017年6月住院患者临床分离的肠球菌,剔除同一患者同一部位检出的重复菌株。
1.2 材料与仪器
Phonenin-100型全自动微生物分析仪(美国BD公司);M-H琼脂平板(法国生物梅里埃公司);药敏纸片(英国Oxoid公司);质控菌株粪肠球菌(ATCC 29212)(中国食品药品检定研究院)。
1.3 菌株分离、鉴定和药敏试验
采用全自动微生物分析仪进行菌株鉴定与药敏试验。万古霉素、替考拉宁、利奈唑胺采用纸片扩散(Kirby-Bauer,K-B)法进行药敏试验;其他药物采用全自动微生物分析仪进行药敏试验。药敏试验判定参照美国临床与实验室标准化协会(CLSI)规定的标准[5]。
1.4 数据处理
采用WHONET 5.6软件分析药敏试验数据。
1.5 相关性分析
采用SPSS 19.0统计软件,以Pearson相关性分析患者入住重症加强护理病房(ICU)天数、气管切开或插管情况、抗菌药物使用天数及种类、糖皮质激素使用情况、碳青霉烯类抗菌药物使用天数等危险因素与耐万古霉素肠球菌感染率的相关性。
2 结果
2.1 肠球菌检出情况
2009年1月-2017年6月我院共检出肠球菌6 252株。其中有51例患者检出耐万古霉素屎肠球菌(43株)和耐万古霉素粪肠球菌(8株)。
2.2 肠球菌检出率
2009年1月-2017年6月我院肠球菌检出率呈波动上升趋势,详见表1。
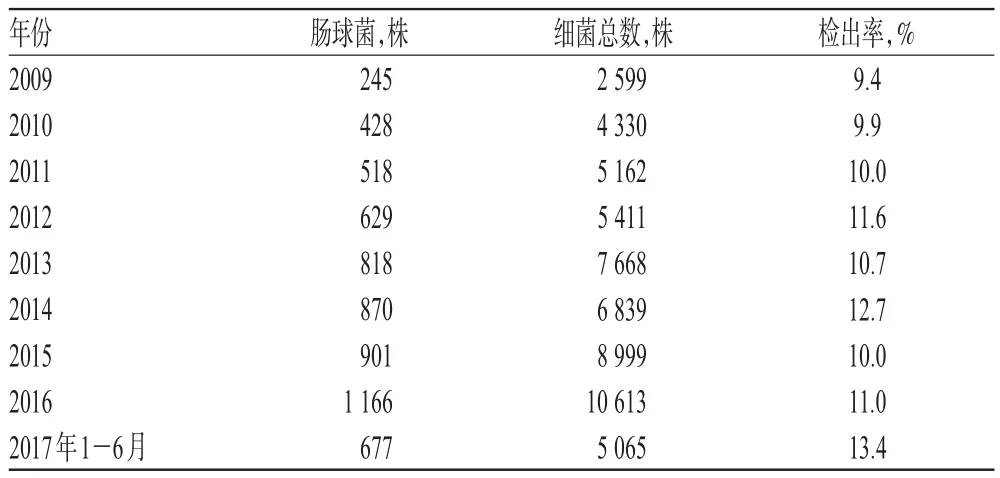
表1 肠球菌检出率Tab 1 Detection rate of Enterococcus
2.3 肠球菌的种类与标本分布
2009年1月-2017年6月我院检出肠球菌以粪肠球菌(Enterococcus faecalis,1 994株)、屎肠球菌(E.faecium,3 575株)、鹑鸡肠球菌(E.gallinarum,262株)、铅黄肠球菌(E.casseliflavus,164株)、鸟肠球菌(E.avium,157株)为主。分离标本分布主要为尿液2 009株、引流液1 538株、胆汁1 168株、伤口分泌物561株、血液493株,详见表2。上升趋势。屎肠球菌对利奈唑胺耐药率从2009年的1.9%下降至2017年1-6月的0.2%;对万古霉素、替考拉宁耐药率持续波动,但仍处于较低水平;对四环素耐药率呈下降趋势,而对高浓度庆大霉素耐药率呈上升趋势,详见表4。

表2 肠球菌的种类与标本分布(株)Tab 2 Types and species distribution of Enterococcus(strain)
2.4 主要肠球菌对抗菌药物的平均耐药率和敏感率
2009年1月-2017年6月我院主要肠球菌对抗菌药物的平均耐药率和敏感率变迁情况详见表3(表中,“R”为耐药率,“S”为敏感率,“/”为未检测,下表同;中介菌株未纳入统计)。

表3 主要肠球菌对抗菌药物的平均耐药率和敏感率Tab 3 Average resistant rate and susceptibility rate of main Enterococcus species to antibiotics
2.5 粪肠球菌和屎肠球菌对抗菌药物的耐药率
粪肠球菌对氨苄西林、青霉素、万古霉素耐药率呈波动下降趋势,且对万古霉素、利奈唑胺、替考拉宁和替加环素的耐药率较低;对环丙沙星、莫西沙星、左氧氟沙星耐药率波动下降至2014年,后于2015年开始呈波动

表4 粪肠球菌和屎肠球菌对抗菌药物的耐药率(%%)Tab 4 Resistance rate of E.faecalis and E.faecium to antibiotics(%%)
2.6 耐万古霉素粪肠球菌和耐万古霉素屎肠球菌对抗菌药物的耐药率和敏感率
耐万古霉素粪肠球菌和耐万古霉素屎肠球菌主要分布于肝胆外科(15/51)和ICU(14/51)。药敏试验结果显示,耐万古霉素屎肠球菌对利奈唑胺、替加环素、替考拉宁的耐药率分别为23.3%、0、35.3%,而耐万古霉素粪肠球菌对利奈唑胺、替加环素、替考拉宁的耐药率均为0,详见表5(中介菌株未纳入统计)。

表5 耐万古霉素粪肠球菌和耐万古霉素屎肠球菌对抗菌药物的耐药率和敏感率Tab 5 Resistant rate and susceptibility rate of vancomycin-resistant E.faecalis and E.faecium to antibiotics
2.7 耐万古霉素粪肠球菌和耐万古霉素屎肠球菌感染率的相关危险因素
Pearson相关性分析显示,患者入住ICU天数(r=0.225,P<0.01)、气管切开或插管率(r=0.314,P<0.01)、抗菌药物使用天数(r=0.347,P<0.01)、抗菌药物使用种类(r=0.226,P<0.01)、使用了糖皮质激素(r=0.190,P<0.01)、碳青霉烯类抗菌药物使用天数(r=0.173,P<0.05)均与耐万古霉素粪肠球菌和耐万古霉素屎肠球菌感染率呈正相关。
3 讨论
肠球菌是常见的医院感染致病菌,近年来其感染发生率和耐药率日益升高。在美国,肠球菌引起的感染占所有医院感染原因的12%;其中,粪肠球菌和屎肠球菌为主要病原菌,分别占6.8%和4.1%[6-7]。肠球菌可引起尿路感染、血流感染、感染性心内膜炎等多种疾病,其中血流感染病死率高达43%[6-8]。2005-2014年,中国CHINET对全国19所三级甲等医院肠球菌的耐药监测结果显示,肠球菌检出率低于10%,其中粪肠球菌与屎肠球菌的分离率接近,分别占肠球菌的47.3%和43.5%[1]。本研究结果显示,肠球菌检出率从2009年的9.4%上升至2017年6月的13.4%,略高于上述19所医院的平均水平(8.73%)[1];屎肠球菌分离率(57.2%,3 575/6 252)显著高于粪肠球菌(31.9%,1 994/6 252),但伤口分泌物标本中以粪肠球菌(283株)多见,提示医院应重视肠球菌引起的医院感染,加强多部门多学科的相互协作,做好医院感染控制。
有文献报道,在引起医院感染的肠球菌中,肠球菌的检出率不断增高,其中分离出的菌株约18%~50%对万古霉素耐药,对青霉素的耐药率高达97%,对高浓度庆大霉素的耐药率达52.1%,对高浓度链霉素的耐药率达58.3%,给临床治疗带来巨大困难[1-2,7]。在欧洲,肠球菌感染的检出率己达到8.5%~12.5%[9];在美国,肠球菌对万古霉素的耐药率从1989年的0.3%~0.4%增长到2013年的30.30%[10]。2015年一项多中心研究提示,我国西南地区肠球菌感染的检出率为9.74%,相比2011年的3.85%已明显上升[11],肠球菌感染已成为威胁人类生命安全的严重问题。本研究结果显示,2009年-2017年6月我院共检出肠球菌6 252株,其中耐万古霉素粪肠球菌8株、耐万古霉素屎肠球菌43株,远低于欧美国家耐万古霉素肠球菌的检出水平[9-10]。药敏试验结果显示,耐万古霉素屎肠球菌对利奈唑胺、替加环素、替考拉宁的耐药率分别为23.3%、0、35.3%,而耐万古霉素粪肠球菌对利奈唑胺、替加环素、替考拉宁均未见耐药菌株,提示临床抗菌药物使用比较合理。对于耐药肠球菌感染的治疗,需根据最新流行病学资料及细菌耐药特点来制订治疗方案,以控制耐药菌的增加,使肠球菌耐药情况得到有效控制。
目前认为,肠球菌感染可能的危险因素为患有严重基础疾病、长期住院、入住ICU、静脉置管、胸腹腔大手术后、有肠球菌定植者、接受广谱抗菌药物治疗、曾口服或静脉接受万古霉素治疗等[7,10]。Pearson相关性分析表明,患者治疗过程中采取的某些治疗措施(如气管切开或插管、碳青霉烯类抗菌药物、激素药物暴露)、住院天数及入住ICU的天数均与肠球菌引起的感染相关,与相关报道[5-6,8]一致。由于本研究纳入的样本量有限,肠球菌感染的相关因素未完全纳入,仅初步发现了肠球菌感染的一些相关因素,后续将增加样本量,通过多因素分析等方法,深入探讨肠球菌引起感染的相关危险因素。
随着抗菌药物的广泛使用,肠球菌感染率逐年增高,已成为医院感染的主要病原菌。因此,临床医师应重视肠球菌感染及药敏试验结果,制订合理的用药方案,加强耐药监测,有效预防和控制感染,以避免泛耐药菌株的暴发流行。
[1] 楚旭,毛剑锋,董华丽,等.2010-2014年肠球菌属临床分布与耐药性监控[J].中华医院感染学杂志,2016,26(19):4354-4357.
[2] 杨青,俞云林,林洁,等.2005-2014年CHINET肠球菌细菌耐药性监控[J].中国感染与化疗杂志,2016,16(2):146-152.
[3] RICHARDS MJ,EDWARDS JR,CULVER DH,et al.Nosocomial infections in combined medical-surgical intensive care units in the United States[J].Infect ControlHosp Epidemiol,2000,21(8):510-515.
[4] ESCAUT L,BOUAM S,FRANK-SOLTYSIAK M,et al.Eradication of an outbreak of vancomycin-resistant Enterococcus(VRE):the cost of a failure in the systematic screening[J].Antimicrob Resist Infect Control,2013,2(1):18.
[5] 黄益澄,吕火烊,王洪,等.耐万古霉素肠球菌的耐药性分析[J].中华医院感染学杂志,2014,24(9):2155-2157.
[6] HAYAKAWA K,MARTIN ET,GUDUR U M,et al.Impact of different antimicrobial therapies on clinical and fiscal outcomes of patients with bacteremia due to vancomycin-resistant enterococci[J].Antimicrob Agents Chemother,2014,58(7):3968-3975.
[7] WEINER LM,WEBB AK,LIMBAGO B,et al.Antimicrobial-resistant pathogens associated with healthcare-associated infections:summary of data reported to the national healthcare safety network at the centers for disease control and prevention,2011-2014[J].Infect Control Hosp Epidemiol,2016,37(11):1288-1301.
[8] DIAZGRANADOS CA,ZIMMER SM,KLEIN M,et al.Comparison of mortality associated with vancomycin-resistant and vancomycin-susceptible enterococcal bloodstream infection:a meta-analysis[J].Clin Infect Dis,2005,41(3):327-333.
[9] EMANEINI M,HOSSEINKHANI F,JABALAMELI F,et al.Prevalence of vancomycin-resistant Enterococcus in Iran:a systematic review and meta-analysis[J].Eur J Clin Microbiol Infect Dis,2016,35(9):1387-1392.
[10] BONTEN MJ,WILLEMS R,WEINSTEIN RA.Vancomycin-resistant enterococci: why are they here, and where do they come from?[J].Lancet Infect Dis,2001,1(5):314-325.
[11] 李六亿,陈美恋,吴安华,等.耐万古霉素肠球菌感染流行病学多中心研究[J].中国感染控制杂志,2015,14(8):518-524.
