FOXO3a与乳腺浸润性导管癌血管生成的相关性
2018-06-14常艳华梁加贝周志毅蔡颖
常艳华,梁加贝,周志毅,蔡颖
(南京医科大学附属无锡市人民医院 病理科,江苏 无锡 214023)
乳腺癌是威胁女性健康的常见恶性肿瘤,其发病率在全世界呈上升趋势。临床上治疗乳腺癌的常见方法是手术切除和辅助化疗,由于乳腺癌容易转移和复发,给治疗带来了巨大挑战。肿瘤的复发和转移是由多种复杂因素造成的,其中,肿瘤组织中新生血管数量的增加,为肿瘤组织的生长提供了必需的营养物质,使肿瘤得以快速生长,导致肿瘤易复发、易转移的重要因素之一。
FOXO3a是FOX蛋白家族的重要成员,在哺乳动物的多种器官的细胞中均有表达。有研究表明[1],FOXO3a转录因子可抑制血管内皮细胞的迁移及新生血管的形成。由此提出假设,FOXO3a可能抑制乳腺癌组织中新生血管形成,进而抑制肿瘤的生长。本研究通过检测乳腺癌组织中FOXO3a的表达,分析其亚细胞定位与肿瘤内微血管密度的关系,探讨其在乳腺癌新生血管形成中可能存在的作用和意义。
1 资料与方法
1.1 临床资料
选取2014年1月-2014年12月南京医科大学附属无锡市人民医院乳腺浸润性导管癌患者的癌组织(乳腺癌组)及相应癌旁>2 cm的组织(癌旁组)各102例。所有病例经病理证实,且术前均未接受过放疗、化疗及生物学治疗。
1.2 试剂
FOXO3a兔抗人单克隆抗体购自Cell Signaling Technology(CST,#12829,稀释度 1 :100),CD34 鼠抗人单克隆抗体购自福州迈新公司(MAB-0034),EnVision试剂盒和DAB显色剂购自福州迈新公司。
1.3 方法
石蜡包埋组织,4 μm厚切片,分别行HE染色和免疫组织化学(简称免疫组化)染色(采用EnVision两步法)。实验均设阳性对照和阴性对照。FOXO3a阳性定位于细胞核/质;CD34定位于血管内皮细胞的细胞膜/质,将CD34阳性的内皮细胞形成的管状、窄裂隙状、囊状和空泡状的结构,判定为可计数的微血管。微血管密度(microvessel density,MVD)计数采WEIDNER[2]的方法,先于低倍(100倍)光镜下确定至少5个脉管着色最密集的区域,然后在高倍(400倍)光镜下计数目标区域的微血管数,取计数最高的3个视野的均值作为该标本的MVD。
1.4 统计学方法
数据分析采用SPSS18.0统计软件,计量资料以均数±标准差(±s)表示;比较用t检验,计数资料以率(%)表示,比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 FOXO3a在乳腺癌组及癌旁组的表达
FOXO3a在乳腺癌组表达的总阳性率为70.59%(72/102),72例阳性病例中有7例仅细胞核阳性,56例仅细胞质阳性,9例细胞核与细胞质均阳性;癌旁组表达的总阳性率为84.31%(86/102),86例阳性病例中有71例仅细胞核阳性,3例仅细胞质阳性,12例细胞核与细胞质均阳性;乳腺癌组FOXO3a总阳性率低于癌旁组(χ2=5.501,P=0.019);乳腺癌组及癌旁组FOXO3a在细胞核表达的阳性率分别为15.69%(16/102)和81.37%(83/102),在细胞质表达的阳性率分别为63.73%(65/102)和14.71%(15/102);两组比较差异有统计学意义(χ2胞核=88.096,P=0.000;见图1 和附表。
2.2 两组MVD值及其与FOXO3a在乳腺癌组织中亚细胞定位的关系
两组MVD的水平分别为(27.46±5.87)和(17.25±3.61),差异有统计学意义(t=22.224,P=0.000)。见图2。乳腺癌组织中胞核FOXO3a阳性者MVD的水平(23.19±4.00)低于胞核FOXO3a阴性者(28.24±5.84)(t=3.314,P=0.001);而胞质FOXO3a阳性者MVD的水平(26.39±3.12)与FOXO3a阴性者(27.90±4.37)比较,差异无统计学意义(t=0.827,P=0.795)。
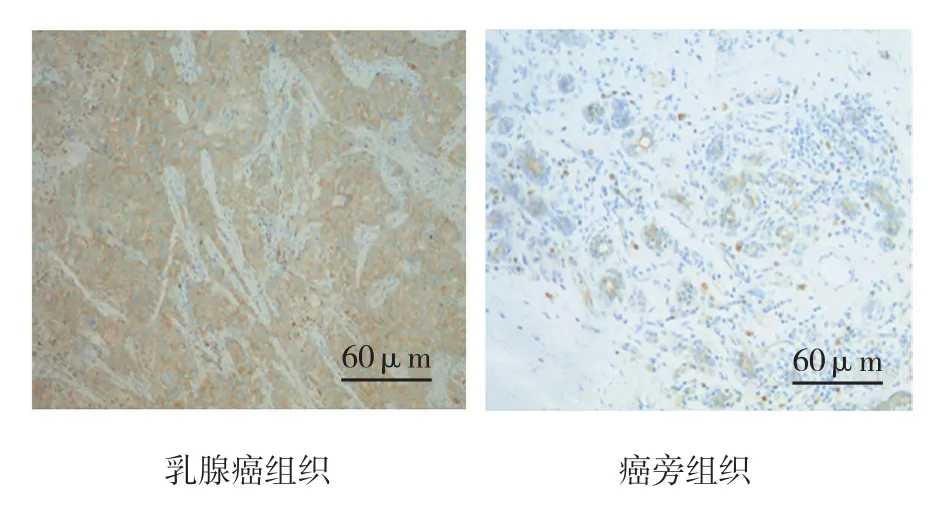
图1 两组FOXO3a的表达 (免疫组化)

附表 两组FOXO3a的表达比较 [n =102,例(%)]
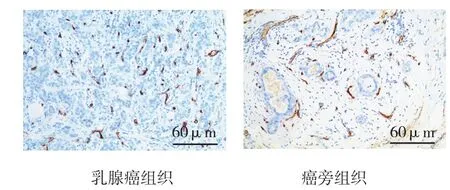
图2 两组CD34的表达 (免疫组化)
3 讨论
Forkhead转录因子是2000年被正式命名的新转录因子家族,该家族庞大,有17个亚家族,其中对FOXO亚家族的研究最为深入。目前在哺乳动物中已发现的FOXO家族成员有4个,为FOXO1、FOXO3a、FOXO4和FOXO6,其在细胞增殖、分化及凋亡等方面起重要作用[3-5]。FOXO3a广泛表达于人的胃、结肠、直肠、肝、肺、乳腺和前列腺等各种组织器官中,作为重要的转录因子参与多种生理病理过程,调控细胞增殖、凋亡、氧化应激及内环境的稳态等过程[6-8]。
FOXO3a是胰岛素PI3K-Akt信号通路的重要作用底物。胰岛素样生长因子能诱导PI3K/Akt级联反应,蛋白激酶B(protein kinase B, AKT)可使FOXO3a磷酸化,磷酸化后的FOXO3a与核DNA亲和力下降,而与伴侣蛋白14-3-3的亲和力增加,FOXO3a/14-3-3蛋白结合体从细胞核转位至细胞质,并阻止复合物逆转运至细胞核内,FOXO3a滞留于细胞质中,无法激活下游的靶因子,而失去活性[9-10]。多个研究表明PI3K/Akt/FOXO3a信号通路参与乳腺癌的发生[11-12],进一步研究发现,FOXO3a的活性高低、亚细胞定位以及参与的细胞信号转导通路均与肿瘤的发生发展密切相关。本研究发现,FOXO3a在乳腺癌组的表达低于癌旁组,且FOXO3a主要表达于乳腺癌细胞的细胞质中,提示癌细胞中的FOXO3a定位出现异常,癌细胞胞质中的FOXO3a处于去活化状态,失去对细胞增殖、凋亡相关因子的转录调节作用[9-10],FOXO3a的异常表达与乳腺癌的发生、进展有相关性。
对血管内皮细胞的基因谱分析显示,FOXO3a是血管内皮细胞中重要的转录因子,FOXO3a的活性下降可促进血管过度生成[13]。有研究表明,FOXO3a过表达与非小细胞肺癌组织中的微血管密度呈负相关[14];FOXO3a与乳腺癌组织中血管生成的关系在国内外文献中尚未见报道。本研究中,癌旁组织的FOXO3a主要表达细胞核中,可以发挥其抑制血管内皮细胞增殖的正常功能,从而抑制新生血管的形成;而在乳腺癌组织,FOXO3a在细胞核表达阳性者的微血管密度值低于胞核阴性者,胞质阳性者癌组织微血管密度值与胞质阴性者比较无差异。提示癌细胞中FOXO3a定位异常(从胞核转位于胞质),其正常活性受抑制,不能发挥其限制内皮细胞增殖和迁移的能力[13],间接促进新生血管的过度生成。
肿瘤的生长依赖新生血管的形成,而血管的形成与血管内皮的增殖密切相关。本研究表明,处于活性状态的FOXO3a可负性调节血管内皮细胞因子的增殖。因此,通过调控FOXO3a的活性,促进FOXO3a活化而发挥其抑制血管形成的作用,有望为肿瘤治疗提供新的思路。
[1]PENG C M, MA J L, GAO X, et al. High glucose induced oxidative stress and apoptosis in cardiac microvascular endothelial cells are regulated by FoxO3a[J]. PLoS One, 2013, 8(11): e79739.
[2]WEIDNER N, FOLKMN J, POZZA F, et al. Tumor angiogenesis: a new significant and independent prognostic indicator in early-stage breast carcinoma[J]. J Natl Cancer Inst, 1992, 84(24): 1875-1877.
[3]MARTINS R, LITHGOW G J, LINK W. Long live FOXO:unraveling the role of FOXO proteins in aging and longevity[J].Aging Cell, 2016, 15(2): 196-207.
[4]WANG F, MARSHALL C B, IKURA M. Forkhead followed by disordered tail: The intrinsically disordered regions of FOXO3a[J].Intrinsically Disordered Proteins, 2015, 3(1): e1056906.
[5]LEE S, DONG H H. FoxO integration of insulin signaling with glucose and lipid metabolism[J]. J Endocrinol, 2017, 233(2):R67-R79.
[6]MYATT S S, LAM E W. The emerging roles of forkhead box (Fox)proteins in cancer[J]. Nat Rev Cancer, 2007, 7(11): 847-859.
[7]FU Z, TINDALL D J. FOXOs, cancer and regulation of apoptosis[J]. Oncogene, 2008, 27(16): 2312-2319.
[8]DANSEN T B, BURGEFING B M. Unravelling the tumorsuppressive functions of FOXO proteins[J]. Trends Cell Biol,2008, 18(9): 421-429.
[9]KIM H J, LEE S Y, KIM C Y, et al. Subcellular localization of FOXO3a as a potential biomarker of response to combined treatment with inhibitors of PI3K and autophagy in PIK3CA-mutant cancer cells[J]. Oncotarget, 2017, 8(4): 6608-6622.
[10]FANG L, WANG H, ZHOU L, et al. Akt-FOXO3a signaling axis dysregulation in human oral squamous cell carcinoma and potent efficacy of FOXO3a-targeted gene therapy[J]. Oral Oncol, 2011,47(1): 16-21.
[11]SMIT L, BERNS K, SPENCE K, et al. An integrated genomic approach identifies that the PI3K/AKT/FOXO pathway is involved in breast cancer tumor initiation[J]. Oncotarget, 2016,7(3): 2596-2610.
[12]BULLOCK M. FOXO factors and breast cancer: outfoxing endocrine resistance[J]. Endocr Relat Cancer, 2016, 23(2):R113-R130.
[13]POTENTE M, URBICH C, SASAKI K, et al. Involvement of Foxo transcription factors in angiogenesis and postnatal neovascularization[J]. J Clin Invest, 2005, 115(9): 2382-2392.
[14]任昭军, 柳红. 非小细胞肺癌中FOXO3a蛋白的表达及意义[J].临床与实验病理学杂志, 2012, 28(12): 1365-1368.
