分批补料式高密度培养植物乳杆菌的研究
2018-06-14卢富山尹清强赵卫卫
卢富山,尹清强,赵卫卫,王 潇
(1.河南普爱饲料股份有限公司,河南 周口 466100;2.河南农业大学 牧医工程学院,河南 郑州 450002)
植物乳杆菌(Lactobacillusplantarum)具备免疫调节、抑制病原微生物、维持肠道菌群平衡和促进营养物质吸收等很多保健作用[1]。植物乳杆菌微生态制剂的制备,关键技术就是高密度培养,限制乳酸菌增殖的关键因素是有机酸的积累和发酵底物的消耗。在发酵进入对数生长后期,乳酸以及其他有机酸的生成导致pH的下降,在pH降为4.0左右时,就会抑制乳酸菌的生长,这时对数生长期的细胞繁殖就会被破坏[2];同时,底物的大量消耗也限制了微生物的持续增长。补料分批培养能够有效中和过多的酸并补充缺失的营养素,在流加补料液的过程中,通过应用低浓度初糖并且在发酵过程中连续补料[3]和调整至最适pH值,使菌体数量在发酵结束时能够获得很大提高,对乳酸菌进行大规模培养具有一定的指导意义[4-5]。本研究对植物乳杆菌进行补料分批培养,找出培养过程中有效的限制性营养因子[6]和最优调整pH方式,以此获得高密度细胞培养方法,解决植物乳杆菌发酵剂制备中的关键环节。
1 材料与方法
1.1 材料
1.1.1 菌种 植物乳酸杆菌(L.plantarum)CICC 20265,购买于中国工业微生物菌种保藏中心。
1.1.2 培养基 种子培养基(MRS):葡萄糖2%、胰蛋白胨1%、牛肉蛋白胨1%、酵母浸粉0.5%、NaAc 0.5%、K2HPO40.2%、MgSO40.058%、MnSO40.025%、柠檬酸二胺0.2%、吐温80为0.1 mL、pH为6.2~6.4。基础发酵培养基:葡萄糖2.0%、胰蛋白胨1.4%、NaCl 0.25%、MgSO40.1%、K2HPO40.5%、NaAc 0.3%。
1.2 方法
1.2.1 种子液的制备 接种冻干保藏的菌种于种子培养基,于37 ℃静止培养18 h。
1.2.2 发酵培养 将制备的种子液按照1%的接种量接种于发酵培养基,于37 ℃静止培养18 h,即为后续试验用发酵液。
1.2.3 分批补料式高密度培养[7]乳酸菌在37 ℃下培养至12 h进入对数生长末期,残糖质量浓度在5 g/L左右。然后在对数生长期,采用不同的分批补料手段向发酵液中添加新鲜的补料液,同时添加碱液保持pH值为6.5。
首先在500 mL培养瓶中装入200 mL发酵液,对乳酸菌进行补料分批培养研究,探讨对数生长末期限制微生物生长的限制性底物,以活菌数为参照,研究补料时的最适中和剂和补料液的最佳碳氮比。
在发酵12 h后,向发酵液中分别加入不同配比的补料液,通过测定补料后活菌数的变化,研究限制微生物增殖的营养要素以及发酵培养基中的碳氮源最佳配比。将发酵培养基按照营养组分为2组:葡萄糖(L1,30 g/L)和蛋白胨(L2,28 g/L)。
在发酵12 h后,分别选择1 mol/L的KOH、Na2CO3溶液、氨水和醋酸钠为中和剂,调解pH到最适,最终通过测定活菌数选择最佳的中和剂。
在确定补料液最佳碳氮比和最适中和剂后,进行10 L发酵罐扩大实验,运用恒速流加、葡萄糖反馈流加等补料方式,将碳氮比为5∶7的补料液注入发酵罐并同时调整pH值,通过测定活菌数的变化,探究最佳分批补料方式。
1.2.4 活菌计数方法 将发酸液按10的倍数进行稀释,取1 mL稀释液涂布于的固体培养基上,在37 ℃下培养24 h,计算发酵液中活菌数(CFU/mL),并用自然对数(lg)表示。
1.2.5 pH值的测定 采用PHS-3C精密酸度计直接测定发酵液的pH值。
1.2.6 还原糖的测定 采用DNS法。
2 结果与分析
2.1 初始葡萄糖浓度对植物乳杆菌生长的影响
由表1可知:葡萄糖质量浓度在5~15 g/L范围内,菌体浓度随初糖质量浓度增大而增加;当葡萄糖质量浓度为15 g/L时,菌体浓度最大;初始糖浓度继续增加,菌体浓度降低。由此可以看出在一定范围内,增加初始糖质量浓度可以促进细胞增殖,但过高的底物浓度反而抑制了细胞的增殖。
Combining the mathematical model defined by Eqs.(1)–(3),the transfer function of the hydraulic section is
2.2 起始氮源浓度对植物乳杆菌生长的影响
配制不同蛋白胨含量的培养基,含量分别为6、10、14、16、18 g/L,其他成分相同,装液量100/250 mL,接种量3%,培养24 h后测活菌数。
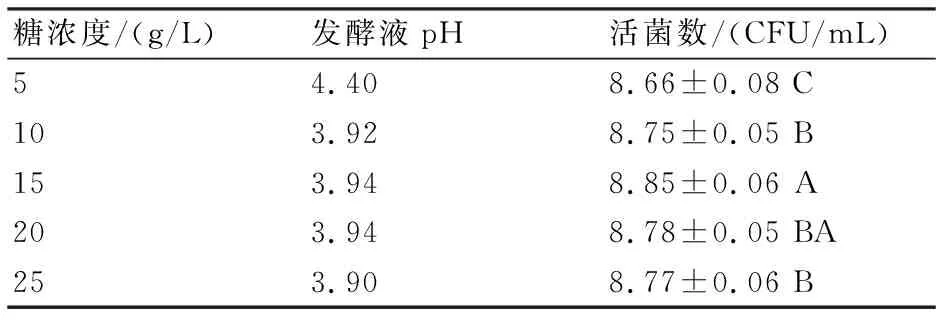
表1 不同初糖浓度对活菌数的影响
由表2可以看出,14、16、18 g/L下的活菌数差异不明显,但14 g/L下的活菌数最高,用量也较少,确定氮源初始浓度为14 g/L。

表2 不同氮源浓度对活菌数的影响
2.3 最适pH的确定
将液体培养基初始pH值分别调至5.5、6.0、6.5、7.0、7.5,37 ℃下恒温培养18 h后,检测其活菌数。由表3可以看出,发酵液初始pH为7.0~7.5时活菌数最高。
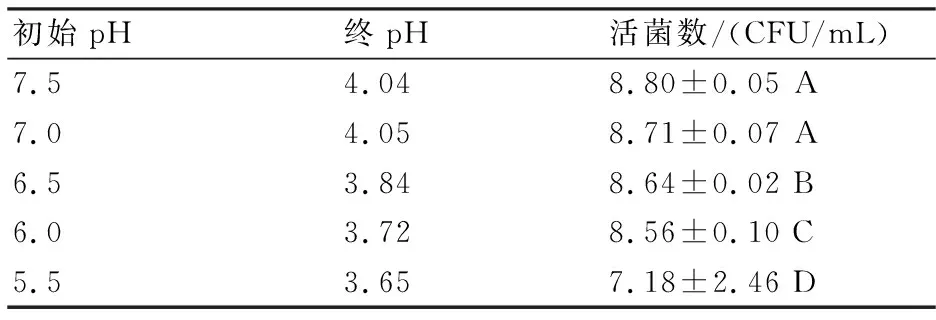
表3 不同初始pH对活菌数的影响
2.4 限制性底物的确定
补料分批培养首先要确定对数生长末期限制微生物增殖的营养因子。由图1可知,在微生物生长进入稳定期时,菌体OD值达到0.2976,残糖质量浓度降至2 g/L,表明葡萄糖的损耗可能是限制微生物继续增殖的因素。
微生物的增殖需要多种营养因子,那么培养基到对数末期可能还存在其他限制性营养因子。因此本试验设计了3种补料液,分别为补料液L1(10 mL)、补料液L2(10 mL)、补料液L1(5 mL)+ L2(5 mL),在分批培养至对数生长末期(12 h),将上述补料液分别一次性加入200 mL的发酵培养液,在补料培养阶段调节pH值在7左右,培养22 h后结束发酵,测得其活菌数变化(表4)。
在发酵平稳期加入补料液L1,22 h后菌体浓度增加,这表明分批培养末期的细胞增殖停止是由碳源匮乏引起的。当补料液中含有氮源时(L2及L1+L2),菌体总量有所增加,这表明氮源也是对数生长末期的限制性营养因子,需要在分批补料过程中加入补料液。

图1 植物乳酸杆菌生长过程变化表4 不同补料类型对活菌数的影响

补料类型终pH活菌数/(CFU/mL)L14.719.18±0.012 BL27.048.79±0.13 CL1+L24.659.30±0.03 AB空白3.778.57±0.06 C
注:空白表示未进行补料。
2.5 补料液最适碳氮比的确定
在补料液中,葡萄糖(L1)添加量不变(5 mL),增加蛋白胨的添加量。在前4组实验中,随着蛋白胨添加量的增加,活菌数也随之提高,并且差异显著。这主要是由于补料液中蛋白胨含量较少。当蛋白胨添加量(L2)增加到7 mL时,获得了最大的活菌数;继续增加蛋白胨则活菌数趋于稳定且差异不显著,此时可能葡萄糖的缺乏又成为关键因素。所以在补料试验中,确定补料液中的C/N(体积比)为5∶7。

表5 不同碳氮比的补料液对活菌数的影响
2.6 中和剂的选择
在乳酸杆菌高密度培养过程中往往通过流加碱液来消除酸的反馈抑制[7]。本实验选择KOH、Na2CO3溶液、氨水和醋酸钠为中和剂,按确定的适宜条件进行发酵,在对数生长末期一次性补料的同时选用不同的中和剂调节培养基pH值到7,并比较不同中和剂对植物乳杆菌高密度培养的影响,中和剂的浓度为1 mol/L,测定培养24 h后的活菌数。
在乳酸菌的静止培养过程中,大量乳酸以及其它有机酸积累会对细胞的分裂增殖产生反馈抑制[8]。植物乳杆菌在高密度培养过程中会产生大量的有机酸,在培养过程中加入中和剂后,氢氧化钠能快速恢复降低的pH值,醋酸钠作为缓冲剂能稳定发酵液的pH值。综上,试验确定氢氧化钠+醋酸钠为最适中和剂(表6)。

表6 不同中和剂对活菌数的影响
2.7 最适补料方式的确定
首先应用恒速补料策略进行高密度培养,以2 g/(L·h)(以葡萄糖计) 的补料速度向发酵液中加入C/N为5∶7 (体积比)的补料液,同时每隔2 h调节一次pH值至7。
葡萄糖反馈补料策略:通过对补料液补料速度的调节来实施葡萄糖反馈补料控制,根据培养液内的葡萄糖浓度的变化及时调整葡萄糖添加量,使葡萄糖浓度维持在一个合适的范围内。虽然确定残糖的质量浓度需要1 h的间隔时间,但可以粗略地保持一个所需的低残糖质量浓度(1.0~1.5 g/L),在该条件下,培养24 h。
由图2可知,葡萄糖反馈流加效果最好,活菌浓度能达到3.1×109CFU/mL;而恒速流加能达到2.4×109CFU/mL;两种流加培养方式[9-10]的活菌数都高于静止培养。葡萄糖反馈流加是将发酵过程中的葡萄糖浓度控制在一定范围内,发酵液中碳氮源、pH值在最适水平,有利于微生物细胞的增殖;而恒速流加能够在发酵前期提供给乳酸菌生长的营养要素,到对数生长期,微生物生长迅速,营养物质的消耗速度已经大于补料速度,后期则不能满足菌体对营养物质的需求。因此,葡萄糖反馈流加方法更适合植物乳杆菌的高密度培养。
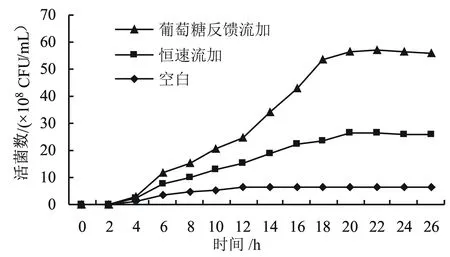
图2 不同补料方式下活菌数的变化
3 讨论
本研究首先确定了补料液的组分与配比,确定了最佳的中和剂组合模式。通过流加不同组分、不同配比的补料液,发现碳源(葡萄糖)和氮源(蛋白胨)是植物乳杆菌增殖的限制性底物,从而确定了葡萄糖和蛋白胨混合物为补料分批培养过程中需要补加的营养素,并在此基础上确定了补料液的最优碳氮比5∶7。同时,乳酸菌在生长过程中不断代谢糖类产生乳酸和其他有机酸,使得培养液酸度不断增加,乳酸菌的生长受到低pH值的抑制,因此在补料同时向培养基中加入中和剂来调解pH值,使用缓冲剂来维持pH值在一定范围内,最终选用氢氧化钠和醋酸钠组合为最优中和剂。
为了研究更好的补料分批高密度培养法,本研究比较了2种流加模式,恒速流加模式虽然能够平稳地向培养液中补充营养要素,在前期一定程度上满足了微生物的营养需求,但到了对数生长中后期细胞增殖迅速,恒速流加就无法满足细胞增殖的营养需求,因此会限制菌体的快速生长。葡萄糖反馈补料被证实为最佳的,这种流加方式能将发酵液中葡萄糖控制在一定的范围内,并且通过内部营养需求调整营养要素供给量,所以最终获得了较高的细胞浓度,活菌数达到3.1×109CFU/mL,最终使用葡萄糖反馈流加可以使活菌数提高4倍。
参考文献:
[1] 张敏,黄星原.病毒性心肌炎小鼠血清CAM21和TNF2-t的变化及意义[J].同济大学学报:医学版,2006,27(1):21-23.
[2] 金双喜,韩羿斌.一株植物乳酸杆菌的高密度发酵[J].中国微生态学杂志,2008,20(4):365-366,368.
[3] 靳志强,李平兰.补料分批法高密度培养德氏乳杆菌保加利亚亚种S-1[J].中国乳品工业,2007,35(1):4-9.
[4] Riesen B D, Guthke R. High cell density cultivation of microorganisms [J]. Appl Microbiol Biotecho1, 1999(51): 422-430.
[5] 任亚妮,车振明,黄莉.乳酸菌发酵剂中的细胞高密度培养条件及最佳离心条件探索[J].中国调味品,2011,36(5):36-39.
[6] Furie M B, Tancinco M C, Smith C W. Monoclonal antibodies to leukocyte integrins cd11a/cd18 and cd11b/cd18 or intercellular adhesion molecule-1 inhibit chemoattractant-stimulated neutrophil transendothelial migration in vitro[J]. Blood, 1991, 78(8): 2089-2097.
[7] 王海娟,韩雪,马微,等.高渗条件下相容性溶质对乳酸杆菌的作用[J].食品科技,2015(3):16-19.
[8] 刘辉,季海峰,王四新,等.饲用乳酸菌高密度培养的研究进展[J].中国饲料,2016(4):11-14.
[9] 徐庆阳,马雷,程立坤,等.葡萄糖流加方式对黄色短杆菌生产L-亮氨酸的影响[J].食品与发酵工业,2010(8):1-5.
[10] Beom S K, Seung C L, Sang Y L, et al. High cell density fed batch cultivation ofEscherichiacoilusing exponential feeding combined with pH-state[J]. Bioprocess Bio-systems Engineering, 2004(26): 147-150.
