洋葱不育性鉴定及组培扩繁研究
2018-06-14潘美红杨海峰惠林冲缪美华何林玉陈振泰
潘美红,杨海峰,惠林冲,薛 萍,缪美华,陈 微,何林玉,陈振泰
(连云港市农业科学院,江苏 连云港 222000)
洋葱产业是一个效益显著的产业,有利于农村产业结构调整,不仅能满足国内市场需求,也为我国出口创汇做出重要贡献,目前我国的洋葱种植面积和产量已成为世界上的第一大国[1]。虽然洋葱在我国蔬菜生产中占重要地位,但是由于我国洋葱品种资源匮乏,育种单位少[2],科研投入不足,生产上严重缺少有自主知识产权的洋葱品种,特别是杂交品种。洋葱为异花授粉作物,花器官很小,难以开展常规人工杂交育种,国内对洋葱雄性不育的研究起步比较晚,选育出的洋葱杂交品种质量与国外品种存在一定差距,真正应用于市场的很少[3]。利用洋葱雄性不育系是进行杂交品种选育和制种的关键,大部分从事洋葱育种的工作者都致力于洋葱雄性不育系的选育。本研究旨在对田间观察到的洋葱不育植株,利用分子标记方法进行育性鉴定,确定其不育性及不育类型,然后通过组培扩繁不育系,为选育洋葱杂交品种奠定基础。
1 材料与方法
1.1 材料概况
连葱15号由连云港市农业科学院选育,中早熟品种,商品性好,外皮金黄色,内部鳞片白色,有甜味,球形指数0.85,假茎较细;单球重330 g,黄淮地区9月5~10日播种,11月初定值,次年5月上旬开始采收,产量5400~5900 kg/667 m2,抗病性强。
1.2 不育株的鉴定
1.2.1 田间鉴定 洋葱开花期,在连葱15号种植群体中寻找符合洋葱不育株表观特征的植株,将不育株选择其中一个花球套袋自交(保证花球上没有开放的小花),观察自交结实情况。
1.2.2 分子标记鉴定
1.2.2.1 DNA提取 试验材料在连云港市农业科学院东辛农场试验基地种植,开花期在连葱15号群体中找到3株不育株,另选3株可育株作对照,每株取2个花薹上的1片嫩叶,液氮冷冻研磨,用天根生物有限公司的DNA提取试剂盒(型号:DP350-03)提取DNA,取2 μL样品于Nanodrop 2000 C微量分光光度计上进行DNA浓度和纯度的检测。
1.2.2.2 引物设计与合成 引物参考Kim等[4]报道的orf725,由苏州金唯智生物有限公司合成:
正向引物序列(5′-3′):
F1-CATAGGCGGGCTCACAGGAATA。
反向引物序列(5′-3′):
R1-AATCCTAGTGTCCGGGGTTTCT,
R2-CAGCGAACTTTCATTCTTTCGC。
1.2.2.3 PCR扩增 PCR扩增试剂购置于TAKARA公司,反应体系为25 μL,包括:2 μL DNA(0.1 μg),2.5 μL 10×PCR buffer,1.25 μL(10 μmol/L)正向引物,1.25 μL(10 μmol/L)反向引物,2 μL dNTPs(10 mmol/L),0.25 μL TaqM和15.8 mL ddH2O,PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min[5],PCR产物用1%琼脂糖凝胶进行检测。
1.3 不育株组培扩繁
1.3.1 组培方法筛选 参照陈振泰等[6]的组培方法,加引用文献利用同品种可育株,进行培养基配方的筛选,再应用于不育株的组培。

表1 培养基成分及配比
注:MS为通用培养基代号,培养基pH为5.8,琼脂8 g/L,蔗糖30 g/L。
1.3.2 组培苗倍性鉴定 将扩繁得到的洋葱单株壮苗转入生根培养基1/2MS+1 mg/L 6-BA+0.02 mg/L NAA中进行培养,培养温度为20~25 ℃。当组培苗根长至2~3 cm时,随机选几根生长健壮的根,取2~3 mm根尖制作压片[7],在显微镜下观察根尖染色体的有丝分裂情况。
1.3.3 组培苗生根、驯化移栽 洋葱生根培养后,打开培养器皿的封口,放置1~2 d后,将洋葱苗从培养器皿中取出,洗净根部附着的培养基,移入装有沙土的盆中,于自然光照条件下,白天22~25 ℃、夜间11~15 ℃的条件下培养,待洋葱苗成活后移栽至大田。
2 结果与分析
2.1 洋葱植株不育性鉴定结果
2.1.1 不育株表型鉴定 不育株刚开的花花药颜色呈透明状、颜色略带绿色;开花后期与可育株相比,花药干枯萎缩严重(图1);用手触碰花球,无花粉沾手。开花前套袋自交,成熟后经检查完全不结实。

图1 洋葱可育株与不育株花球对比
2.1.2 不育株分子鉴定 根据Kim等[4]的报道,采用orf725标记进行PCR扩增,能够在可育株中扩增出一条833 bp,T型不育中扩增出833 bp和628 bp两条带,S型不育中只能扩增出628 bp单一条带。本试验结果如图2,CK为希望之星正常可育株,A为希望之星不育株,3个CK都扩增出833 bp条带,3个不育材料都扩增出833 bp和628 bp两个条带,可以确定田间观察到的洋葱为不育株,且是CMS-T型不育。
2.2 洋葱不育株组织培养
采用鳞茎盘做外植体,采用MS培养基,配以一定比例的6-BA和NAA,不诱导愈伤组织,只诱导不定芽。由表2可知,每一种培养基都有超过70%的诱导率,采用M65、M74配方的培养基,诱导率达到了100%。比较平均每个鳞茎盘诱导不定芽数发现,该洋葱品种在M74的培养基上平均每个鳞茎盘有3个不定芽,诱导效果明显高于其他培养基。最终确定用M74,即MS+7 mg/L 6-BA+0.4 mg/L NAA培养基进行不育株的扩繁。
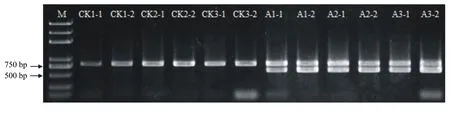
图2 PCR扩增结果表2 洋葱在不同培养基上的增殖效果
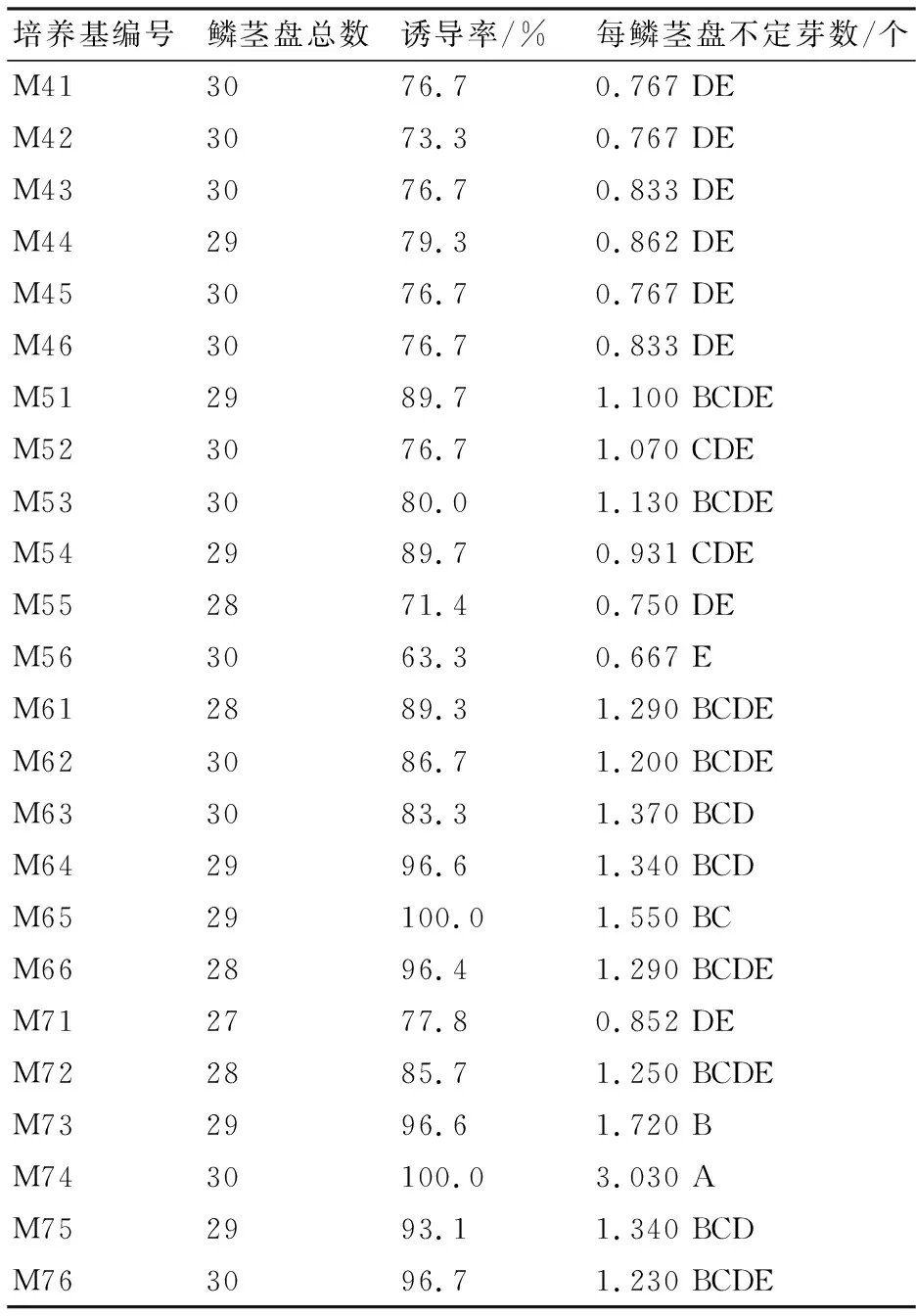
培养基编号鳞茎盘总数诱导率/%每鳞茎盘不定芽数/个M413076.70.767 DEM423073.30.767 DEM433076.70.833 DEM442979.30.862 DEM453076.70.767 DEM463076.70.833 DEM512989.71.100 BCDEM523076.71.070 CDEM533080.01.130 BCDEM542989.70.931 CDEM552871.40.750 DEM563063.30.667 EM612889.31.290 BCDEM623086.71.200 BCDEM633083.31.370 BCDM642996.61.340 BCDM6529100.01.550 BCM662896.41.290 BCDEM712777.80.852 DEM722885.71.250 BCDEM732996.61.720 BM7430100.03.030 AM752993.11.340 BCDM763096.71.230 BCDE
2.3 再生植株的倍性鉴定
将所获得的不定芽从鳞茎盘切下,转移至MS培养基中,7~10 d后发育成正常植株,再将该植株转入1/2MS+1 mg/L 6-BA+0.02 mg/L NAA培养基中生根,20 d左右生根,对所获得的再生植株进行根尖染色体数分析,发现扩繁所得的洋葱不育株含2n=2x=16条染色体(图3)。
3 讨论
利用雄性不育系配制杂种一代是蔬菜杂交优势利用的主要育种途径,洋葱也是最早利用雄性不育系育种的蔬菜之一[8],但是由于洋葱两年生,3年1个世代,采用传统育种方法选育洋葱雄性不育系时间太长。国外对洋葱雄性不育的研究较早较深入,目前中国市场上的洋葱杂交品种也多从国外引进,我国缺乏具有自主知识产权的洋葱杂交品种瓶颈在于洋葱不育系的选育。国内外利用分子标记进行洋葱雄性育性的相关研究已有不少报道[4,9-20],通过试验比较,采用orf725标记,不仅能快速鉴定出洋葱育性,还能区分出洋葱不育类型,方法简单实用而经济。利用组培,能快速扩繁不育株,但是对于不同类型的洋葱,不同配方的培养基,增殖效果不尽相同,本试验条件下,连葱15号以洋葱鳞茎盘为外植体,含有7 mg/L 6-BA+0.4 mg/L NAA的MS培养基增殖效果最好,通过染色体计数分析,洋葱组培苗的倍性不变。分子标记与组织培养两者有效结合,能快速培育出不育系,为杂交种的选育提供材料。
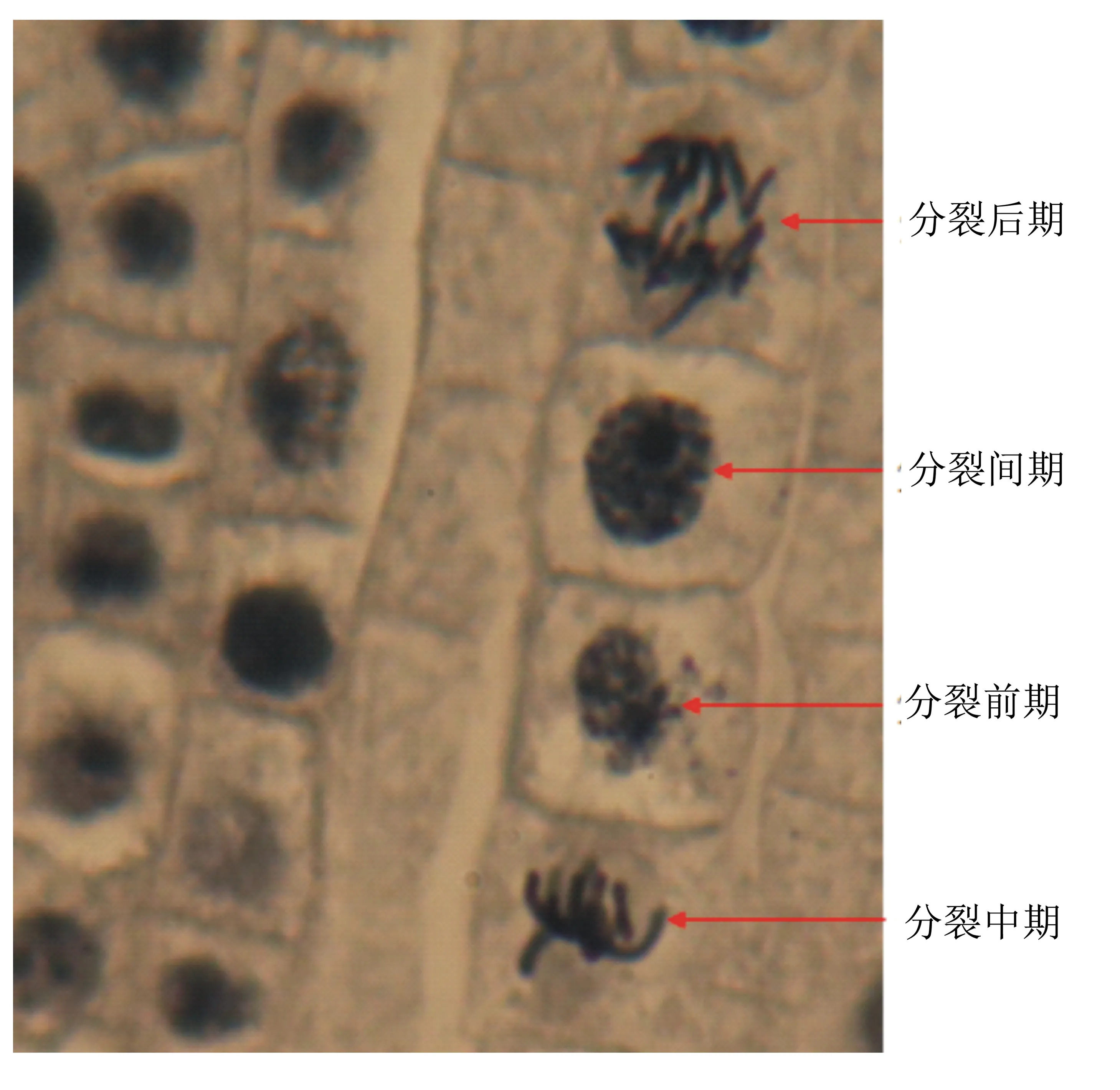
图3 再生洋葱植株根尖细胞有丝分裂
参考文献:
[1] 潘天春.洋葱育种的探索与实践[J].江苏农业科学,2013,41(5):119-121.
[2] 王立浩,方智远,杜永臣,等.我国蔬菜种业发展战略研究[J].中国工程科学,2016,18(1):123-136.
[3] 吴海涛,马蓉丽,刘洪炯,等.洋葱细胞质雄性不育系选育研究进展[J].园艺学报,2009,36(2):297-302.
[4] Kim S, Lee E, Cho D Y, et al. Identification of a novel chimeric gene,orf725, and its use in development of a molecular marker for distinguishing among three cytoplasm types in onion (AlliumcepaL.)[J]. Theoretical and Applied Genetics, 2009, 118(3): 433-441.
[5] 惠林冲.莲藕NnDREB2A克隆,表达分析和功能验证[D].扬州:扬州大学,2015:33-34.
[6] 陈振泰,杨海峰,潘美红,等.一种洋葱组织培养的方法:中国,CN101986830A[P].2011-03-23.
[7] 张文霞,戴灼华,樊启昶,等.遗传学实验指导[M].北京:高等教育出版社,2007:47-48.
[8] 陈沁滨,范育明.洋葱雄性不育系101A的杂优利用[J].江苏农业科学,2009,37(3):183-184.
[9] Sato Y. PCR amplification of CMS-specific mitochondrial nucleotide sequences to identify cytoplasmic genotypes of onion (AlliumcepaL.)[J]. Theoretical and Applied Genetics, 1998, 96(3/4): 367-370.
[10] Engelke T, Terefe D, Tatlioglu T. A PCR-based marker system monitoring CMS-(S), CMS-(T) and (N)-cytoplasm in the onion (AlliumcepaL.)[J]. Theoretical and Applied Genetics, 2003, 107(1): 162-167.
[11] 刘杰,崔成日,崔崇士,等.洋葱细胞质雄性不育系与相应保持系线粒体DNA的PRAD分析[J].东北农业大学学报,2004,35(3):322-324.
[12] Martin W J, McCallum J, Shigyo M, et al. Genetic mapping of expressed sequences in onion and in silico comparisons with rice show scant collinearity[J]. Molecular Genetics and Genomics, 2005, 274(3): 197-204.
[13] 陈沁滨,侯喜林,王建军,等.洋葱细胞质雄性不育系101A的分子鉴定[J].西北植物学报,2006(12):2430-2433.
[14] 陈沁滨,侯喜林,陈晓峰,等.洋葱细胞质雄性不育基因RAPD及SCAR分子标记研究[J].南京农业大学学报,2007,30(4):16-19.
[15] 李园园,王忠,梁峰,等.洋葱细胞质雄性不育系70及其保持系71基因组DNA的RAPD分析[J].生物技术通报,2006(6):100-102.
[16] 吴海涛,王建军,侯喜林,等.两个洋葱雄性不育系细胞质类型的鉴定与分析[J].园艺学报,2009,36(5):723-726.
[17] 吴海涛,王建军,侯喜林,等.洋葱T型细胞质雄性不育相关基因的结构与表达模式研究[J].园艺学报,2010,37(4):631-636.
[18] Kim S, Yoon M. Comparison of mitochondrial and chloroplast genome segments from three onion (AlliumcepaL.) cytoplasm types and identification of a trans-splicing intron ofcox2[J]. Current Genetics, 2010, 56(2): 177-188.
[19] Yang Y Y, Huo Y M, Miao J, et al. Identification of two SCAR markers co-segregated with the dominantMsand recessivemsalleles in onion (AlliumcepaL.)[J]. Euphytica, 2013, 190(2): 267-277.
[20] Bang H, Kim S, Park S O, et al. Development of a codominant CAPS marker linked to theMslocus controlling fertility restoration in onion (AlliumcepaL.)[J]. Scientia Horticulturae, 2013(153): 42-49.
