膈肌超声指标对机械通气患者撤机结果的预测价值研究
2018-06-14张海翔龚仕金宋佳鲁海燕董绉绉肖爱兵李小青明自强
张海翔 龚仕金 宋佳 鲁海燕 董绉绉 肖爱兵 李小青 明自强
撤机是患者结束机械通气治疗的重要阶段,预测撤机结果的指标众多,但由于导致撤机失败的原因也众多,单一的指标往往难以反映所有可能导致撤机失败的病理生理因素。因此,临床对预测撤机结局的研究更倾向于应用多个指标或复合参数。浅快呼吸指数(RSBI)是最常用的预测撤机结局的复合参数[1],但其特异度低且参考阈值不统一,临床应用受限[2-3]。有研究指出,对于合并膈肌功能障碍的机械通气患者,辅助呼吸肌能通过增加做功在一定时间内产生代偿作用,使潮气量保持在正常范围,掩盖膈肌功能障碍对潮气量的影响,此时使用RSBI预测撤机结局会出现假阴性结果[2]。近年来,超声检查作为评估机械通气患者膈肌功能的一种无创方法越来越受重视,临床上常通过测量膈肌移动度(DD)与膈肌增厚率(DTF)来评估膈肌功能[4-6]。本研究将膈肌超声相关指标(DD和DTF)代替传统RSBI中的潮气量计算出新的膈肌动度浅快呼吸指数(DD-RSBI,即呼吸频率/DD)和膈肌增厚浅快呼吸指数(DT-RSBI,即呼吸频率/DT),比较这两个新参数与传统RSBI对机械通气患者撤机结果的预测价值,现报道如下。
1 对象和方法
1.1 对象 选取2016年12月至2017年3月浙江省6家医院重症医学科连续收治的机械通气患者131例。纳入标准:(1)机械通气时间>48h;(2)导致机械通气的病因好转或祛除;(3)氧合稳定 [PaO2/吸入氧浓度(FiO2)≥200mmHg,呼气末正压(PEEP)≤5cmH2O,FiO2≤0.4];(4)血流动力学稳定,无心肌缺血的动态变化,临床上没有明显的低血压[未使用或仅使用低剂量的血管活性药物,如多巴胺或多巴酚丁胺<5μg/(kg·min)或去甲肾上腺素<0.05μg/(kg·min)];(5)有自主呼吸的能力;(6)镇静程度评估表(RASS)评分-1~ +1。排除标准:(1)年龄<18 岁;(2)妊娠或肿瘤终末期;(3)有胸腔闭式引流、气胸或纵隔气肿;(4)原发性神经肌肉疾病;(5)严重的心、肝、肾等脏器功能不全或血流动力学不稳定。本研究获得浙江医院医院伦理委员会批准,患者及其家属知情同意并签署知情同意书。
1.2 方法
1.2.1 撤机试验 本研究为前瞻性观察性研究,对符合上述入选标准的撤机患者进行自主呼吸试验(SBT),采用低水平压力支持通气(PSV)模式,压力支持水平设为7cmH2O,SBT期间FiO2保持不变。患者先进行2min SBT,通过后继续进行30min SBT,通过后拔除气管插管或脱开呼吸机(气管切开患者)。SBT过程中密切监测患者生命体征,出现下列情况中任何一项被认为SBT失败:(1)呼吸频率>35次/min或<8次/min;(2)动脉血氧饱和度(SaO2)<90%;(3)心率>140次/min或变化>20%,出现新发的心律失常;(4)收缩压>180mmHg或<90mmHg;(5)出现呼吸困难、烦躁、大汗或者明显焦虑。
1.2.2 分组标准 患者成功拔除气管插管或脱开呼吸机(气管切开患者)且自主呼吸超过48h,视为撤机成功(撤机成功组)。患者SBT失败或者48h内重新进行机械通气,视为撤机失败(撤机失败组)。
1.2.3 膈肌超声检查 (1)DD测量(图1):患者取半卧位,床头抬高30°,使用3~5 MHz凸阵探头,将探头置于患者锁骨中线或腋前线与肋弓下缘交界处,以肝脏作为透声窗,探头指向头侧及背侧,使声束到达并垂直于膈肌中后1/3部位,在理想的二维图像基础上应用M超显示膈肌运动,M超取样线指向膈肌顶部并与长轴夹角<30°以获得最大的膈肌动度。分别测量吸气末及呼气末膈肌距基线的距离。DD(mm)=吸气末膈肌距基线的距离-呼气末膈肌距基线的距离。(2)膈肌厚度(DT)测量(图2):患者取半卧位,床头抬高30°,使用频率为10MHz的线阵探头,置于腋前线或腋中线第8~10肋间隙,垂直于胸壁显示肋膈角处的膈肌结构,在理想的二维图像基础上应用B型或M型模式测量肋膈角下0.5~2cm处DT。分别测量吸气末与呼气末的DT并计算膈肌增厚分数(DTF)。DTF=(膈肌吸气末厚度-膈肌呼气末厚度)/膈肌呼气末厚度×100%。每例患者均由2位检查者各进行1次测量,取平均值。膈肌超声检查均由具有重症超声资质的ICU医生完成。2位检查者用超声检查测量20组DD及DT,间隔24h后对同一患者进行重复性测量,并进行一致性评价。
1.3 观察指标 (1)观察并比较两组患者性别、年龄、BMI、急性生理与慢性健康评分Ⅱ(APACHEⅡ评分)、机械通气原因、SBT前参数、预后情况。(2)观察并比较两组患者SBT 30min时撤机参数,SBT开始30min时进行膈肌超声检查,测量并记录呼吸频率、潮气量、DD、DTF、RSBI、DD-RSBI、DT-RSBI。如 SBT 失败则在重新连接呼吸机之前即刻进行上述操作。(3)观察DD、DTF、呼吸频率、RSBI、DD-RSBI和DT-RSBI对撤机失败的预测价值,包括灵敏度、特异度、阳性预测值、阴性预测值、阳性似然比、阴性似然比等。
1.4 统计学处理 应用SPSS 23.0统计软件;正态分布的计量资料以表示,两组比较采用两独立样本t检验;非正态分布的计量资料以 M(P25,P75)表示,两组比较采用Mann-Whitney U检验;计数资料以频数和构成比表示,组间比较采用χ2检验;采用ROC曲线评价各指标的预测价值,应用约登指数计算出最佳阈值及其灵敏度、特异度、阳性及阴性预测值、阳性及阴性似然比;采用多因素logistic回归分析撤机失败的危险因素;采用Bland-Altman分析评价检查者测量数值的组内及组间一致性;P<0.05为差异有统计学意义。

图1 DD测量(箭头所指为膈肌)
2 结果
2.1 两组患者一般资料比较 撤机成功组患者97例,撤机失败组患者34例,其中24例患者未能完成SBT,3例患者拔管后48h内重新插管,7例患者拔管后48h内需要无创通气支持。两组患者一般资料比较见表1。

图2 DT测量(箭头所指为膈肌)

表1 两组患者一般资料比较
由表1可见,两组患者性别、年龄、BMI、APACHEⅡ评分、机械通气原因、SBT前参数比较差异均无统计学意义(均P>0.05)。撤机失败组患者住ICU天数及总住院天数均大于撤机成功组患者,差异有统计学意义(均P<0.05)。
1.2 两组患者SBT 30min时撤机参数比较 见表2。
由表2可见,撤机成功组患者SBT 30min时的呼吸频率、RSBI、DD-RSBI、DT-RSBI均低于撤机失败组(均P<0.05),潮气量、DD、DTF 均高于撤机失败组(均P<0.05)。
2.3 DD、DTF、呼吸频率、RSBI、DD-RSBI和 DT-RSBI对撤机失败的预测价值 见表3。
由表3 可见,RSBI、DD-RSBI、DT-RSBI预测撤机失败的准确度均较高。RSBI、DD-RSBI、DT-RSBI预测撤机失败的ROC曲线见图3。
2.4 撤机失败的危险因素分析 单因素分析显示RSBI、DT-RSBI、DD-RSBI是撤机失败的相关因素。多因素logistic回归分析表明,高DD-RSBI、高DT-RSBI均是撤机失败的独立危险因素,见表4。
2.5 2位检查者的一致性评价结果 Bland-Altman分析显示2位检查者之间DD与DT的测量值分别有5%(1/20)、10%(2/20)的点位于95%一致性界限以外,同一检查者DD与DT的测量值分别有5%(1/20)、10%(2/20)的点位于95%一致性界限以外。2位检查者测量的DD、DT一致性高。
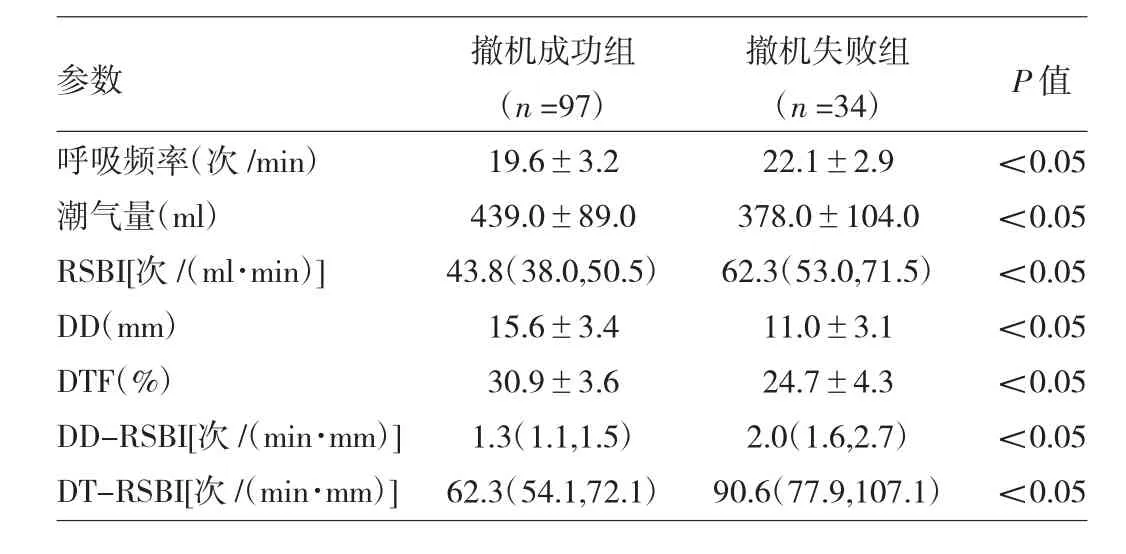
表2 两组患者SBT 30min时撤机参数比较
3 讨论
对于ICU内接受机械通气的患者,当引起急性呼吸衰竭的原发疾病得到改善,患者自主呼吸能力能满足自身通气需求时,临床应考虑及时撤除机械通气对呼吸的支持,使患者恢复完全自主通气。延迟撤机将增加医疗费用和机械通气相关的并发症,而过早的撤机容易导致撤机失败,增加再插管率和病死率[7-8]。因此,对撤机结局的正确判断以及最佳撤机时机的选择至关重要。导致撤机失败的原因多种多样,包括呼吸肌的机械负荷过高、膈肌功能受损、撤机诱发的心功能不全和保持气道开放与清除分泌物的能力下降等因素,甚至上述几种因素同时参与,使用单一的指标来预测撤机结局往往存在不足。因此,理想的预测指标应反映所有上述可能导致撤机失败的病理生理因素。撤机失败的本质是各种原因导致的呼吸肌机械负荷与呼吸肌应对机械负荷的实际能力之间的失衡,从而导致呼吸肌疲劳,最终出现浅快呼吸[9]。作为临床上最常用的预测撤机结果的参数之一,RSBI被认为能较好的预测撤机结果。有研究表明,RSBI>105次/(L·min)时,其撤机失败预测值可达95%[1];而当RSBI<105次/(L·min)时,预测撤机成功的特异度仅为67%。且各项研究报道的RSBI预测撤机结果的阈值变化很大,从60次/(L·min)到105次/(L·min)不等[2-3]。因此,RSBI仍不是预测撤机结果的最理想指标。

表3 DD、DTF、呼吸频率、RSBI、DD-RSBI和DT-RSBI对撤机失败的预测价值

图3 RSBI、DD-RSBI、DT-RSBI预测撤机失败的ROC曲线

表4 撤机失败的危险因素分析
膈肌是一种重要的呼吸肌,在自主呼吸产生潮气量中起到重要的作用,大约60%~80%的吸气潮气量是由膈肌收缩产生[10-11]。ICU内许多因素如膈神经损伤、神经肌肉疾病、机械通气、脓毒症、营养不良、电解质紊乱等均可导致膈肌的功能障碍,从而增加患者撤机失败风险,延长机械通气时间。当膈肌功能受损,收缩能力下降时,其他辅助呼吸肌如肋间内肌、肋间外肌等能通过增加做功在一定时间内产生代偿作用,使潮气量保持在正常范围,掩盖膈肌功能障碍对潮气量的影响,此时患者的RSBI往往在正常范围[2]。但是,辅助呼吸肌的耐力远不如膈肌,在几小时内即可发生呼吸肌疲劳,最终导致撤机失败。这也解释了为什么RSBI<105次/(L·min)时,预测撤机成功的特异度仅为67%。本研究将反映膈肌功能的相关指标(DD和DTF)代替RSBI中的潮气量,计算出两个新指标,即DD-RSBI和DT-RSBI,结果显示高DD-RSBI和高DT-RSBI都是撤机失败的独立危险因素。对DD-RSBI和DT-RSBI的构成进行剖析,呼吸频率是反映呼吸中枢驱动力及膈神经传导功能的指标[12]。DD和DT能更加真实反映膈肌的功能,避免了辅助呼吸肌对潮气量的影响[13]。因此,DD-RSBI、DTRSBI是将呼吸驱动力与反映膈肌功能特异性指标相结合,从而体现出呼吸中枢驱动下的膈肌收缩效能,既反映了呼吸负荷与呼吸肌力量之间的平衡关系,也暴露出撤机失败各病理生理因素下浅快呼吸的特性。
Spadaro等[2]对51例撤机患者的研究发现,DD-RSBI预测撤机失败的准确性明显优于RSBI、最大吸气压(MIP)等传统参数,以DD-RSBI>1.3次/(min·mm)为界值,其AUC达0.89,预测撤机失败的灵敏度为94.1%、特异度为64.7%。本研究中将DTF这一反映膈肌驱动能力的指标代替潮气量,计算的DT-RSBI与DD-RSBI相比预测撤机失败的效能相似,说明DD与DTF均可真实准确地反映出膈肌的功能。
本研究也存在一定局限性。首先,由于左侧膈肌超声声窗较小,且受胃肠胀气的影响较大,本研究只选择了右侧膈肌进行测量。但是本研究大部分患者为内科患者,不同于心脏手术导致的单侧膈肌麻痹,膈肌功能障碍累及双侧膈肌。第二,DD-RSBI与DT-RSBI的分子是呼吸频率,在反映呼吸中枢驱动力或自主呼吸不耐受时,其影响因素较多、特异度低[12],但本研究严格按照纳排标准筛选入组患者,且测量均在患者安静、配合的状态下进行,尽量减少或避免了呼吸频率所受的干扰。研究报道称,反映呼吸中枢驱动力的最佳指标是膈肌电位,其不受潮气量和膈肌疲劳的影响[14-15],所以在后续的研究中笔者打算将膈肌电位与膈肌移动度或膈肌增厚率相结合,并推测此指标预测撤机失败的准确性能进一步提高。最后,本研究样本量仍偏小,需要进一步扩大样本来验证DD-RSBI、DT-RSBI对撤机失败的预测价值。
综上所述,相比较传统的RSBI,膈肌超声相关指标DD-RSBI、DT-RSBI预测撤机结果更准确,是指导撤机时机的较好指标。
[1]Meade M,Guyatt G,Cook D,et al.Predicting success in weaning from mechanical ventilation[J].Chest,2001,120(6Suppl):400s-24s.doi:10.1378/chest.120.6_suppl.400S.
[2]Spadaro S,Salvatore G,Tommaso M,et al.Can diaphragmatic ultrasonographyperformeddurin-gtheT-tubetrialpredictweaningfailure?Therole ofdiaphragmaticrapidshallowbrea-thingindex[J].Crit Care,2016,20(1):305.doi:10.1186/s13054-016-1479-y.
[3]Huang C,Yu C.Conventional weaning parameters do not predict extubation outcome in intub-ated subjects requiring prolonged mechanical ventilation[J].Respir Care,2013,58(8):1307-1314.doi:10.4187/respcare.01773.
[4]Matamis D,SoilemeziE,Tsagourias M,et al.Sonographic evaluation of the diaphragm in cri-tically ill patients.Technique and clinical applications [J].Intensive Care Med,2013,39 (5):1-10.doi:10.1007/s00134-013-2823-1.
[5]DiNino E,Gartman E,Sethi J,et al.Diaphragm ultrasound as a predictor of successful extu-bation from mechanical ventilation[J].Thorax,2014,69(5):423-7.Doi:10.1136/thoraxjnl-2013-204111.
[6]Farghaly S,Hasan A.Diaphragm ultrasound as a new method to predict extubation outcome i-n mechanically ventilated patients[J].Aust Crit Care,2017,30(1):37-43.doi:10.1016/j.au-cc.2016.03.004.
[7]Smargiassi A,Inchingolo R,Tagliaboschi L,et al.Ultrasonographic assessment of the diaph-ragm in chronic obstructive pulmonary disease patients:relationships with pulmonary f-unction and the influence of body composition-a pilot study[J].Respiration,2014,87(5):364-71.doi:10.1159/000358564.
[8]Demoule A,Jung B,Prodanovic H,et al.Diaphragm dysfunction onadmission to the intensive care unit.Prevalence,risk factors,and prognostic impact-a prospective study[J].Am J Respir Crit Care Med,2013,188(2):213-219.doi:10.1164/rccm.201209-1668OC.
[9]HeunksL,HoevenJ.Clinical review:the ABCofweaningfailure--a structured approach[J].Crit Care,2010,14(6):245.doi:10.1186/cc9296.
[10]Dres M,Dube B,Mayaus J,et al.Coexistence and Impact of Limb Muscle and Diaphragm Weakn-ess at Time of Liberation from Mechanical Ventilation in Medical Intensive Care Unit Patients[J].Am J Respir Crit Care Med, 2017, 195 (1):57-66. doi:10.1164/rccm.201602-0367OC.
[11]Boussuges A,Gole Y,Blanc P.Diaphragmatic motion studied by m-mode ultrasonography:met-hods,reproducibility,and normal values[J].Chest,2009,135(2):391-400.doi:10.1378/chest.08-1541.
[12]DeHaven C,Orlando C,Joseph P,et al.Breathing measurement reduces false-negative classi-fication of tachypneic preextubation trial failures[J]. Crit Care Med, 1996, 24 (6):976-980. doi:10.1097/00003246-199606000-00017.
[13]Umbrello M,Formenti P,Longhi D,et al.Diaphragm ultrasound as indicator of respiratory effort in critically ill patients undergoing assisted mechanical ventilation:a pilot clinical study[J].Crit Care,2015,19:161.doi:10.1186/s13054-015-0894-9.1.
[14]EstradaL,TorresA,SarlabousL,et al.EMG-Derived Respiration Signal Using the Fixed Sa-mple Entropy during an Inspiratory Load Protocol[J].Conf Proc IEEE Eng Med Biol Soc,2015,2015:1703-1706.doi:10.1109/EMBC.2015.7318705.
[15]Mondal P,Hasan M,Saha A,et al.Effect of laparotomy on respiratory muscle activation pa-ttern[J].Physiol Rep,2016,4(1):e12668.doi:10.14814/phy2.12668.
