IL-12B基因多态性及单倍型与克罗恩病的关系研究
2018-06-14郭茂东王群英陈燕萍滕卫军马拥军杨小云韦炜丁进
郭茂东 王群英 陈燕萍 滕卫军 马拥军 杨小云 韦炜 丁进
克罗恩病(Crohn′s disease,CD)是一种累及全消化道的慢性非特异性肠道炎症性疾病,病因至今未明。遗传免疫学因素在其发病中的作用一直备受关注[1]。以Th1细胞亚群异常极化为特点的细胞免疫应答失衡已被证实是CD的重要发病机制之一[2]。IL-12可促进原始T淋巴细胞向Th1细胞分化,并诱导Th1细胞分泌干扰素γ、TNF-α等炎症因子,在调节细胞免疫反应中起重要作用[3]。研究发现,CD患者肠黏膜IL-12 mRNA表达上调[4]。同时,动物实验表明给予外源性IL-12不仅会使小鼠结肠炎症加重,且更易发生爆发性结肠炎,甚至死亡[5],而采用特异性抗体封闭IL-12则能明显减轻小鼠结肠炎症症状[6]。这些研究表明,IL-12可能在CD的发生、发展中起关键作用。IL-12由p40和p35 2个亚基组成,其中p40亚基的表达只局限于巨噬细胞、单核细胞、树突状细胞,对IL-12的表达水平具有决定性作用[7]。IL-12 p40表达受其IL-12B遗传多态性影响[8]。目前,日本及部分高加索人群的研究证实IL-12B基因多态性与CD易感性相关[9-10],我国汉族人群CD与IL-12B基因多态性的相关性报道少见。一项关于亚洲人群的研究表明rs3212227和rs6887695是IL-12B的2个常见功能性单核苷酸多态性(SNP)位点[11]。本研究探讨这2个SNP位点与CD易感性的关系,旨在为进一步阐明CD的遗传免疫学发病机制提供理论参考,现报道如下。
1 对象和方法
1.1 对象 选取2013年1月至2017年12月金华市中心医院、金华市人民医院消化内科收治的CD患者94例(CD组)。CD诊断标准参照“炎症性肠病诊断与治疗的共识意见(2012年,广州)”[12]。患者均经临床、实验室、电子结肠镜、放射影像学及病理组织学检查等明确诊断;按结肠镜下CD病变范围分为回肠型40例、结肠型12例、回结肠型42例,其中结肠型和回结肠型合并为结肠病变CD组;按疾病类型分为非狭窄非穿透型35例、狭窄型32例,穿透型27例。另择同期在金华市中心医院体检的106例健康体检者作为对照组。CD组与对照组均排除哮喘、类风湿性关节炎、系统性红斑狼疮、多发性硬化等自身免疫性疾病以及肺癌、肝癌、胃癌等肿瘤病史。两组受检者性别、年龄、吸烟史比较差异均无统计学意义(均P>0.05),见表1,且为无血缘关系的浙江汉族人群。本研究经金华市中心医院医学伦理委员会批准,受检者均知情同意并签署知情同意书。
1.2 方法
1.2.1 DNA提取 取受检者外周静脉血约3ml,乙二胺四乙酸(EDTA)-Na2抗凝。用血液基因组DNA提取试剂盒(北京天根生化科技有限公司)提取全基因组DNA。采用1%琼脂糖电泳对所获得的DNA样本进行质量检查及浓度检测,然后根据检测的浓度将样本稀释到工作浓度10ng/μl后置于-20℃冰箱冻存。

表1 两组受检者性别、年龄、吸烟史比较
1.2.2 改良多重高温连接酶检测反应(iMLDR)技术检测IL-12B基因多态性(rs3212227和rs6887695)
1.2.2.1 多重PCR获取目的基因片段 所需PCR扩增引物由上海生物工程技术有限公司合成。rs3212227上游引物:5′-GAAGGCCCATGGCAACTTGAG-3′,下游物:5′-CAATGTCACCCCACATCAACTTTTG-3′。rs6887695上游引物:5′-ACCCAGGGAAGGTGTGCTTCTC-3′,下游引物:5′-CACCCCTGAAGCGAGGTCAAAT-3′。总反应体系20μl,包含1×HotStarTaq缓冲液(大连宝生物工程有限公司),3.0mmol/L Mg2+(大连宝生物工程有限公司),0.3mmol/L dNTP(上海捷瑞生物工程有限公司),1U HotStarTaq聚合酶(德国Qiagen公司),1μl模板DNA和1μl多重PCR引物(引物浓度:rs3212227 1mmol/L,rs6887695 2mmol/L)。反应条件:95℃ 2min;94℃ 20s,65℃ 40s(每个循环减0.5℃),72℃ 1.5min,共11个循环;94℃ 20s,59℃ 30s,72℃ 1.5min,共 24 个循环;72℃2min;置于 4℃保存。
1.2.2.2 多重PCR产物纯化 在10μl PCR产物中加入5 U虾碱性磷酸酶(SAP,美国Promega公司)和2U核酸外切酶(Exo I,美国Epicentre公司),37℃温浴1h,然后75℃灭活15min。
1.2.2.3 iMLDR连接反应 连接反应体系包含10×连接缓冲液 1μl,纯化后多重 PCR 产物 2μl,双蒸水 6μl,高温连 接 酶 0.25μl,5′连接 引物 混 合液(1μmol/L)0.4μl,3′连接引物混合液(2μmol/L)0.4μl,连接酶引物序列分别为 rs3212227:FG5′-TTCCGCGTTCGGACTGATATGCTGATTGTTTCAATGAGCATTTAGCAACG-3′;FP5′-AACTATACAAATACAGCAAAGATATCATTGTGATC-3′;FT5′-TACGGTTATTCGGGCTCCTGTGCTGATTGTTTCAATGAGCATTTAGCAGCT-3′。rs6887695:FC 5′-TGTTCGTGGGCCGGATTAGTCAGTTTGAGAGA-AGCAGTGTAGTGTAGTGTTC-3′;FG5′-TCTCTCGGGTCAATTCGTCCTTCAGTTTGAGAGAAGCAGTGTAGTGTAGTGTTG-3′;FP5′-AATAGTCTGGATTTACATCTTTGATCTTCCA-3′。连接反应条件:94℃ 1min,56℃ 4min,共38个循环;置于4℃保存。
1.2.2.4 基因型判读 取0.5μl稀释后的连接反应产物,与 9μl甲酰胺、0.5μl内标混匀,95℃变性 5min 后用ABI 3730XL测序仪(美国ABI公司)测序。最后采用GeneMapper 4.1软件(美国ABI公司)判读基因型。
1.3 观察指标 观察并比较两组受检者的IL-12B基因多态性;分析IL-12B基因连锁不平衡关系和单倍型,以及IL-12B基因多态性与CD患者病变部位、疾病类型的关系。
1.4 统计学处理 应用SPSS19.0统计软件;计量资料以表示,组间比较采用两独立样本t检验;计数资料以频数和构成比表示,组间比较采用χ2检验;采用χ2检验分析IL-12B 2个SNP位点(rs3212227和rs6887695)的基因型分布是否符合Hardy-Weinberg平衡定律。采用logistic回归分析比较两组间IL-12B 2个SNP位点的等位基因和基因型频率的分布差异,以及IL-12B基因多态性与CD病变部位、类型的相关性。采用Haploview 4.2软件进行连锁不平衡关系与单倍型分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组受检者IL-12B基因多态性比较 对照组受检者IL-12B rs3212227、rs6887695位点的基因型分布符合Hardy-Weinberg平衡定律(均P>0.05)。CD组患者与对照组受检者IL-12B rs3212227、rs6887695位点的基因型与等位基因频率比较均无统计学差异(均P>0.05),见表2。

表2 两组受检者IL-12B基因多态性比较[频次(%)]
2.2 IL-12B基因连锁不平衡关系和单倍型分析 连锁不平衡分析发现rs3212227和rs6887695 2个SNP位点之间存在中等强度的连锁不平衡关系(D′=0.545,r2=0.235),见图1。应用Haploview 4.2软件共构建4种单倍型,在两组受检者间分析上述4种单倍型,结果发现各单倍型频率在两组间分布均无统计学差异(均P>0.05),见表3。
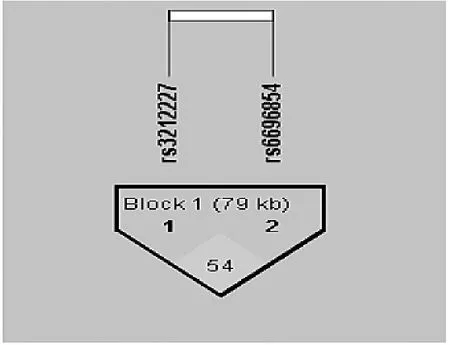
图1 IL-12B基因连锁不平衡模式图(方块中数字代表2个SNP位点间的D′值;Block 1代表IL-12B基因各个SNP位点间存在连锁不平衡)

表3 两组受检者IL-12B基因rs3212227、rs6887695位点4种单倍型比较[频次(%)]
2.3 IL-12B基因多态性与CD病变部位、类型的关系采用非条件logistic回归分析IL-12B基因rs3212227和rs6887695位点的等位基因和基因型频率与CD病变部位的关系,结果发现IL-12B rs6887695位点的基因多态性与CD的病变部位有关(均P<0.05)。与对照组相比,回肠型CD组患者rs6887695位点的C等位基因和GC+CC基因型频率均明显降低(28.75%vs 44.34%,P<0.05,OR=0.507,95%CI:0.291~0.882;50.00%vs 71.70%,P<0.05,OR=0.395,95%CI:0.186~0.836);而 rs3212227和rs6887695位点的等位基因及基因型频率分布在结肠病变CD组和对照组间比较均无统计学差异(均P>0.05)。进一步CD组内分层比较发现,与结肠病变CD组比较,回肠型CD组患者rs6887695位点的C等位基因、GC+CC基因型以及CC基因型频率亦均降低(28.75%vs 50.00%,P<0.05,OR=0.404,95%CI:0.218~0.745;50.00%vs 72.22%,P<0.05,OR=0.385,95%CI:0.163~0.908;7.50%vs 27.78%,P<0.05,OR=0.150,95%CI:0.037~0.613),见表4。根据疾病行为进行分层分析,结果显示IL-12B基因多态性与CD疾病类型无关(P >0.05),见表5。

表4 IL-12B基因多态性与CD病变部位的关系[频次(%)]
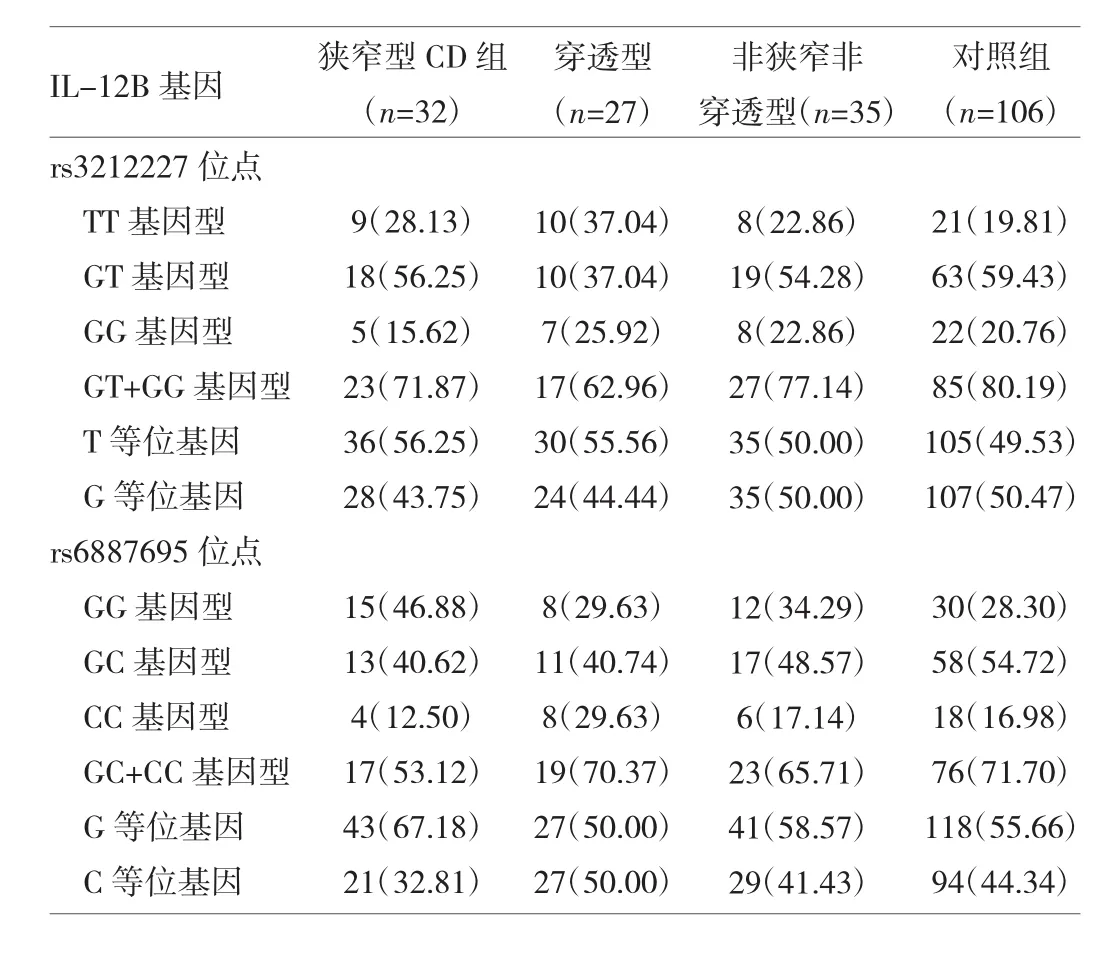
表5 IL-12B基因多态性与CD疾病类型的关系[频次(%)]
3 讨论
IL-12B基因定位于第5号染色体5q31-33区域,全长15kb,包含8个外显子,编码相对分子量为40KD的细胞因子受体样亚基p40。p40与IL-12A基因编码的细胞因子受体样亚基p35通过二硫键连接形成具有生物学活性IL-12。由于人类p35为组成性表达,而p40为调节性表达,因此IL-12B基因对IL-12的表达水平及生物学功能影响意义更大[13]。rs3212227和rs6887695是IL-12B的2个SNP位点,其中rs3212227位于3′非翻译区(UTR)。研究表明该多态性位点可能影响IL-12B mRNA稳定性及IL-12蛋白表达水平[14]。来自健康人群的研究发现rs3212227位点纯合子突变CC基因型携带者外周血单个核细胞活化后所表达的IL-12蛋白水平显著高于AA基因型或AC基因携带者[14]。rs6887695位于IL-12B基因5′上游调控区域,有研究显示该多态性位点可能影响转录因子 TSF1、MZF1、Oct-1、RORα 与DNA片段的亲和力,因此是潜在的功能性位点[10]。迄今的研究已经证实IL-12B(rs3212227和rs6887695)基因多态性与哮喘[15]、银屑病[16]、类风湿性关节炎[17]、Ⅱ型糖尿病[18]等多种免疫系统疾病相关。
本研究对照组受检者IL-12B的突变等位基因G、C的频率分别为49.53%、44.34%,与数据库中千人基因组计划所报道的中国南方人群的最小等位基因频率(MAF)基本相符(rs3212227:47.4%,rs6887695:44.2%)。整体比较结果显示,IL-12B 2个SNP位点(rs3212227和rs6887695)的等位基因和基因型频率在对照组和CD组之间的分布均无统计学差异,表明IL-12B基因多态性与浙江汉族人群CD的易感性无关,这一结论与来自西班牙[19]、瑞典[20]以及新西兰人群[21]的研究发现基本一致,而有学者报道尽管rs3212227多态性与CD易感性无关,但rs6887695突变后增加德国人群CD的发病风险[10]。在亚洲人群的研究中,日本学者在一项纳入484例CD患者的研究结果中首次报道rs6887695纯合子突变CC基因型携带者罹患CD的风险是其他基因型携带者的1.42倍[9]。本研究结果与日本人群及德国人群的研究报道相悖,推测可能与纳入的样本数量及种族遗传背景差异有关。
目前认为,自身遗传多态性与CD患者的疾病表型密切相关。例如Wu等[22]报道芳香烃受体(AhR)基因多态性与回肠型CD密切相关,而与病变累及结肠的CD无关。这一研究结果提示病变局限于回肠的CD和病变累及结肠的CD两者的遗传免疫学发病机制可能存在一定差异。本研究结果表明,rs6887695在对照组和回肠型CD组患者之间有统计学差异。回肠型CD患者中突变C等位基因以及GC+CC基因型频率明显低于对照组,提示rs6887695基因突变可能是浙江汉族回肠型CD的保护因素。此外,组内分层分析亦发现,回肠型CD组患者中rs6887695突变C等位基因和GC+CC基因型以及CC基因型频率均低于结肠病变CD组患者,提示该位点基因突变可能导致CD患者更易累及结肠。国外学者亦曾探讨IL-12B基因多态性与CD疾病部位的关系。Márque[19]等报道IL-12B基因rs3212227和rs6887695位点与西班牙人群CD病变部位及疾病行为均无关。而Ferguson等[21]报道rs6887695位点突变T等位基因是新西兰小肠型CD的保护因素。另有研究表明rs3212227位点多态性可能与结肠型CD相关[10]。目前有关IL-12B基因多态性影响CD疾病部位的分子机制尚不明确。有研究发现尽管单核细胞分泌IL-12水平受其遗传多态性影响,但外源性抗原激活单核细胞是促发IL-12表达的先决条件。有意思的是,IL-12B基因多态性对IL-12表达的影响只在某些特定的抗原如结核菌素、脂多糖诱导下呈现,而在其他抗原如葡萄球菌菌体蛋白诱导下,其基因多态性对IL-12表达无影响[14],这表明IL-12B基因对IL-12表达的影响与环境菌群抗原种类密切相关。由于人类回、结肠中肠道菌群构成迥然各异,笔者推测IL-12B基因对CD病变部位的影响可能是其遗传多态性和肠道菌群抗原差异等多方面因素综合作用的结果。
综上所述,本研究结果显示IL-12B基因rs6887695位点多态性与浙江汉族人群CD的临床表型可能相关,该位点的突变C等位基因、GC+CC基因型可能是回肠型CD的保护因素。由于体内IL-12信号所介导的炎症反应和免疫应答错综复杂,本研究尚不能完全诠释IL-12B对CD临床表型影响的潜在机制,这有待于后续研究进一步探讨。
[1]Lee SH,Kwon JE,Cho ML.Immunological pathogenesis of inflammatoryboweldisease[J].IntestRes,2018,16(1):26-42.
[2]MzesG,Molnár B,TulassayZ,et al.Changes of the cytokine profile in inflammatory bowel diseases[J].World J Gastroenterol,2012,18(41):5848-5861.
[3]Moeintaghavi A,Arab HR,Rahim Rezaee SA,et al.The Effects of Smoking on Expression of IL-12 and IL-1β in Gingival Tissues of Patients with Chronic Periodontitis[J].Open Dent J,2017,11(1):595-602.
[4]Nemeth ZH,Bogdanovski DA,Barratt-Stopper P,et al.Crohn's Disease and Ulcerative ColitisShowUnique Cytokine Profiles[J].Cureus,2017,9(4):e1177.
[5]Pedrotti LP,Sena AA,Rodriguez Galn MC,et al.Intestinal mononuclear cells primed by systemic interleukin-12 display long-term ability to aggravate colitis in mice[J].Immunology,2017,150(3):290-300.
[6]Croxford AL,Kulig P,Becher B.IL-12-and IL-23 in health and disease[J].CytokineGrowthFactorRev,2014,25(4):415-421.
[7]Paradowska-Gorycka A,Sowinsk=a A,Stypińska B,et al.IL-12B Gene Polymorphisms and IL-12 p70 Serum Levels Among Patients with Rheumatoid Arthritis[J].Scand J Immunol,2017,85(2):147-154.
[8]Xu Z,Pei L,ZhangF,et al.Afunctional variant in IL12Bpromoter modulates its expression and associates with increased risk of allergic asthma[J].GenesImmun,2013,14(4):238-243.
[9]Yamazaki K,Takahashi A,Takazoe M,et al.Positive association of genetic variants in the upstream region of NKX2-3 with Crohn's disease in-Japanesepatients[J].Gut,2009,58(2):228-232.
[10]Glas J,Seiderer J,Wagner J,et al.Analysis of IL12B Gene Variants in Inflammatory Bowel Disease[J].PLoS One,2012,7(3):e34349.
[11]Wang EY,Yang Q,Liao ZG.Association of polymorphisms in interleukin (IL)-12A and-B genes with rheumatoid arthritis in a Chinese population[J].ClinExpImmunol,2015,180(1):83-89.
[12]中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见(2012年,广州)[J].中华内科杂志,2012,51(2):796-813.
[13]Pravica V,Brogan IJ,Hutchinson IV.Rare polymorphisms in the promoter regions of the human interleukin-12 p35 and interleukin-12 p40 subunit genes[J].Eur J Immunogenet,2000,27(1):35-36.
[14]Yilmaz V,Yentür SP,Saruhan-Direskeneli G.IL-12 and IL-10 polymorphisms and their effects on cytokine production[J].Cytokine,2005,30(4):188-194.
[15]Padrón-Morales J,Sanz C,Dávila I,et al.Polymorphisms of the IL12B,IL1B,and TNFAgenesand susceptibilityto asthma[J].J InvestigAllergolClinImmunol,2013,23(7):487-494.
[16]Chandra A,Senapati S,Ghosh S,et al.Association of IL12B risk haplotypeandlackofinteractionwithHLA-Cw6amongthe psoriasispatients inIndia[J].JHumGenet,2017,62(3):389-395.
[17]Paradowska-Gorycka A,Sowinska A,Stypińska B,et al.IL-12B Gene Polymorphisms and IL-12 p70 Serum Levels Among Patients with Rheumatoid Arthritis[J].Scand J Immunol,2017,85(2):147-154.
[18]Eirs N,Gonzlez-Lara L,Santos-Juanes J,et al.Genetic variation at IL12B,IL23R and IL23A is associated with psoriasis severity,psoriatic arthritis and type 2 diabetes mellitus[J].J Dermatol Sci,2014,75(3):167-172.
[19]Mrquez A,Mendoza JL,Taxonera C,et al.IL23R and IL12B PolymorphismsinSpanishIBDPatients:NoEvidence ofInteraction[J].Inflamm BowelDis,2008,4(9):1192-1196.
[20]TrkvistL,HalfvarsonJ,OngRT,etal.Analysisof39 Crohn′sDisease Risk Loci in Swedish InflammatoryBowel Disease Patients[J].Inflamm BowelDis,2010,16(6):907-909.
[21]Ferguson LR,Han DY,Fraser AG,et al.IL23R and IL12B SNPs and Haplotypes Strongly Associate with Crohn's Disease Risk in a New Zealand Population[J].Gastroenterol Res Pract,2010,2010:539461.
[22]Wu CQ,Cao SG,Xia XP,et al.Association of Crohn's disease with aryl hydrocarbon receptorgene polymorphismsand haplotypes[J].ZhonghuaNeiKeZaZhi,2018,57(1):37-43.
