双氢青蒿素对MRL/lpr SLE小鼠CD4+T细胞基因组DNA甲基化水平的影响研究
2018-06-14陈红波项晓骏范军芬郭小文寿旗扬马红珍范永升
陈红波 项晓骏 范军芬 郭小文 寿旗扬 马红珍 范永升
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种自身免疫介导引起多脏器损伤的弥漫性结缔组织病,需要长期用药治疗。但长期应用激素类和免疫抑制剂类药物会引发严重的不良反应[1]。青蒿素作为祖国传统医药的代表在治疗疟疾上取得了令人瞩目的成绩,近年来研究发现青蒿素类衍生物在SLE的治疗上也有一定作用[2]。青蒿素类衍生物SM934可以减少SLE小鼠自身抗核抗体产生,减轻小鼠肾损伤,延长SLE小鼠生命[3]。DNA甲基化调控在SLE发生、发展中起重要作用,SLE患者CD4+T细胞基因组DNA普遍存在低甲基化,这种低甲基化状态可诱导SLE发病或加重[4-5]。基于此,本研究旨在探讨青蒿素类衍生物双氢青蒿素是否通过影响MRL/lpr SLE小鼠CD4+T细胞DNA甲基化水平,从而发挥其治疗作用,现报道如下。
1 材料和方法
1.1 材料 6周龄SPF级雌性MRL/lpr SLE小鼠5只,体重(31.6±1.9)g,由上海莱克实验动物有限责任公司提供。RPMI1640培养液(美国Gibco公司)、FBS(美国Hyclone公司)、双氢青蒿素(纯度98%)(上海伊卡生物技术有限公司)、CD4(L3T4)-MicroBeads Kit(德国 MiltenyiBiotec公司)、Anti-mouse CD3-FITC(美国Abcam公司)、Anti-mouse CD4-PE(美国 Abcam公司)、Cell Counting Kit-8(CCK-8)(七海生物公司)、TIANamp Genomic DNA Kit(美国TIANGEN公司)、流式细胞仪(美国BD公司)、倒置显微镜(日本OLYMPUS公司)、高效液相色谱仪LC-10ATvp(日本岛津公司)。
1.2 方法
1.2.1 磁珠抗体分选CD4+T细胞 处死MRL/Lpr SLE小鼠后,无菌条件下取出脾脏,制备脾脏单核细胞悬液(107个/ml)。取1×107个细胞用PBS重悬细胞,按照免疫磁珠分选柱说明书操作分离CD4+T细胞,流式细胞仪检测CD4+T细胞纯度。
1.2.2 细胞原代培养、传代、分组及药物干预 从小鼠脾脏分离出来的CD4+T原代细胞,进行培养传代(37℃、RPMI1640细胞培养液、5%二氧化碳培养箱),传至第3代后进行药物干预。
1.2.3 CCK-8检测双氢青蒿素细胞毒性 将稀释后的CD4+T细胞加入96孔细胞培养板,每孔加入1×104个细胞,每孔依次加入不同剂量的双氢青蒿素,使其终浓度为 0、10、20、40、60、80、100μmol/L(分别为对照组,10、20、40、60、80、100μmol/L 组),设置 3 个重复孔及空白对照(不加细胞);37℃,5%二氧化碳饱和湿度培养48h,加入 20μmol/L CCK-8,避光孵育 1h;酶标仪测定每孔450nm波长吸光度,计算半抑制浓度(IC50)和双氢青蒿素的细胞毒性。
1.2.4 高效液相色谱检测基因组DNA甲基化水平
1.2.4.1 基因组DNA提取和水解:按照DNA提取试剂盒说明书提取基因组DNA,然后将1μg DNA样品溶于3μl去离子水中,高温变性后冰浴,加入1μl 0.1mol/L醋酸铵(pH5.3)、1μl核酸酶 P1(2U/μl)、1μl 1mol/L 碳酸氢铵(pH5.3)和 1μl磷酸二酯酶(0.002U/μl),在 37℃下反应2h后加入1μl碱性磷酸酶(0.5U/μl),继续反应1h。水解完全的DNA样品冻存在-20℃待分析。
1.2.4.2 高效液相色谱检测基因组DNA甲基化水平采用岛津液相色谱系统(LC-10AT vp),根据5种碱基的性质和分离效果,得到最佳色谱条件如下:色谱柱,phenomenex C18 柱 (4.6~250mm,5μm);流动相,0.01mol/L磷酸二氢钾:甲醇(体积比15:85);柱温,25℃;流速,1.2ml/min;检测波长,260nm;进样量,20μl。腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶标准品的浓度为1、5、10、50、100μmol/L,5- 甲 基 胞 嘧 啶 为 0.05、0.25、0.50、2.50、5.00μmol/L,用于制备标准曲线。
1.2.5 荧光定量PCR检测DNA甲基化转移酶1(DNMT1)、生长阻滞和 DNA 损伤基因 a(Gadd45a)mRNA表达水平(1)RNA抽提:利用Trizol抽提MRL/lpr SLE小鼠CD4+T细胞总RNA,紫外分光光度计测定浓度。(2)逆转录:反应体系为(20.0μl):total RNA(5μl),Random Primer p(dN)6(0.2μg/μl,1μl),Rnase-free ddH2O(5μl),5×Reaction Buffer(4.0μl),dNTP Mix(10mmol/L,2.0μl),Rnase inhibitor(20U/μl,1.0μl),AMV Reverse Transcriptase(10U/μl,2.0μl)。(3)PCR 扩增:引物如下:反应体系(20μl):ddH2O(7μl),2×SYBR Premix Ex TaqTM(10μl),引物 F(10μmol/L,1.0μl),引物 R(10μmol/L,1.0μl),模板 cDNA(1.0μl)。反应条件:95℃(3min);40 个循环(95℃,15sec);60℃,40sec(收集荧光)。完成上述步骤后,把加好样品的96孔板放在荧光定量PCR仪中进行反应。
1.2.6 Western blot检测DNMT1和Gadd45a蛋白表达水平 将蛋白样品加入4×SDS缓冲液中,沸水煮沸后12 000g离心1min;取一定量总蛋白加入SDS-PAGE凝胶上样孔内,垂直电泳槽跑胶电泳后,将PVDF膜在甲醇中浸泡,转移电泳槽转膜后,将PVDF膜至于Blocking Buffer中,加入一抗,4℃孵育过夜,洗涤后加入二抗,室温孵育2h,洗涤将PVDF膜平放在显色板上,ECL底物滴加在膜表面,化学发光仪收集信号。
1.3 观察指标 (1)比较不同浓度双氢青蒿素对CD4+T细胞的毒性;(2)比较不同双氢青蒿素浓度组CD4+T细胞基因组DNA甲基化水平;(3)比较不同双氢青蒿素浓度组CD4+T细胞DNMT1和Gadd45a mRNA表达水平;(4)比较不同双氢青蒿素浓度组CD4+T细胞DNMT1和Gadd45a蛋白表达水平。
1.4 统计学处理 应用SPSS 19.0统计软件;计量资料以表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验;P<0.05为差异有统计学意义。
2 结果
2.1 分选后CD4+T细胞的纯度 应用免疫磁珠法分选CD4+T细胞,结果显示纯度达到89.96%,分选后的CD4+T细胞状态良好,满足后续实验需求。
2.2 不同浓度双氢青蒿素对CD4+T细胞的毒性比较对照组,10、20、40、60、80、100μmol/L 组 CD4+T 细胞450nm 波长吸光度分别为 0.935±0.022、0.846±0.012、0.677±0.012、0.627±0.019、0.486±0.014、0.351±0.017、0.262±0.013,10、20、40、60、80、100μmol/L 组 CD4+T 细胞抑制率分别为 10.07%、29.12%、34.72%、50.66%、65.88%、75.91%。双氢青蒿素对SLE小鼠CD4+T的IC50为62μmol/L。双氢青蒿素可抑制CD4+T细胞增殖,且在实验范围内,随着浓度的增加,对CD4+T细胞增殖的抑制作用增强。
2.3 不同双氢青蒿素浓度组CD4+T细胞基因组DNA甲基化水平比较 对照组与40、60、80μmol/L组CD4+T细胞基因组DNA甲基化水平分别为(3.114±0.122)%、(3.375±0.071)%、(3.540±0.076)%、(3.639±0.104)%,组间比较差异有统计学意义(P<0.05),组间两两比较差异亦均有统计学意义(均P<0.05)。即双氢青蒿素处理后,CD4+T细胞基因组DNA甲基化水平显著升高;且双氢青蒿素浓度越高,基因组DNA甲基化水平越高。
2.4 不同双氢青蒿素浓度组CD4+T细胞DNMT1和Gadd45a mRNA表达水平比较 见表1。
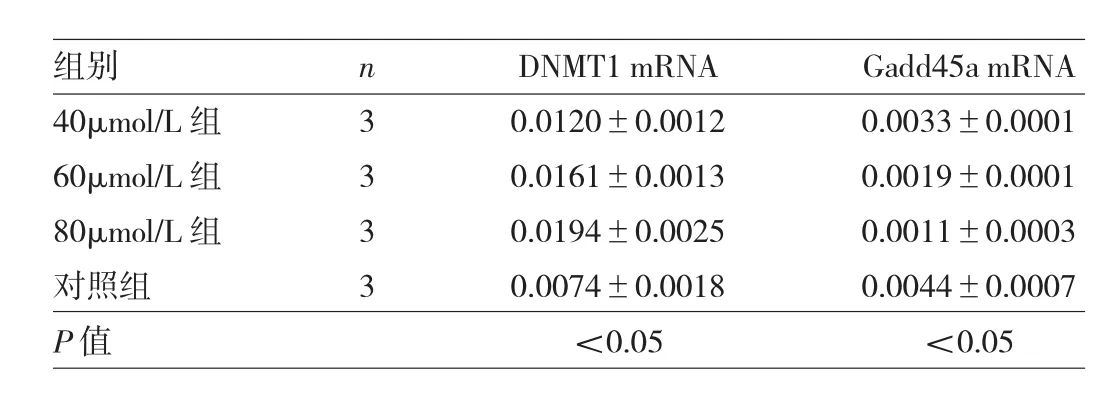
表1 不同双氢青蒿素浓度组CD4+T细胞DNMT1和Gadd45a mRNA表达水平比较
由表1可见,不同双氢青蒿素浓度组CD4+T细胞DNMT1和Gadd45a mRNA表达水平比较均有统计学差异(均P<0.05),组间两两比较差异亦均有统计学意义(均P<0.05)。即双氢青蒿素处理后,CD4+T细胞DNMT1 mRNA表达上调,而Gadd45a mRNA表达下调;且双氢青蒿素浓度越高,DNMT1 mRNA表达水平越高,Gadd45a mRNA表达水平越低。
2.5 不同双氢青蒿素浓度组CD4+T细胞DNMT1和Gadd45a蛋白表达水平比较 见图1、表2。
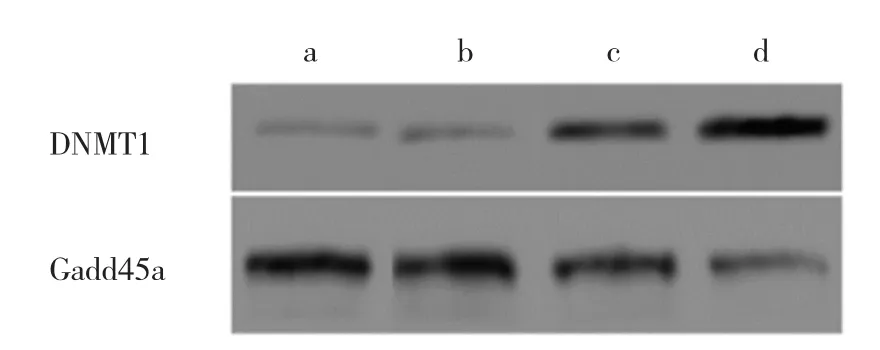
图1 不同双氢青蒿素浓度组CD4+T细胞DNMT1和Gadd45a蛋白表达电泳图(a:对照组;b:40μmol/L 组;c:60μmol/L 组;d:80μmol/L 组)
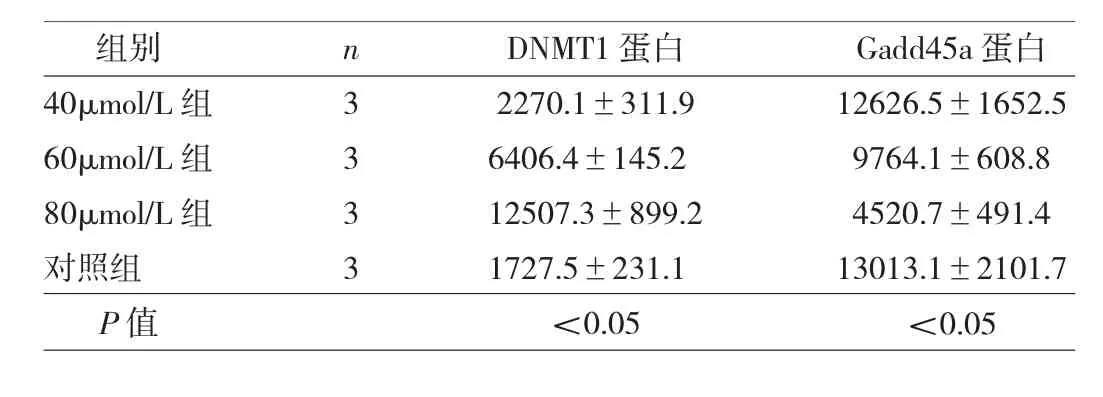
表2 不同双氢青蒿素浓度组CD4+T细胞DNMT1和Gadd45a蛋白表达水平比较
由图1、表2可见,不同双氢青蒿素浓度组CD4+T细胞DNMT1和Gadd45a蛋白表达水平比较均有统计学差异(均P<0.05),组间两两比较差异亦均有统计学意义(均P<0.05)。即双氢青蒿素处理后,CD4+T细胞DNMT1蛋白表达上调,而Gadd45a蛋白表达下调;且双氢青蒿素浓度越高,DNMT1蛋白表达水平越高,Gadd45a蛋白表达水平越低。
3 讨论
SLE是一种机体免疫功能异常导致多系统受损的慢性自身免疫性疾病[6]。SLE患者CD4+T细胞基因组DNA普遍存在低甲基化,这与SLE患者体内甲基化调节基因表达异常有关[4-5]。DNMT1是DNA甲基化转化过程中最关键的限速酶,维持基因组DNA甲基化水平,其酶活性与浓度与甲基化水平呈正相关。在SLE患者中,DNMT1浓度及酶活性明显下降,导致基因组DNA呈低甲基化[7]。Gadd45a是一种重要的DNA甲基化抑制蛋白,它通过促进DNA修复,去除DNA甲基化标记,诱导甲基化敏感基因表达。Gadd45a基因在SLE患者CD4+T细胞中高表达,与SLE病情严重程度呈显著正相关[8-9]。
屠呦呦课题组发现双氢青蒿素治疗SLE疗效肯定,且无明显毒副反应[10]。Huang等[11]发现双氢青蒿素可能是通过抑制TLR4/IRF/IFN信号通路,从而抑制LPS诱导的脾细胞活化,显著减少LPS诱导的脾细胞中IFN-α和IFN-β的产生,起到对MRL/lpr狼疮鼠的治疗作用。徐丽敏等[12]发现双氢青蒿素通过阻止B细胞增殖,促进CD8+T细胞增殖,从而直接和间接抑制B细胞活性,减少自身免疫抗体产生,达到治疗SLE的作用。
本研究结果发现,双氢青蒿素通过上调DNMT1表达和下调Gadd45a表达,升高SLE小鼠CD4+T细胞基因组DNA甲基化水平,从而减少自身免疫抗体产生,进而达到治疗SLE的作用。本研究主要是在体外细胞实验中证实了双氢青蒿素对SLE小鼠的治疗作用,在小鼠体内探讨其生物学作用将是进一步研究的方向。
[1]中华医学会风湿病学分会.系统性红斑狼疮诊断及治疗指南[J].中华风湿病杂志,2010,14(5):342-346.
[2]杨岚,张东.双氢青蒿素及其红斑狼疮新适应症研究概述[J].科学通报,2017,62(18):2007-2012.
[3]Hou LF,He SJ,Li X,et al.Oral administration of artemisinin analog SM934 ameliorates lupus syndromes in MRL/lpr,mice by inhibiting Th1and Th17cell responses[J].Arth Rheum,2011,63(8):2445-2455.
[4]Dipak RP,Bruce CR.Epigenetic mechanisms in lupus[J].Current Opinion in Rheumatology,2010,22(5):478-482.
[5]Javierre BM,Fernandez AF,Richter J.Changes in the pattern of DNA methylation associate with twin discordance in systemic lupus erythematosus[J].Genome Res,2010,20(2):170-179.
[6]Tsokos GC.Systemic lupus erythematosus[J].N Engl J Med,2011,365(22):2110-2121.
[7]Balada E,Ordi-Ros J,Serrano-Acedo S,et al.Transcript levels of DNA methyltransferases DNMT1,DNMT3A and DNMT3B in CD4+T cells from patients with systemic lupus erythematosus[J].Immunology,2008,124(3):339-347.
[8]Barreto G,Schfer A,Mar=hold J,et al.Gadd45a promotes epigenetic gene activation by repair-mediated DNA demethylation [J].Nature,2007,445(7128):671-675.
[9]Yaping Li,Ming Zhao,Heng Yin,et al.Qianjin Lu.Overexpression of the Growth Arrest and DNA Damage-Induced 45a Gene Contributes to Autoimmunity by Promoting DNA Demethylation in Lupus T Cells[J].Arthritis Rheum,2010,22(5):1438-1447.
[10]屠呦呦,杨岚.治疗红斑狼疮和光敏性疾病的含双氢青蒿素的药物组合物[P].中华人民共和国专利:99103346.9,2003-07-30.
[11]Huang X,Xie Z,Liu F,et al.Dihydroartemisinin inhibits activation of the Toll-like receptor 4 signaling pathway and production of type I interferon in spleen cells from lupus-prone MRL/lpr mice[J].Int Immunopharmacol,2014,22(1):266-272.
[12]徐丽敏,陈学荣,屠呦呦.双氢双氢青蒿素对狼疮性BXSB小鼠的作用[J].中国中西医结合皮肤性病学杂志,2002,1(1):19-20.
