高温致密碳酸盐岩与胶凝酸酸岩反应速率测试方法研究
2018-06-13王琨,詹立,苟波,3
王 琨, 詹 立, 苟 波,3
(1西南石油大学石油与天然气工程学院 2西南石油大学油气藏地质及开发工程国家重点实验室 3西南石油大学博士后科研流动站)
碳酸盐岩酸岩反应速率的测量是获取酸岩反应动力学参数最直接最重要的方法,总结起来主要有3种方法:①失重法测定岩石矿物的消耗量。Nasr-EL-Din[1]等采用失重法计算碳酸盐岩酸岩反应速率,其主要原理是测量酸岩反应前后岩盘的质量差;②酸碱中和滴定法测定酸液的消耗量。李沁[2]等通过样口取样,利用NaOH标准溶液滴定反应前后溶液中H+浓度的变化从而确定酸岩反应速率;③Ca2+、Mg2+浓度变化(AAS法或ICP法)测定反应产物生成量。Alkhaldi[3-6]等通过样口取样,采用电感耦合等离子体发射光谱仪(ICP)或者原子吸收分光光度计(AAS)测量反应前后溶液中Ca2+、Mg2+浓度的变化来确定酸岩反应速率,从而为酸岩反应动力学参数的求取提供依据。大量的学者采用这些方法中的一种进行酸岩反应速率的测量[7-11],但采用这些方法测量反应速率时均未考虑实验条件、岩盘物性以及酸液体系带来的影响,鲜有对比分析这些方法的适用性和可靠性。为此,笔者选取川西某工区井下致密碳酸盐岩岩心和现场使用的胶凝酸体系开展高温条件下酸岩反应速率测试方法研究,对比分析3种测试方法的测量结果的可靠性和方法适用性,从而为高温条件下致密碳酸盐岩酸岩反应速率的测量方法的选取提供依据。
一、酸岩反应速率的测量方法
1.酸碱中和滴定法测定酸液的消耗量
利用酸碱中和滴定装置,配制标准碱液滴定反应前后溶液中H+浓度的变化量ΔC,即直接确定酸岩反应前后酸液的消耗量(式(1)),并考虑面容比影响,由式(2)确定酸岩反应速率:
(1)
(2)
式中:CHCl—酸岩反应后酸液浓度,mol/L;VHCl—滴定所取酸液体积,mL;CNaOH—滴定所用标准碱液浓度,mol/L ;VNaOH—滴定消耗标准碱液体积,mL;J—酸岩反应速率,mol/(cm2·s);ΔC—酸消耗量,mol/L;t—反应时间,s;V—酸液体积,L;S—岩心反应表面积,cm2。
2.失重法测定岩石矿物的消耗量
失重法主要原理是通过测量灰岩或者白云岩反应前后质量差Δm,计算出酸液消耗量ΔC(式(3)、式(4)),再由式(2)确定酸岩反应速率。
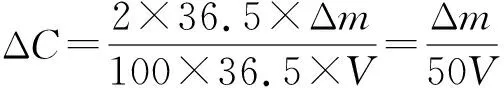
(3)

(4)
式中:Δm—岩心反应前后质量差,g。
3.钙镁离子浓度变化法测定反应产物生成量
利用等离子发射仪(ICP)或原子吸收光谱仪(AAS)测定反应后溶液中Ca2+、Mg2+的浓度变化值ΔP,确定酸液消耗量(式(5)、式(6))ΔC,再由式(2)确定酸岩反应速率。
灰岩:ΔC=2ΔP
(5)
白云岩:ΔC=4ΔP
(6)
式中:ΔP—Ca2+、Mg2+的浓度变化值,mol/L。
二、致密碳酸盐岩酸岩反应速率测试实验
1.实验仪器材料与实验方案设计
主要采用的实验仪器包括CRS-1000-35型旋转岩盘酸反应及腐蚀测试仪、Haake Mars III型流变仪、高精度天平、AA-7020型原子吸收分光光度计、碱式滴定管等。酸液体系为HCl+0.5%缓蚀剂+0.8%胶凝剂的胶凝酸,选用的岩心为井下致密灰色粉晶白云岩,岩心平均孔隙度为4.4%、平均渗透率为0.37 mD(表1)。
反应釜压力设置7 MPa,酸岩反应总时间为20 min,每5 min取一次酸液样品,总共取样4次,分别用3种方法计算酸岩反应速率,详细实验方案如表1所示。
2. 实验结果分析与讨论
2.1 胶凝酸流变性能测试
利用Haake Mars Ⅲ型流变仪进行胶凝酸的定温变剪切实验测试,获取胶凝酸的流变性能参数。实验温度为110℃,剪切速率变化范围为0.1~500 s-1。
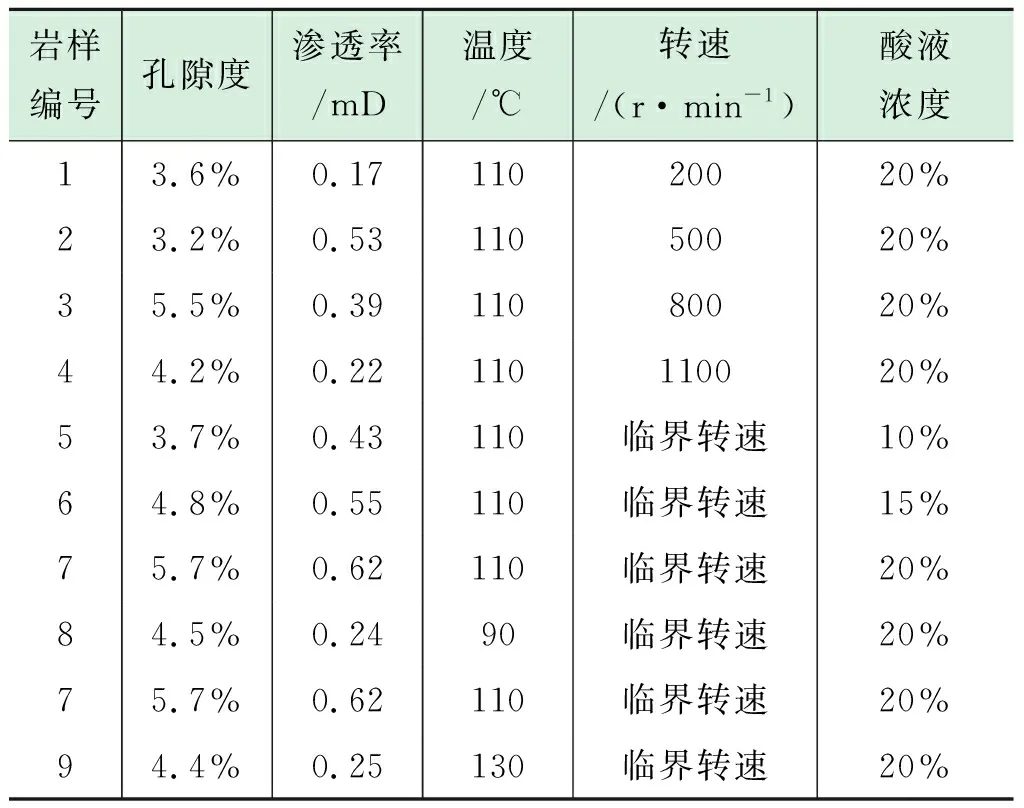
表1 实验方案
由图1可知,该胶凝酸在实验条件下的稠度系数K为1 123.7 Pa·sn,流态指数n为0.196,170 s-1下的表观黏度为18.1 mPa·s。
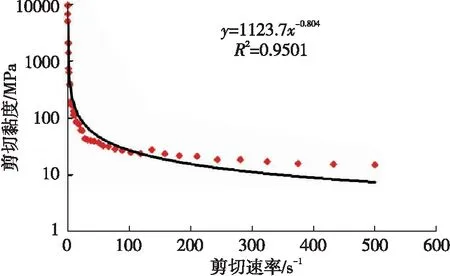
图1 酸液表观黏度随剪切速率的变化
2.2 酸岩反应速率不同测试方法对比
在设置实验条件下,酸岩反应20 min后,分别采用3种方法计算反应速率随转速的变化关系。由图2可知,采用失重法和钙镁离子浓度变化法计算反应速率时,随着转速的增加,液固界面处离子传质速率增加,酸岩反应速率相应增加,此时酸岩反应速率受离子传质速率控制;当转速超过500 r/min时,随着转速的增加反应速率趋于稳定,表明此时酸岩反应速率受转速变化影响较小,即受离子传质速率影响较小,此时系统反应速率主要受表面反应速率控制,因此可确定500 r/min为该实验条件下的临界转速[11],因此采用失重法和AAS法可以明显观察到致密碳酸盐岩与胶凝酸酸岩反应由受离子传质控制到受表面反应速率控制的完整过程,准确揭示了酸岩反应机理。
利用滴定法计算酸岩反应速率时,反应速率随转速的变化关系较为复杂,当转速小于500 r/min,酸岩反应速率也是随转速增加而增加,但转速大于500 r/min时,酸岩反应速率却出现了明显的下降,且计算所得系统反应速率是失重法的2倍,是钙镁离子浓度变化法的3倍。

图2 反应速率随转速的变化
由旋转圆盘测试酸岩反应速率的数学模型确定H+有效传质系数[9]。根据式(7)作F和ω1/(1+n)的关系曲线,斜率即为De2/3,分别求得不同方法下的H+有效传质系数De。其中滴定法所得De为1.1×10-5cm2/s ,AAS法De为2.8×10-6cm2/s,失重法De为8.0×10-6cm2/s。由计算结果知,滴定法测得的H+有效传质系数De最大,是AAS法的3.9倍,失重法的1.38倍,AAS法和失重法测试计算结果较为接近。
(7)

(8)
(9)
式中:K—稠度系数,g/(cm·s-2n);ρ—混合液密度,g/cm3;R—岩心半径,m;C0—初始酸液浓度,mol/mL;w—角速度,s-1;De—H+有效传质系数,cm2/s;n—流态指数,a与n的取值关系见表2。

表2 a与n的取值关系
为进一步揭示3种实验方法所得传质系数计算结果差异大的原因,将从实验原理及实验方法客观存在的原因逐一分析。图3为岩心反应20 min后质量损失与转速的关系,可以明显看到岩心质量损失以500 r/min为界呈现两个典型的不同区域,这是由于当转速小于500 r/min时,随着转速增加,扩散边界层厚度减小,H+传质速率增加[1],酸岩反应速率增加,岩盘损耗量增加,即失重增加。当转速超过500 r/min时,随着转速的增加,岩盘失重保持稳定,此时酸岩反应速率主要受表面反应速率控制,转速变化对反应速率较小,即岩心损耗量稳定。
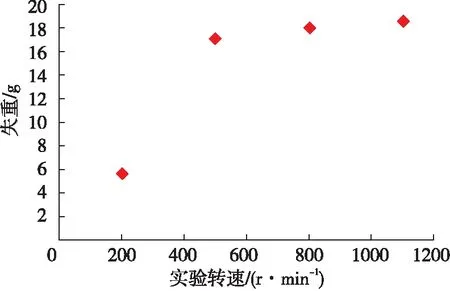
图3 岩盘失重随实验转速的变化
图4为采用AAS方法测得反应产物Ca2+,Mg2+浓度变化,可知随着转速的增加,Ca2+,Mg2+浓度增加,当转速超过500 r/min时,转速对Ca2+,Mg2+浓度的影响不大,即临界转速为500 r/min,此时离子浓度随转速变化的规律与采用失重法获取的岩心质量损失与转速的关系一致[13]。在同一转速下,随着反应时间的增加,Ca2+,Mg2+浓度先增加,当反应时间大于10 min时,此时反应时间对Ca2+,Mg2+浓度影响不明显。这是由于随着酸岩反应的继续进行,在液固界面生成了如图5所示薄膜状黑色物质,该物质附着在岩盘反应表面,形成了物理障碍,阻碍了H+和生成物Ca2+,Mg2+离子的传质[14],因此酸岩反应时间的持续增加对反应速率的影响较小;另一方面,由于实验测试温度高(大于90℃),取样口即使采用了冷却措施,但仍然形成了酸雾,酸液的挥发不可避免的会影响溶液中Ca2+,Mg2+离子损失,从而使测得的酸岩反应速率小于失重法所得反应速率(图2)。

图4 钙镁离子浓度随时间的变化

图5 酸岩反应后的实验岩心
采用酸碱中和滴定法测试的酸液样品中H+浓度变化,可知随着时间的增加, H+浓度整体上呈下降趋势(图6),当转速超过500 r/min时,H+浓度随转速的变化不大。500 r/min条件下的H+浓度变化量大于800 r/min和1 100 r/min条件下的H+浓度变化量,出现这一情况的原因可能有:酸碱中和滴定时,滴定终点全凭实验人员肉眼观察溶液颜色变化,滴定管的误差和人为操作误差对实验结果均有明显影响;另一方面高温取样时酸液的挥发,也会影响H+浓度的准确监测。

图6 H+浓度随时间的变化
通过采用3种不同的方法求取并对比分析了高温条件下致密碳酸盐岩与胶凝酸反应速率测试结果,结果表明,AAS法和失重法均可正确揭示致密碳酸盐岩与胶凝酸的反应规律;受高温取样影响,相同条件下AAS法获得的酸岩反应速率低于失重法结果。酸碱中和滴定法受高温取样和实验操作误差大双重影响,所得酸岩反应速率规律性较差,可靠性较差。因此对于高温条件下致密碳酸盐岩与胶凝酸的反应速率测试,失重法获得结果较为可靠。
三、结论
(1)失重法和AAS法可以清楚揭示胶凝酸与致密碳酸盐岩反应速率受传质控制和受反应速率控制的两个过程,而酸碱中和滴定法未能清晰揭示这一规律;H+传质系数计算结果表明,酸碱中和滴定法所得结果是AAS法的3.9倍,失重法的1.38倍。
(2)受高温取样酸液挥发因素影响,AAS法计算结果较失重法小;受高温取样酸液挥发和实验测量方法双重误差影响,酸碱中和滴定法计算结果明显偏大,且揭示的酸岩反应规律较差;因此失重法是高温条件下测量致密碳酸盐岩与胶凝酸反应速率相对可靠的方法。
[1]Nasr-El-Din H A, Al-Mohammed A M, Al-Aamri A, et al. Reaction of Gelled Acids With Calcite[J]. SPE Production & Operations, 2008, 23(3):353-361.
[2]李沁.高黏度酸液酸岩反应动力学行为研究[D].成都: 成都理工大学,2013.
[3]李颖川.采油工程[M].石油工业出版社,2009.
[4]何春明,陈红军,翟锐,等.乳化酸酸岩反应动力学实验研究[J].油田化学,2009,26(3):245-250.
[5]Al-Khaldi M H, Nasr-El-Din H A, Sarma H K. Kinetics of the Reaction of Citric Acid With Calcite[J]. SPE Journal, 2010, 15(3):704-713.
[6]Rabie A I, Gomaa A M, Nasr-El-Din H A. Reaction of In-Situ-Gelled Acids With Calcite: Reaction-Rate Study[J]. SPE Journal, 2011, 16(4):981-992.
[7]Rabie A I, Shedd D C, Nasr-El-Din H A. Measuring the Reaction Rate of Lactic Acid With Calcite and Dolomite by Use of the Rotating-Disk Apparatus[J].SPE Journal,2014,19(6):1192-1202.
[8]Sayed M, Nasr-El-Din H A, Nasrabadi H. Reaction of Emulsified Acids With Dolomite[J]. Journal of Canadian Petroleum Technology, 2013, 52(3):164-175.
[9]张德政.塔中地区鹰山组碳酸盐岩酸岩反应规律研究[D].成都: 西南石油大学,2015.
[10]Khalid M A, Sultan A, Qiu X. Revisiting Reaction Kinetics and Diffusion Rate of Dolomitic Rock with HCl[C].SPE 185832,2015.
[11]Arslan E, Sokhanvarian K, Nasr-El-Din H A, et al. Reaction Rate of a Novel In-Situ Generated HCl Acid and Calcite[C].SPE 187059,2017.
[12]Ali S A, Kalfayan L, Montgomery C T. Acid Stimulation[M]. Society of Petroleum Engineers, 2016.
[13]Rabie A I, Shedd D C, Nasr-El-Din H A. Measuring the Reaction Rate of Lactic Acid With Calcite and Dolomite by Use of the Rotating-Disk Apparatus[J].SPE Journal, 2014, 19(6):1192-1202.
[14]Rabie A I. Reaction of calcite and dolomite with in-situ gelled acids, organic acids, and environmentally friendly chelating agent (GLDA)[J]. Dissertations & Theses-Gradworks, 2012.
