HPLC法快速检测重组人神经生长因子原液中醋酸残留量
2018-06-13白羊章永垒李义嘉黄奋飞陈胜亮王明灶陈星
郭,白羊,章永垒,李义嘉,黄奋飞,陈胜亮,王明灶,陈星
HPLC法快速检测重组人神经生长因子原液中醋酸残留量
361009 厦门,未名生物医药有限公司
神经生长因子(nerve growth factor,NGF)是最早发现的神经营养因子,其在神经细胞的生长、发育、分化、存活和损伤神经修复中起着重要的作用[1]。目前,临床采用鼠颌下腺提取的 NGF 用于各类神经损伤的修复,疗效显著[2]。由中国仓鼠卵巢细胞(CHO 细胞)表达的重组人神经生长因子(rhNGF)相较于鼠神经生长因子(mNGF)具有活性更高、免疫风险更低的特点,具有广阔的市场前景[3]。
CHO 细胞属于外源细胞,其重组表达的蛋白、单克隆抗体等生物制品中可能会出现病毒污染,采用适宜的手段(如低 pH 孵育法)进行病毒灭活能有效提高生物制品的安全性[4]。在 CHO 细胞重组表达 rhNGF 工艺中,使用醋酸调节 pH 进行病毒灭活,再进一步超滤即得 rhNGF 原液。但醋酸属于国际人用药品注册技术协调会(ICH)规定的第三类溶剂,需要对产品中醋酸残留量进行检测[5]。高效液相色谱(HPLC)法是药品检测中应用最为广泛的检测方法,但目前尚无 HPLC 法检测生物制品中醋酸含量的报道。本研究提供了一种能快速检测醋酸含量的 HPLC 方法,以检测 rhNGF 原液中的醋酸残留量,为 rhNGF 的研发与生产提供技术基础。
1 材料与方法
1.1 材料
Waters e2695 HPLC 仪、Waters 2998 PAD 检测器、Empower 3 色谱工作站为美国 Waters 公司产品;十万分之一电子天平为德国 Mettler Toledo公司产品;Milli-Q 纯水器为美国 Millipore 公司产品。HP-C18 色谱柱(4.6 mm × 250 mm,5 μm)购自美国 Sepax 公司;醋酸对照品、NaH2PO4均购自比利时 Acros Organics 公司,纯度 99.8%;色谱级甲醇购自美国 Fisher Chemical 公司;rhNGF 各工艺步骤原液(批次 20170401、20170402、20170403)由未名生物医药有限公司提供。
1.2 方法
1.2.1 HPLC 方法 流动相为 10 mmol/L NaH2PO4水溶液(pH 2.98):甲醇= 95:5,流速 1.0 ml/min;检测波长 210 nm;柱温 30 ℃;进样量 20 μl。
1.2.2 对照品溶液制备 精密称取醋酸对照品 25.000 mg,置于 25 ml 量瓶中,以流动相溶解,定溶,配制成 1 mg/ml 醋酸对照品储备液。精密量取上述醋酸对照品储备液适量于 25 ml 量瓶中,流动相稀释至刻度,以 0.45 μm 滤膜滤过,即得不同浓度对照品溶液。
1.2.3 供试品溶液制备 精密量取 rhNGF 原液制备中使用醋酸的相关步骤样品,包括低 pH 孵育前样品、低 pH 孵育样品、rhNGF 原液(超滤后样品),根据醋酸浓度以流动相稀释,以 0.45 μm 滤膜滤过,即得相应供试品溶液。
1.2.4 精密度试验 精密量取醋酸对照品储备液适量,制备成 0.25 mg/ml 醋酸对照品溶液重复样 6 份,按“1.2.1”项下色谱条件测定,记录峰面积,计算相对标准偏差(RSD)。
1.2.5 专属性试验 分别取流动相、对照品溶液(醋酸浓度 0.1 mg/ml)、供试品溶液(rhNGF 原液)、供试品加标溶液(醋酸加标浓度 0.1 mg/ml),按“1.2.1”项下色谱条件测定,判断对测量是否有干扰。
1.2.6 标准曲线制备与线性关系考察 精密量取醋酸对照品储备液适量,制备成 0.01、0.05、0.10、0.25、0.50、1.00 mg/ml 的系列对照品溶液。按“1.2.1”项下色谱条件进行分析测定,以对照品浓度(mg/ml)为横坐标,峰面积()为纵坐标,绘制标准曲线。
1.2.7 检测限及定量限测定 将对照品溶液逐级稀释后,按“1.2.1”项下色谱条件测定,直至噪声信噪比不低于 10:1,得出定量限;继续试验直至信噪比不低于 3:1,得出检测限。
1.2.8 回收率试验 分别精密称取同批 rhNGF 原液适量置于量瓶中,按照限度要求浓度(0.25 mg/ml,0.025%)的 80%、100%、120% 三个水平分别加入醋酸对照品储备液,每个水平各制备 3 份,按“1.2.1”项下色谱条件进行检测,测定醋酸含量,计算回收率和 RSD。
1.2.9 样品测定 按“1.2.3”项下分别制备 3 批(20170401、20170402、20170403)的低 pH 孵育前样品、低 pH 孵育样品、rhNGF 原液等各工艺步骤供试品溶液,按“1.2.1”项下色谱条件进行检测,测定 rhNGF 各工艺步骤供试品溶液中醋酸的残留量。
2 结果
2.1 精密度试验
平行进样 6 次的醋酸峰面积分别为 169373、169159、167311、167909、167489、167989 mAU•min,均值为 168205 mAU•min,峰面积 RSD = 0.513%(n = 6)。表明本方法精密度良好,符合测定要求。
2.2 专属性试验
流动相、对照品溶液、供试品溶液(rhNGF 原液)、供试品加标溶液的色谱图如图 1 所示,空白溶剂、rhNGF 对醋酸出峰均无影响,对测定均无干扰。
2.3 线性关系考察
对浓度分别为 0.01、0.05、0.10、0.25、0.50、1.00 mg/ml的系列对照品溶液进行积分,以对照品浓度(mg/ml)为横坐标,峰面积()为纵坐标,绘制标准曲线,得到回归方程= 674578.4378– 440.2440(2= 1.0000)。结果表明,醋酸浓度0.010 ~ 1.000 mg/ml 范围内线性关系良好(图2)。
2.4 检测限及定量限测定
将对照品溶液逐级稀释后,直至噪声信噪比不低于 10:1,得出定量限为 8.0 μg/ml;继续试验直至信噪比不低于 3:1,得出检测限为 2.0 μg/ml。
2.5 回收率试验
醋酸回收率试验结果如表 1。80%、100%、120% 三个水平的回收率分别为101.667、101.111、100.741,RSD 分别为 0.820%、0.381%、0.318%,平均回收率为 101.173%,RSD 为 0.506%,符合检测要求。
2.6 样品测定
低 pH 孵育前样品、低 pH 孵育样品、rhNGF 原液(超滤后样品)等各工艺步骤供试品检测图谱见图 3。3 批工艺中低 pH 孵育前样品均未检出醋酸,而低 pH 孵育样品、rhNGF 原液有检出醋酸,结果见表 2。3 批 rhNGF 原液中醋酸残留量分别为 0.086、0.068、0.058 mg/ml,低于醋酸残留限度 0.25 mg/ml(0.025%)。一步超滤对醋酸的去除率高达 99.474%、99.598%、99.654%(平均 99.576%),可以确保 rhNGF 原液中醋酸合格。
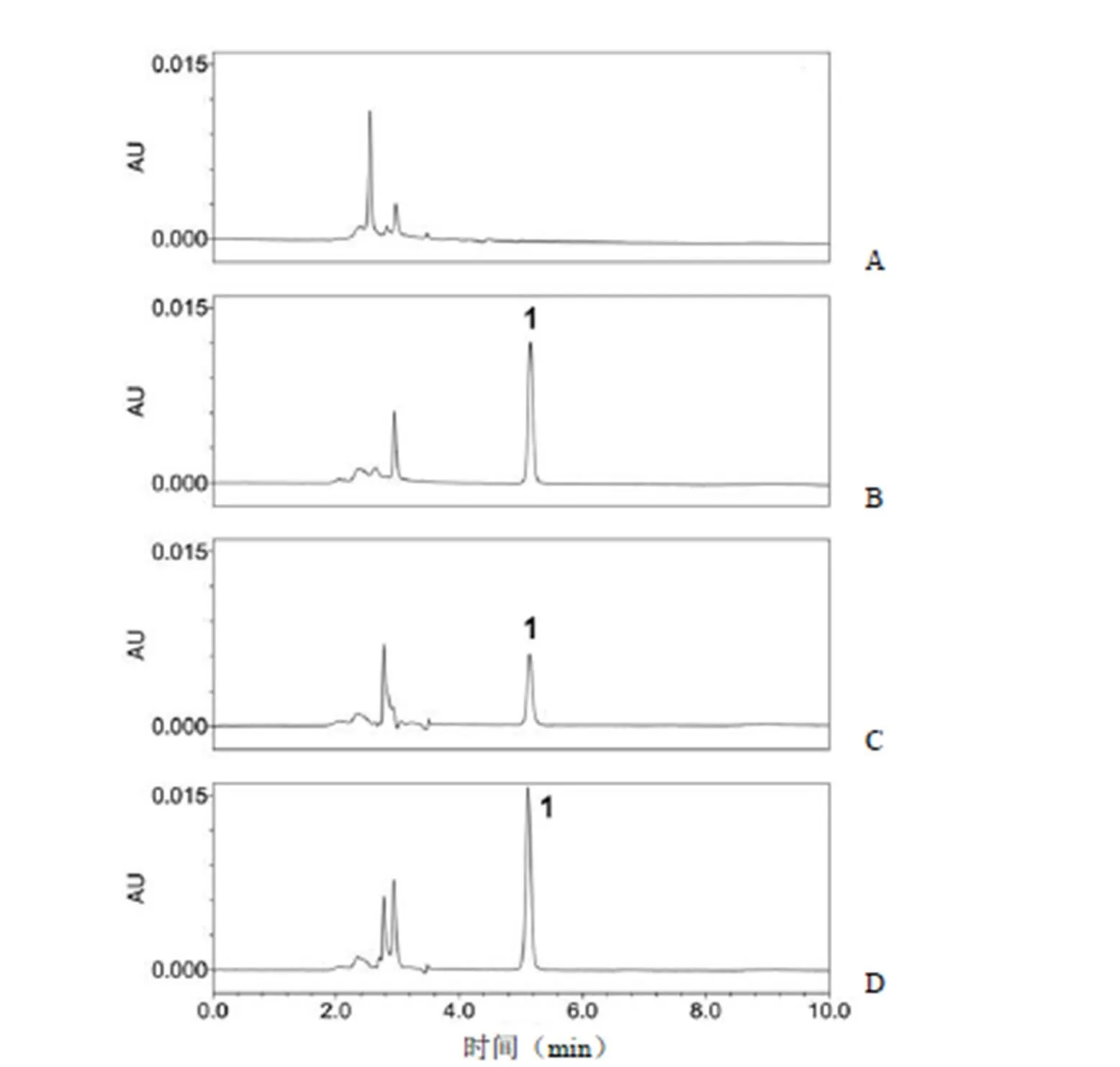
图 1 专属性试验色谱图(A:流动相;B:对照品溶液;C:供试品溶液;D:供试品加标溶液;1:醋酸峰)
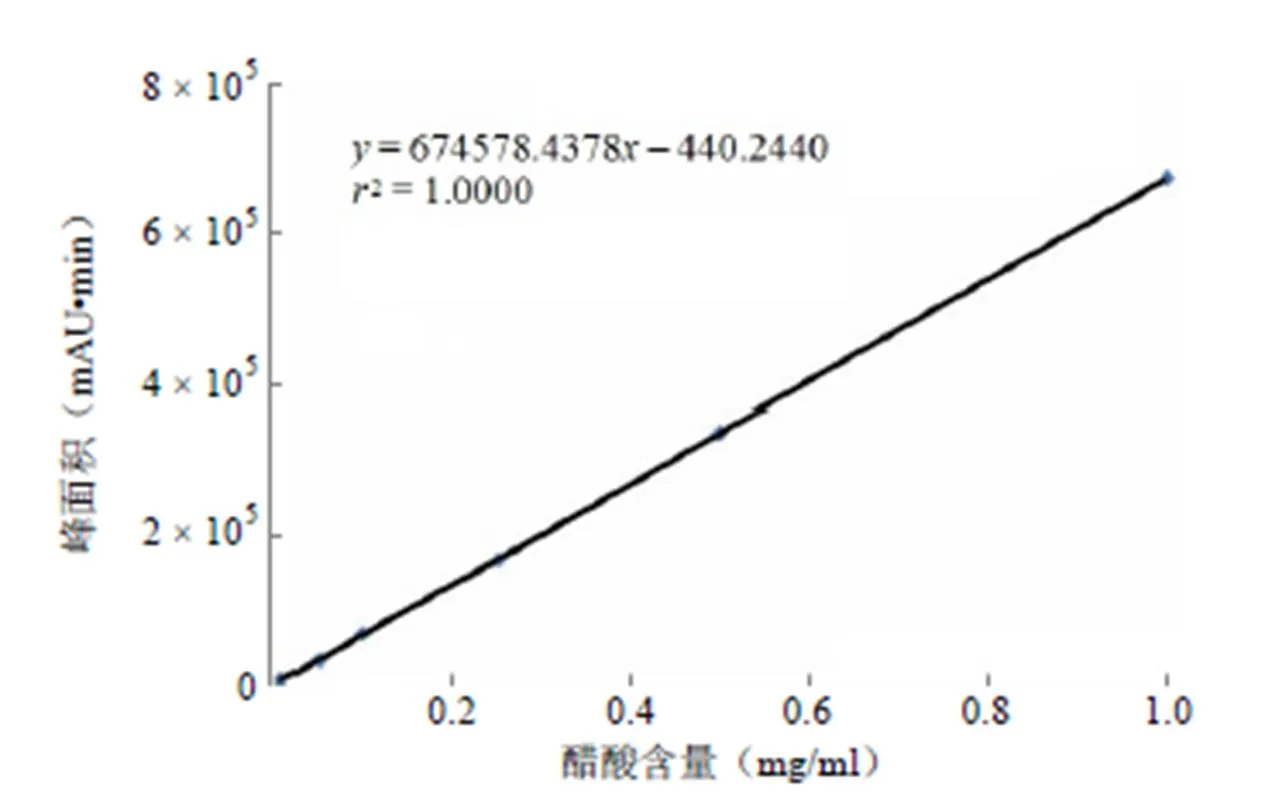
图 2 醋酸浓度与峰面积相关性回归曲线
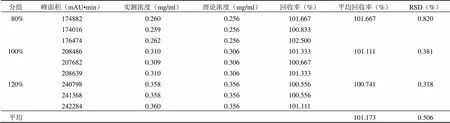
表 1 醋酸回收率试验结果
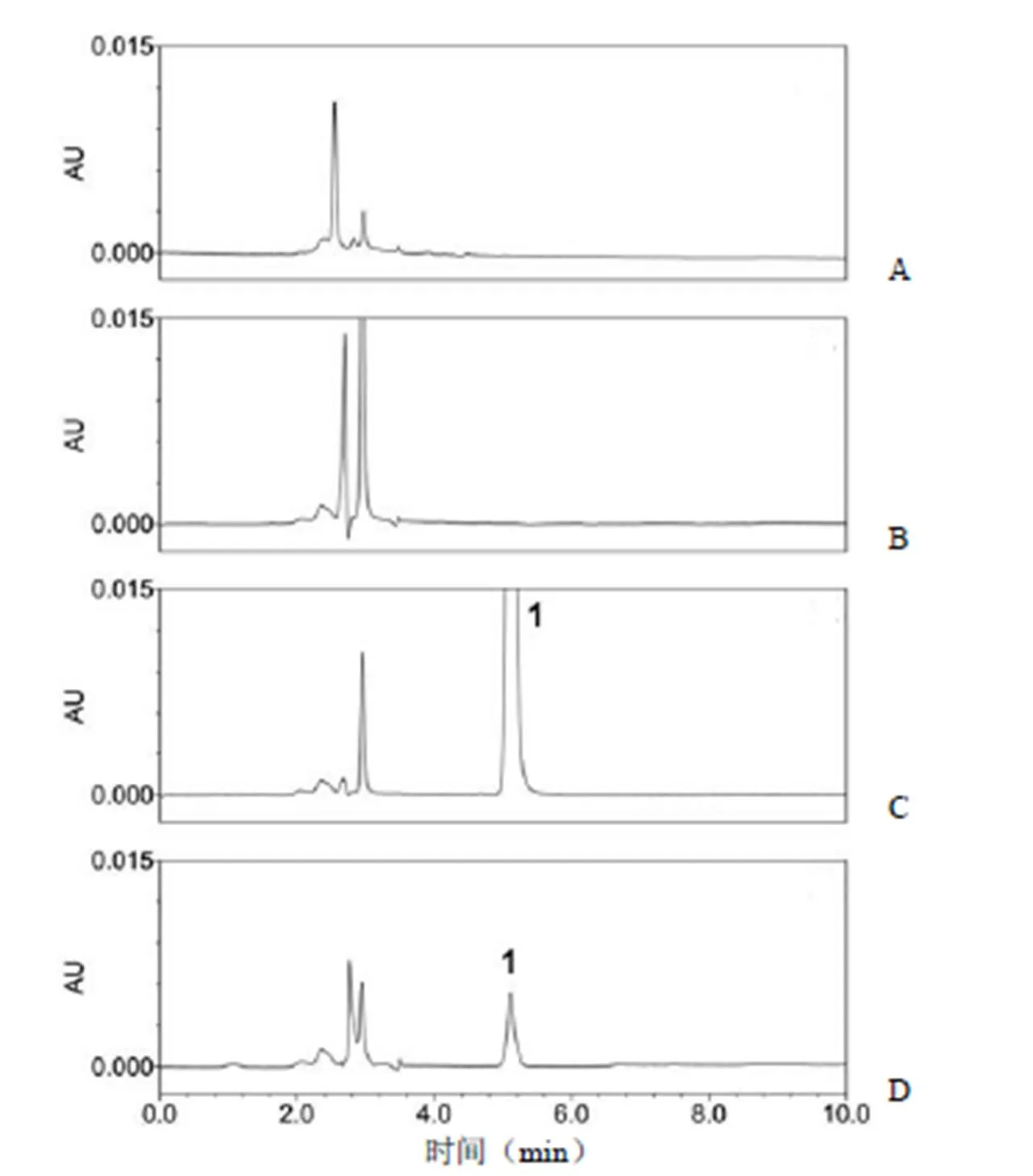
图 3 各工艺步骤供试品色谱图[A:流动相;B:低 pH 孵育前样品;C:低 pH孵育样品(稀释 20 倍);D:rhNGF 原液(超滤后);1:醋酸峰]
3 讨论
CHO 细胞属于哺乳动物细胞,与其他表达系统相比,CHO 表达系统具有准确的转录后修饰功能,表达的蛋白在分子结构、理化特性和生物学功能方面最接近于天然蛋白分子,其在重组蛋白、单克隆抗体表达发明的应用也越来越广泛[6]。但 CHO 细胞来源于中国仓鼠,细胞本身和生产工艺导致产品出现病毒污染的可能性[7]。因此,国家食品药品监督管理总局(CFDA)要求在生产工艺中必须加入经验证的病毒灭活步骤,以此排除可能污染的感染性活病毒,有效控制制品的病毒安全性[8]。
低 pH 孵育是常用的病毒灭活手段,其使用方便、工艺稳定可靠,且无病毒灭活剂(如辛酸钠、磷酸三丁酯等)残留的问题,因此常与柱层析工艺联合应用在病毒灭活/去除中[4, 9]。醋酸酸性较弱,反应较温和,是目前低 pH 孵育中使用较多的酸类,如在 CHO 细胞表达的 rhNGF 工艺中使用醋酸调节 pH 进行病毒灭活,再以磷酸缓冲液进行超滤置换,即得 rhNGF 原液。
醋酸是 ICH 规定的第三类溶剂,急性毒性或短期毒性试验表明这类溶剂几乎无毒、无遗传毒性,其允许的日接触量(PDE)为 50 mg 或以上,ICH Q3c 和中国药典 2015 年版《通则 0861:残留溶剂测定法》规定其限度为 0.5%[5, 10]。一般来说,仅需要对在终产品精制过程中使用的第三类溶剂进行残留量研究,但在新药的研发过程中,有必要对所有使用到的有机溶剂进行溶剂残留水平的合理性论证,使药品的安全性得到最大保证[10-11]。
目前,化学药物中醋酸残留检测主要针对原料药,如胸腺五肽的醋酸限度为0.5%[12],而生物制品则尚未有具体参照。中国药典 2015 年版三部《人血白蛋白》各论中对同属于第三类溶剂的乙醇规定为人血白蛋白原液中乙醇残留量限度应不高于 0.025%,远低于 0.5% 的常规乙醇残留量限度标准[13]。为最大程度保证药物的安全性,本研究参照上例严格限定 rhNGF 原液中的醋酸残留量,将标准定为醋酸残留量限度应不高于 0.025%(0.25 mg/ml)。
前期研究表明,醋酸残留量检测多采用毛细管气相色谱法[11, 14]、离子色谱法[15]、HPLC 法[16],其中气相色谱法 FID 检测器对醋酸响应值低于其他有机试剂,且检测结果易受气流稳定性影响,重现性不佳;离子色谱法检测醋酸近年来多有报道,但其对仪器要求较高,且电导检测器通用性较差,导致其在药企配置率不高,推广应用受到限制;而 HPLC 法操作简单,分析速度快,通用性强,是目前药企配置的最基本检测仪器之一,建立适用的 HPLC 法检测生物制品原液中醋酸残留量是十分必要且有推广意义的。
因此,本研究采用 C18 反相色谱柱,建立以 10 mmol/L NaH2PO4水溶液-甲醇作为流动相进行等度洗脱的 HPLC 快速检测方法,实验结果表明本方法精密度、专属性、线性良好,定量限和检测限低,回收率符合规定,适用于 rhNGF 原液中醋酸残留检测;低 pH 值孵育后进行一步超滤的 rhNGF 原液中醋酸残留量为 0.058 ~ 0.082 mg/ml,低于醋酸残留限度 0.25 mg/ml(0.025%),一步超滤对醋酸的去除率高达 99.576%,可以确保 rhNGF 原液中醋酸残留量符合规定。本方法的建立为加快 rhNGF 的工业化生产提供了实验依据,并可推广至辅料中不含冰醋酸、醋酸钠的各类生物制品原液中醋酸残留量的检测,为生物制品新药研发提供理论参考。
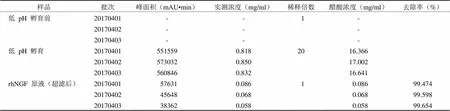
表 2 各工艺步骤醋酸含量
[1] Cohen S, Levi-Montalcini R, Hamburger V. A nerve growth- stimulating factor isolated from sarcomas 37 and 180. Proc Natl Acad Sci U S A, 1954, 40(10):1014-1018.
[2] Shen L, Wang Y. Progress on research and clinical application of nerve growth factor. Prog Microbiol Immunol, 2015, 43(6):48-52. (in Chinese)沈丽, 王妍. 神经生长因子的研究及应用进展. 微生物学免疫学进展, 2015, 43(6):48-52.
[3] Le W, Peng LJ, Shi QW, et al. Study on the high lever expression and bioactivity evaluation of recombinant human nerve growth factor. Chin Pharm Aff, 2014, 28(6):601-606. (in Chinese)乐伟, 彭璐佳, 史权威, 等. 重组人神经生长因子的高效表达和生物活性评价研究. 中国药事, 2014, 28(6):601-606.
[4] Ma R, Cui X. Low pH inactivation for xenotropic gamma retrovirus in recombinant human TNF-α receptor immunoglobulin G and mechanism of inactivation. Biologicals, 2014, 42(1):52-56.
[5] International Council for Harmonisation. Impurities: guideline for residual solvents -- Q3C(R6). (2016-10-20) http://www.ich.org/ fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q3C/Q3C__R6___Step_4.pdf.
[6] Zheng HH, Jiang H. Progress of CHO expression system. Curr Biotechnol, 2016, 6(4):239-243. (in Chinese)郑惠惠, 江洪. CHO细胞表达系统研究进展. 生物技术进展, 2016, 6(4):239-243.
[7] Berting A, Farcet MR, Kreil TR. Virus susceptibility of Chinese hamster ovary (CHO) cells and detection of viral contaminations by adventitious agent testing. Biotechnol Bioeng, 2010, 106(4):598-607.
[8] Center for Drug Evaluation, CFDA. General principles for evaluation of viral safety assessment of biological tissue extracted products and eukaryotic cell expression products. 2008-09-04. (in Chinese)国家食品药品监督管理总局药品审评中心. 生物组织提取制品和真核细胞表达制品的病毒安全性评价技术审评一般原则. 2008-09- 04.
[9] Wang SJ, Fu R, Gong W, et al. Verification of procedure for virus removal from recombinant fusion protein by column chromatography. Chin J Biol, 2014, 27(2):241-244. (in Chinese)王淑菁, 付瑞, 巩薇, 等. 重组融合蛋白柱层析病毒去除工艺的验证. 中国生物制品学杂志, 2014, 27(2):241-244.
[10] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China. Volume 4, 2015. Beijing: China Medical Science Press, 2015:105-106. (in Chinese)国家药典委员会. 中华人民共和国药典. 2015 年版四部. 北京: 中国医药科技出版社, 2015:105-106.
[11] Liu Y, Wang ZJ, Dong X, et al. Progress in the control concepts and determination methods of residual solvents in pharmaceuticals. ChinJ New Drug, 2017, 26(17):2040-2045. (in Chinese)刘颖, 王志军, 董欣, 等. 药品中残留溶剂的控制理念及测定方法的应用. 中国新药杂志, 2017, 26(17):2040-2045.
[12] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China. Volume 2, 2015. Beijing: China Medical Science Press, 2015:1161-1162. (in Chinese)国家药典委员会. 中华人民共和国药典. 2015 年版二部. 北京: 中国医药科技出版社, 2015:1161-1162.
[13] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China. Volume 3, 2015. Beijing: China Medical Science Press, 2015:244-245. (in Chinese)国家药典委员会. 中华人民共和国药典. 2015 年版三部. 北京: 中国医药科技出版社, 2015:244-245.
[14] Zheng RF, Yang C, Ren FY, et al. Simultaneous determination of 6 residual organic solvents in aprepitant raw material by headspace capillary GC. China Pharm, 2017, 28(24):3426-3429. (in Chinese)郑瑞凤, 杨晨, 任凤英, 等. 顶空毛细管气相色谱法同时测定阿瑞匹坦原料药中6种有机溶剂的残留量. 中国药房, 2017, 28(24): 3426-3429.
[15] Wen HL, Zhao JD, Qin F, et al. Determination of acetate ion in cloxacillin sodium forinjection by ion chromatography. Chin J Pharm Anal, 2016, 36(7):1268-1273. (in Chinese)闻宏亮, 赵敬丹, 秦峰, 等. 离子色谱法测定注射用氯唑西林钠中醋酸根离子含量. 药物分析杂志, 2016, 36(7):1268-1273.
[16] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China. Volume 4, 2015. Beijing: China Medical Science Press, 2015:109-110. (in Chinese)国家药典委员会. 中华人民共和国药典. 2015 年版四部. 北京: 中国医药科技出版社, 2015:109-110.
国家“重大新药创制”科技重大专项(2011ZX09401-017)
陈星,Email:amable24@163.com
2017-12-12
10.3969/j.issn.1673-713X.2018.03.014
