效应面法优化地榆皂苷提取工艺
2018-06-13王玉刘怀伟张帅杰
王玉,刘怀伟,张帅杰
地榆在我国广泛分布,主产于东北、西北及华北地区,性微寒、味苦,归肝、大肠经,功能凉血补血、解毒敛疮[1]。现代研究发现其主要含有皂苷类、鞣质类等化学成分[2-3],据药理研究发现地榆皂苷类成分具有促造血细胞增殖、抗肿瘤、护肤养颜等作用,且地榆皂苷促造血细胞增殖作用较强,单独作用能促使2种巨核祖细胞增殖和分化[4-8]。经文献查阅,地榆皂苷提取工艺的研究较少,主要研究其成分和药理作用,本实验采用效应面法优化地榆皂苷提取工艺。效应面法是一种优化工艺条件的有效方法,已广泛用于优化中药有效成分提取工艺,主要通过非线性模型多元二次回归方程来拟合因素与响应值之间的关系,结果准确度高、可预测性强[9-11]。本研究首次采用效应面法优化乙醇直接提取地榆皂苷,为进一步开发地榆制剂奠定基础。
1 仪器与材料
Agilent1260型高效液相色谱仪(美国Agilent公司);Alltech2000型蒸发光散射检测器(Agilent公司);BT125D型分析天平(Sartorius公司);地榆皂苷-Ⅰ对照品(批号111952-201301,中国食品药品检定研究院);地榆皂苷-Ⅱ对照品(纯度>98%,批号:D-023-161108,购自成都瑞芬思生物科技有限公司);地榆药材(四川科伦药业股份有限公司),按《中国药典》2015年版一部地榆项下规定检测,均符合要求。甲醇、乙腈为色谱纯,所用水为纯净水,本文中所涉及的其他试剂均为分析纯(成都市科龙化工试剂厂)。
2 方法与结果
2.1 地榆皂苷-Ⅰ含量测定
2.1.1 对照品溶液配制 取地榆皂苷-Ⅰ对照品适量,精密称定,加甲醇制成每1 mL含3 mg的溶液,即得(浓度3.011 mg·mL-1)。
2.1.2 供试品溶液制备 精密移取各实验项下的提取液2 mL,置10 mL量瓶中,加甲醇稀释至刻度,摇匀,滤过,即得。
2.1.3 色谱条件及专属性考察 安捷伦C18色谱柱(4.6×250 mm,5 μm);流动相为乙腈-水(30:70);检测波长为208 nm;柱温为30 ℃;流速为1 mL·min-1;进样量10 μL;分别取对照品溶液、空白溶剂、供试品溶液,按上述色谱条件进行试验,HPLC图如下图1。峰型良好,阴性无干扰,表明该方法专属性良好。
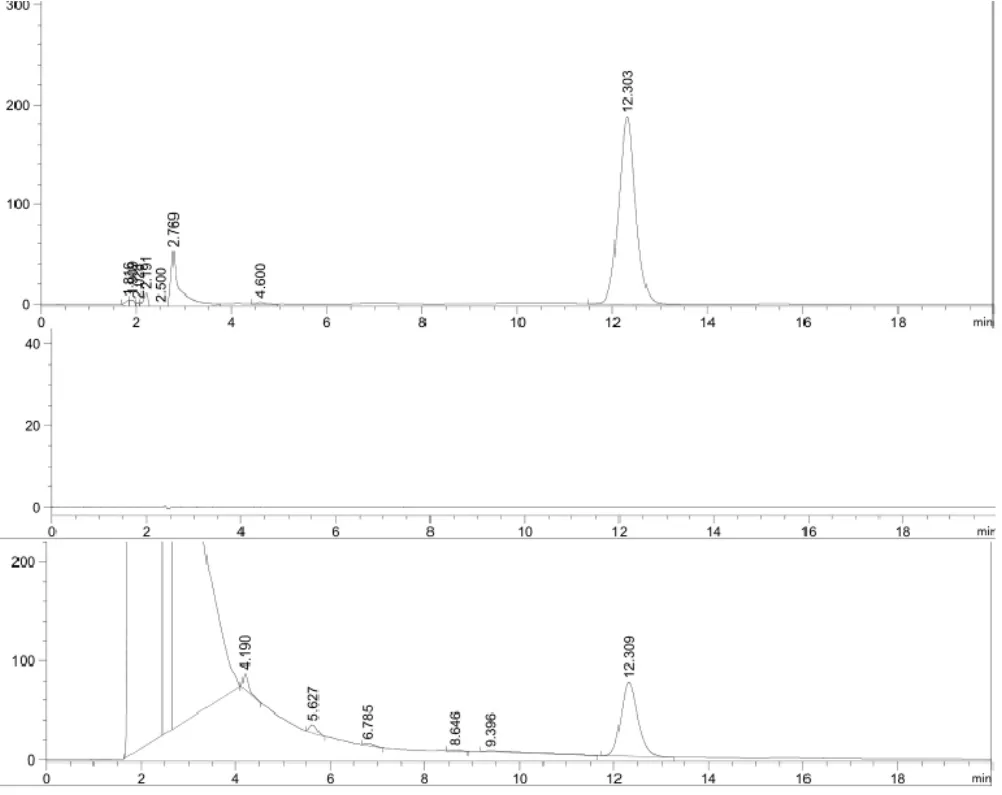
图1 地榆皂苷-Ⅰ色谱图(对照品溶液、空白溶剂、供试品溶液)
2.1.4 标准曲线制备 分别精密移取不同浓度对照品溶液(0.3011,0.6022,0.9033,1.2044,1.5055,3.0110 mg·mL-1),按2.1.3项下色谱条件,注入高效液相色谱仪,记录峰面积,以峰面积Y为纵坐标,对照品浓度X为横坐标进行线性回归,得回归方程为Y=288.01X+1.1715(r =0.999 4),表明地榆皂苷-Ⅰ在0.3011~3.0110 mg·mL-1范围内呈良好的线性关系。
2.1.5 精密度试验 取地榆皂苷-Ⅰ对照品溶液、地榆供试品溶液分别重复进样6次,按2.1.3色谱条件,测得地榆皂苷-Ⅰ峰面积的RSD为0.33%,地榆供试品溶液地榆皂苷-Ⅰ峰面积的RSD为0.85%。表明在该色谱条件下仪器精密度良好。
2.1.6 重复性试验 精密移取2.1.2项下供试品溶液6份,按2.1.3色谱条件测定,RSD=0.93%,表明该方法重复性良好。
2.1.7 稳定性试验 精密移取2.1.2项下供试品溶液6份,按2.1.3色谱条件分别在0、2、4、12、24、48 h测定,RSD=0.69%,表明该供试品溶液在48 h内稳定。
2.1.8 加样回收率试验 精密称取己知含量的地榆药材粉末9份,每份约0.1 g,分别精密加入高、中、低含量的地榆皂苷-Ⅰ对照品溶液,每个含量平行测定3份,按2.1.2项下供试品溶液制备,按照2.1.3项下色谱条件进行测定,结果地榆皂苷-Ⅰ的平均加样同收率为99.4%,RSD为1.44%。表明该方法准确度良好,见表1。
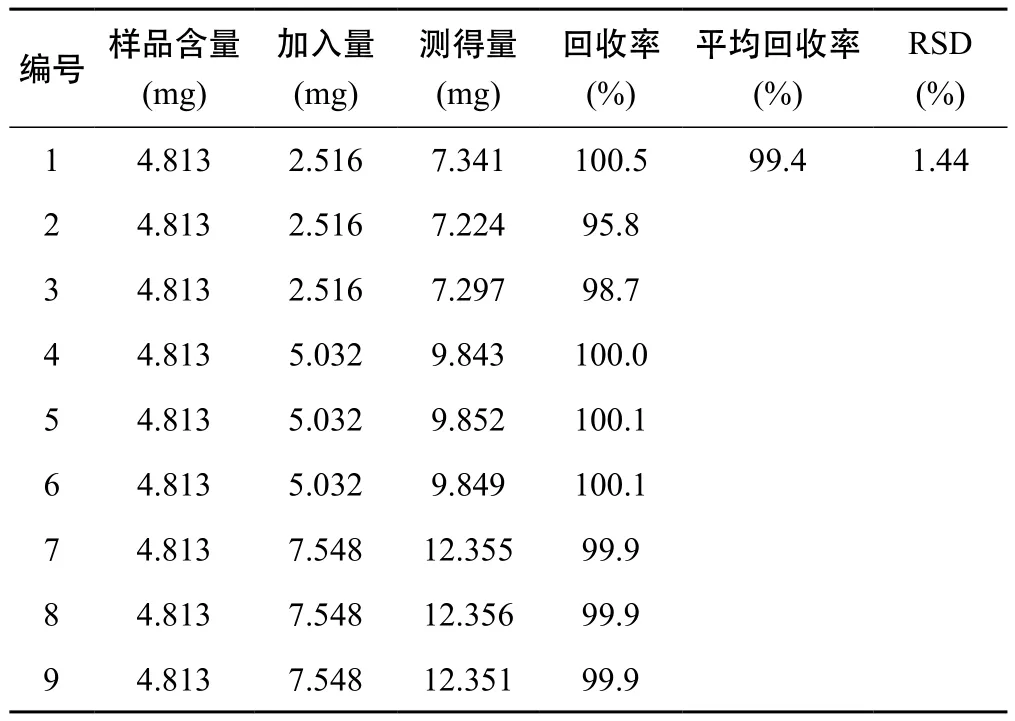
表1 HPLC法测定地榆皂苷-Ⅰ加样回收率结果
2.2 地榆皂苷-Ⅱ含量测定
2.2.1 对照品溶液的配制 取地榆皂苷-Ⅱ对照品适量,加甲醇制成每1 mL含1 mg的溶液,即得(浓度1.008 mg·mL-1)。
2.2.2 供试品溶液的制备 精密移取各实验项下的提取液10 mL,水浴蒸干,残渣加甲醇溶解,转移至10 mL量瓶中,加甲醇至刻度,摇匀,即得。
2.2.3 HPLC-ELSD色谱条件及专属性考察 流动相为甲醇-水(70:30),流速:1.0 mL·min-1;蒸发光散射检测器;漂移温度:100 ℃,气体流速:3.0 L·min-1。进样量10 μL;分别取对照品溶液、空白溶剂、供试品溶液,按上述色谱条件进行试验,HPLC-ELSD图如下图2。峰型良好,阴性无干扰,表明该方法专属性良好。
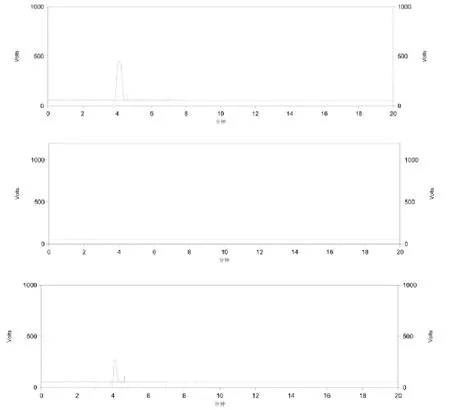
图2 地榆皂苷-Ⅱ色谱图(对照品溶液、空白溶剂、供试品溶液)
2.2.4 标准曲线制备 分别精密移取不同浓度对照品溶液各10 μL(0.1008,0.2016,0.3024,0.4032,0.5040,1.0080 mg·mL-1),按2.2.3项下色谱条件,注入高效液相色谱仪,记录峰面积,以峰面积积分值的对数Y为纵坐标,对照品浓度对数X为横坐标进行线性回归,得回归方程为Y=1.7463X+2.0059(r=0.999 1),表明地榆皂苷-Ⅱ在0.1008~1.0080 mg·mL-1范围内呈良好的线性关系。
2.2.5 精密度考察 取地榆皂苷-Ⅱ对照品溶液、地榆供试品溶液分别重复进样6次,按2.2.3色谱条件,测得地榆皂苷-Ⅱ峰面积的RSD为1.03%,地榆供试品溶液地榆皂苷-Ⅱ峰面积的RSD为1.87%。表明在该色谱条件下仪器精密度良好。
2.2.6 重复性考察 精密移取2.2.2项下供试品溶液6份,按2.2.3色谱条件测定,RSD=1.91%,表明该方法重复性良好。
2.2.7 稳定性试验 精密移取2.2.2项下供试品溶液6份,按2.2.3色谱条件分别在0、2、4、12、24、48 h测定,RSD=1.81%,表明该供试品溶液在48 h内稳定。
2.2.8 加样回收率试验 精密称取己知含量的地榆药材粉末9份,每份约1 g,分别精密加入高、中、低含量的地榆皂苷-Ⅰ对照品溶液,每个含量平行测定3份,按2.2.2项下供试品溶液制备,按2.2.3项下色谱条件进行测定,结果地榆皂苷-Ⅱ的平均加样同收率为99.7%,RSD为1.91%。表明该方法准确度良好,见表2。
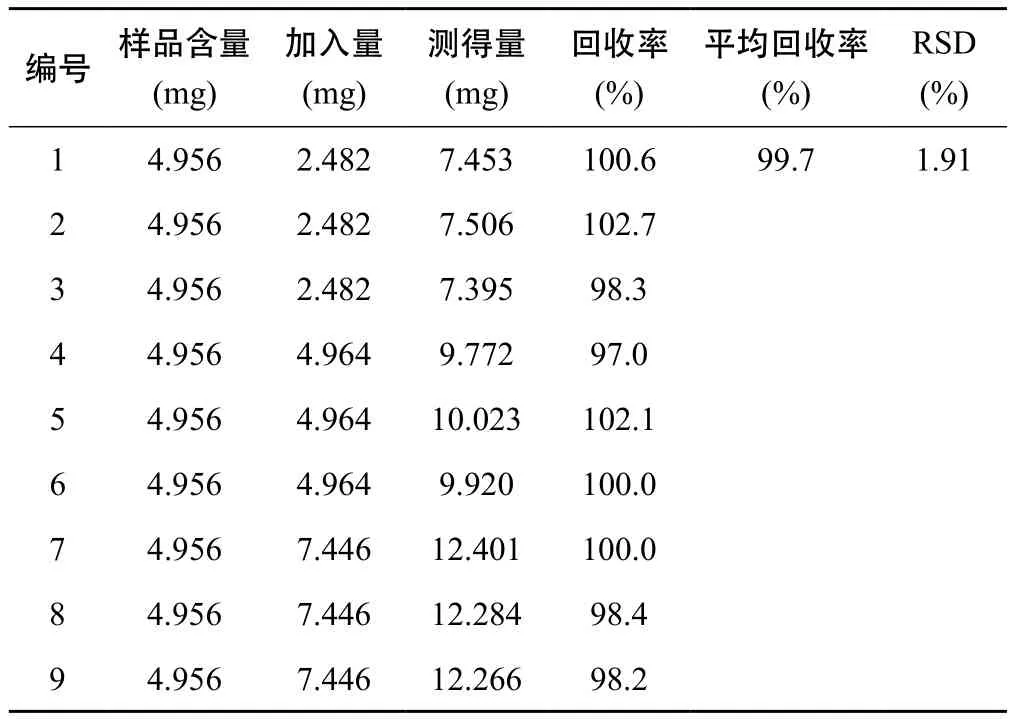
表2 HPLC-ELSD法测定地榆皂苷-Ⅱ加样回收率结果
2.3 响应面优化实验
2.3.1响应面实验设计
在查阅文献[13-15]的基础上,以乙醇浓度(A)、乙醇用量(B)、提取时间(C)为考察因素,因素水平表见表3,以地榆皂苷-Ⅰ和地榆皂苷Ⅱ提取量(Y)的综合评分为指标,Y=地榆皂苷-Ⅰ/Max地榆皂苷-Ⅰ×50+地榆皂苷Ⅱ/Max地榆皂苷-Ⅰ×50,采用Box-Behnken设计方法设计试验,试验设计见表4。实验方法,称取地榆粉末10 g,按相应的条件超声提取。
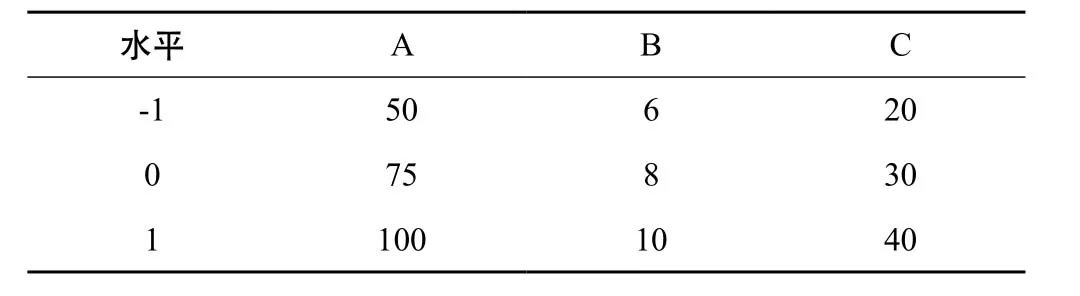
表3 因素与水平

表4 黄芪甲苷提取工艺Box-Behnken试验设计
使用统计软件Design-Expert8.0.6,对表4中数据进行多元回归拟合,得到二次多项回归方程模型:Y=99.94-15.46A+4.90B+2.80C-0.84AB-0.17AC+1.58BC-16.70A2-6.87B2-6.11C2(r=0.9887,P<0.01)。统计学方差分析见表5。
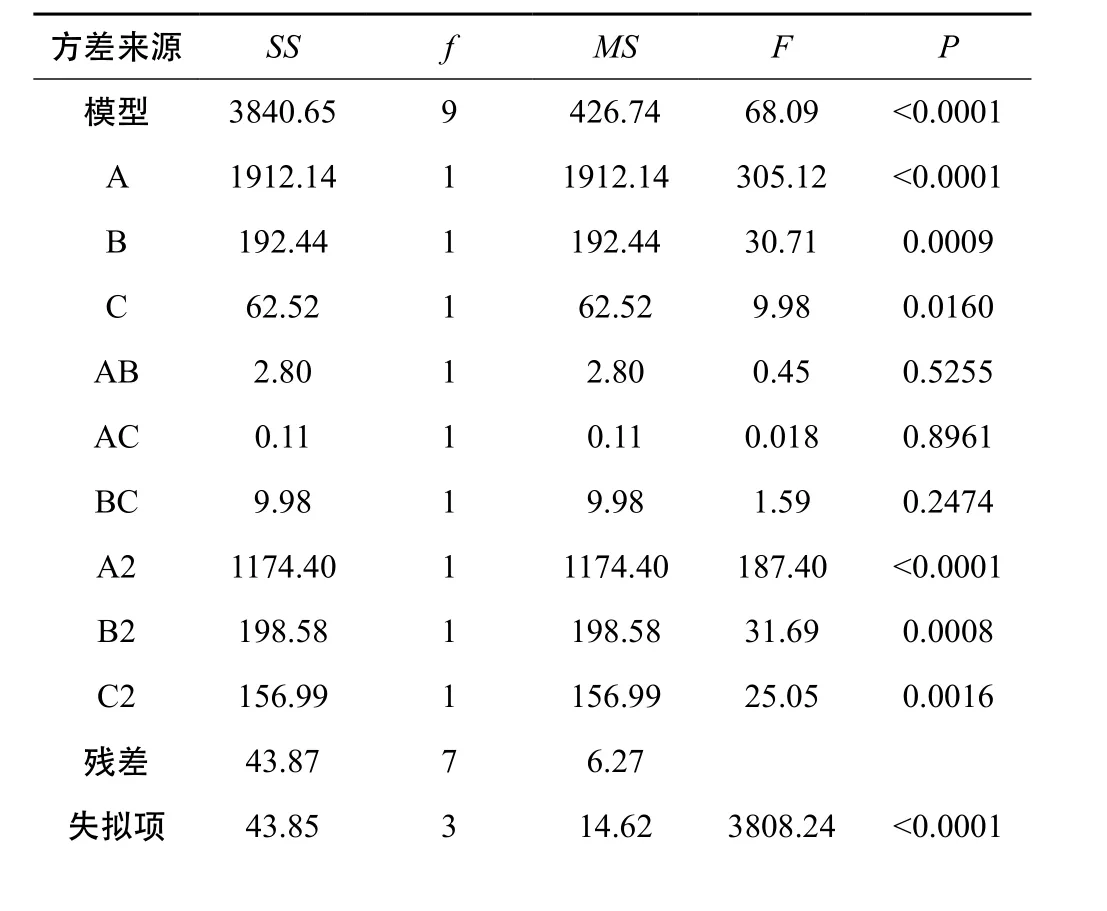
表5 响应面模型方差分析

纯误差 0.015 4总和 3884.51 16
由方差分析结果可知,模型能解释98.87%的响应值变化,回归方程拟合较好,分析结果可靠。三个因素分别对综合评分影响的顺序为A>B>C,模型P<0.0001,表明该回归方程拟合情况良好,能准确预测实际情况。模拟方程绘制响应面等高图和3D图,如图3。
由上图可知,因素A的曲面较陡峭,且等高线较紧密,说明因素A对响应值影响最显著;当因素A一定时,增加因素B,响应值先增加后降低;B和C曲面较平缓,等高线疏松,说明因素B和C的交互作用对响应值无显著性影响,这与方差分析结果一致。经Design-Expert软件优化得最佳提取工艺为乙醇浓度77.4%,料液比7.6倍,提取时间28.6 min。考虑到大生产的实际可操作性,调整工艺参数为乙醇浓度80%,料液比8倍,提取时间30 min。
2.4 验证实验
按以上优化结果乙醇浓度80%,料液比8倍,提取时间30 min,进行3 次验证试验,结果地榆皂苷-Ⅰ的含量分别为60.972,61.088,61.094 mg·g-1,平均值为61.051 mg·g-1;地榆皂苷-Ⅱ的含量分别为5.300,5.303,5.295 mg·g-1,平均值为5.299 mg·g-1。与理论预测值相比,其相对误差小于5%,验证值与回归方程预测值吻合较好,说明该模型有良好的预测性。
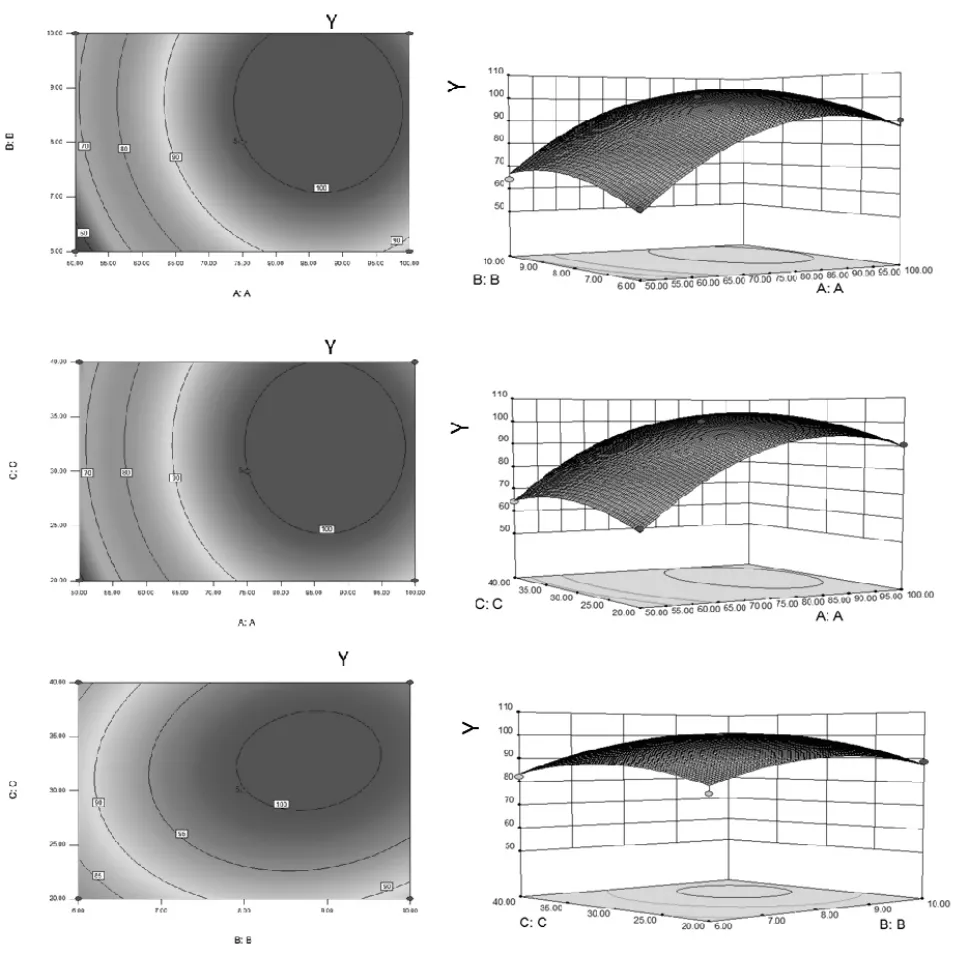
图3 响应面等高图和3D图
3 讨论
本实验采用乙醇直接从地榆药材中提取地榆皂苷成分,经响应面法优化提取工艺,工艺参数为乙醇浓度80%,料液比8倍,提取时间30 min,与其他文献报道,地榆皂苷提取量提高。本实验采用Box-Behnken设计,其充分考虑到各因素的交互作用,设计方法简单,试验次数少,在中心点进行重复试验以提高试验精度,同时采用非线性模型拟合,可信度较好,预测值更接近真实值。经验证试验验证结果可知,本工艺稳定可行,为工业化大生产提供了科学依据。
[1]周国忠,朱磊,刘婉莹,等.地榆药材的研究与探讨[J].北方药学,2012,9(4):30-32.
[2]秦国伟,陈梅玉,徐任生.地榆化学成分的研究[J].中草药,1991,22(11):183-185.
[3]于蓓蓓,钟方晓,董学.地榆化学成分研究进展[J].中国中医药信息杂志,2009,16(Sl):103-105.
[4]代燕平,高小平,吴建明,等.地榆总皂普对巨核祖细胞增殖分化及相关受体表达的影响[J].中国中药杂志,2014,39(9):1685-1689.
[5]邹文俊,刘芳,吴建明,等.地榆总皂昔促造血细胞增殖效应研究[J].中草药,2012,43(5):929-933.
[6]许新华,李松,薛峰,等.地榆升白片预防放疗中白细胞减少症的疗效评价[J].临床荟萃,2005,20(8): 458.
[7]郝晓燕,华丽,李瑞东.放化疗中地榆升白片辅助治疗疗效观察[J].成都中医药大学学报,2004,27(4):20-22.
[8]胡谦,官晓红,练颖,等.地榆升白片对恶性淋巴瘤化疗中血细胞下降的临床观察[J].成都中医药大学学报,2010,33(3):33-35.
[9]叶良红,朱红云,李芸霞.响应面法优化大黄附子药对中蒽醌类成分的提取工艺[J].中药与临床,2011,2(4):16.
[10]董自亮,徐瑞超.基于Box-Behnken设计响应面法优化白芷香豆素闪式提取工艺[J].中药与临床,2013,4(1):13.
[11]张文秀,朱卫丰,聂鹤云,等.Box-Behnken响应面法优化马钱子提取工艺[J].中成药,2015,37(9):1932-1936.
[12]减巧真,唐涛,龙凯花,等.Box-Behnken效应面法优化α-细辛脑长循环纳米粒制备工艺[J].中成药,2016,38(2):456-460.
[13]杨桂燕,代良敏,熊永爱,等.HPLC-ELSD法测定地榆药材中地榆皂苷-I和地榆皂苷-II的含量[J].中华中医药杂志,2016,31(8):3340-3343.
[14]范奎,代良敏,熊永爱,等.HPLC-ELSD法测定地榆总皂苷中地榆皂苷-Ⅰ和地榆皂苷-Ⅱ的含量[J].中华中医药杂志,2017,32(6):26392-64.
[15]苏柘僮,刘英,徐佳丽,等.应用Box-Behnken设计优化地榆皂苷的闪式提取工艺研究[J].中草药,2012,43(3):501-504.
