结核T细胞酶联免疫斑点试验在诊断结核病中的临床应用价值*
2018-06-12施瑞洁韩梦箐张利侠
施瑞洁,韩梦箐 ,马 娟,张利侠,朱 娜 ,杜 洁
1.陕西省人民医院检验科(西安710068),2.陕西中医药大学检验系(咸阳712046),3.陕西省人民医院科研处(西安710068),4.陕西省人民医院健康体检中心(西安710068)
结核病是一种主要通过空气传播的传染性细菌感染性疾病,据报道,2014年世界范围内有 960万例结核感染患者,其中150万例死于结核病[1]。根据世界卫生组织(WHO)的统计,我国结核病患病人数居世界第二位,仅次于印度;我国不仅是全世界27个严重流行耐多药结核病的国家之一,同时也是全世界22个结核病流行严重的国家之一[2]。流行病学调查发现因结核病而导致死亡的人数达到13万人/年[3],国家卫计委已将结核病例为全国重点控制重大疾病之一[4]。
有研究显示各国结核病的诊断均存在不同程度的诊断延误[5-6],而诊断延误可导致患者感染期的延长以及病情的恶化, 不但增加了患者和社会的经济负担, 还可能导致结核疫情加剧,出现更多的感染者及更高的病死率。早期筛检出结核病患者,缩短从出现症状到确诊为结核的时间,并给以合理治疗, 是控制和消灭传染源、减少感染、降低发病的重要环节[7-8],因此快速精准的早期筛查和检测结核菌感染尤为重要。
由于传统的检测结核病的方法存在缺陷,不能早期、有效的筛查出结核病,我们引入了新的检测方法-结核T细胞酶联免疫斑点试验(T-SOPT.TB)。T-SOPT.TB是在酶联免疫斑点技术(ELISPOT)的基础上应用细胞免疫反应建立起来的检测单细胞水平分泌抗体或细胞因子的新型体外免疫检测法[4]。本研究应用T-SOPT.TB检测2016年5-12月某院160例结核病患者与46例非结核病患者外周抗凝血单个核细胞结核特异性T淋巴细胞数、红细胞沉降率及涂片抗酸染色并分析。
材料与方法
1 研究对象 选取2016年5-12月某院确诊为结核病患者160例为病例组,其中男97例,女63例,平均年龄57.1819.52岁。纳入标准:临床表现结核症状,影像学、病理或抗酸染色确诊为结核,排除妊娠,均未服用免疫抑制药物。另选对照组46例,男25例,女21例,平均(61.3617.63)岁。纳入标准:既往均无结核病史及结核病接触史,胸部经X线检查无异常。病例组与对照组的年龄及性别比较差异无统计学意义。
2 标本采集
2.1 T-SOPT.TB试验:肝素锂抗凝管常规采集静脉血5ml。标本采集后4h内送至实验室。
2.2 涂片抗酸染色:痰标本采用合格的新鲜晨或液体标本经离心后取沉淀涂片,利用抗酸染色镜检。
2.3 红细胞沉降率检测 :专用血沉真空管常规抽取空腹静脉血1.6ml。
3 试剂及仪器 淋巴细胞分离液和AIM-V培养液由美德太平洋(天津)生物科技股份有限公司提供;RPMI-1640培养基由天津生物科技有限公司提供;检测结核T淋巴细胞酶联免疫斑点试验试剂盒由英国牛津提供:PBS洗板液由上海双螺旋生物科技有限公司提供;酶结合物原液;无菌试管;无菌加样头;定量加样器;生物安全柜;37℃培养温箱;无菌痰杯;抗酸染色剂;ESR-030血沉仪;含有0.4ml,浓度为0.109mol/L柠檬酸钠的专用血沉真空管。
4 方 法
4.1 T-STOP.TB试验方法:按照标准操作规程将外周抗凝血分离单个核细胞,将其洗涤,计数并稀释至2.5×106个/ml的工作浓度细胞液,在微孔板中分别加入阴性对照细胞培养液,抗原A(ESAT-6,结核杆菌早期分泌蛋白),抗原B(CFP10,培养滤液蛋白10),阳性对照(植物血凝素PHA)各50μl,每孔分别加入100ul稀释好的细胞液(悬空加入,不沾染板孔),放入CO2培养箱(37℃,5%CO2)培养16~20h。次日准备10×PBS液(PBS蒸馏水稀释得到),以1∶200的比例将酶标二抗原液与10×PBS洗涤液混合制成二抗工作液,将过夜培养的板孔中的培养液甩掉,每孔加入200μl 10×PBS液洗板,重复4遍后拍干板孔,每孔加入50μl二抗工作液4~80C孵育1h,洗涤微孔板加入显色液避光静置5~10min,用蒸馏水洗涤终止反应。将孔板内的液体拍干,读取并记录结果。
4.2 红细胞沉降率检测方法:病人空腹时,使用专用血沉真空管采集静脉血,混匀后将血沉管竖直置于ESR-030自动血沉分析仪,30min后查看结果。
4.3 痰涂片抗酸染色方法:病人清晨漱口后深咳送检,取痰液涂片后紫外消毒30min后置于加热台热固定1~2min;将石碳酸复红盖满玻片,常温染色10min后用流水沿玻片一端冲洗10~20s;滴加酸性酒精盖满玻片,脱色1~2min后流水冲洗;滴加亚甲蓝溶液,覆满玻片染色30s后用流水冲洗,滤纸擦干后可观察。
4.4 T-STOP.TB试验判断标准:当阴性对照孔斑点数为0~5个时(抗原A或抗原B孔的斑点数)-(阴性对照孔斑点数)≥6,或者阴性对照孔斑点数为6-10个时(抗原A或抗原B孔的斑点数)≥2×(阴性对照孔斑点数)为阳性结果,不符合上述阳性结果且阳性对照孔正常则为阴性结果。
涂片抗酸染色 :在显微镜下观察每100个视野有≥3条抗酸杆菌即为阳性结果。
红细胞沉降率 :男性15~49岁>15mm/h,50~85岁>20mm/h,86~110岁>30mm/h为红细胞沉降率加快;女性15~49岁>20mm/h,50~85岁>30mm/h,86~110岁>45mm/h为红细胞沉降率加快。
4.5 统计学方法:采用SPSS19.0统计学软件,收集资料为计数资料,多个样本率的比较采用χ2检验,对于2个单元格的期望计数小于5,使用Fisher的精确检验,以P<0.05为差异有统计学意义。对于计量资料的正态性检验采用单样本Kolmogorov-Smirnov检验分析,对两独立样本的数据差异分析使用t检验或Mann-Whitney U检验。
结 果
1 160例结核病患者T-STOP.TB试验阳性146例、敏感度91.3%;红细胞沉降率检测阳性101例、敏感度63.1%;涂片抗酸染色阳性67例、敏感度41.9%。T-STOP.TB敏感度高于红细胞沉降率检测与涂片抗酸染色,且差异均有统计学意义(χ2=35.94,χ2=87.63,P<0.05),见表1。

表1 160例结核病患者T-STOP.TB、红细胞沉降率、抗酸染色敏感度
注:﹡T-STOP.TB VS 红细胞沉降率;﹟T-STOP.TB VS 抗酸染色
2 46例非结核病患者T-STOP.TB试验44例阴性、特异度95.7%;红细胞沉降率检测22例阴性、特异度47.8%;涂片抗酸染色46例、特异度100.0%。T-STOP.TB试验特异度高于红细胞沉降率,且差异有统计学意义(χ2=25.95,P<0.05);T-STOP.TB试验特异度与抗酸染色相当,差异没有统计学意义(P=0.495),见表2。
3 T-STOP.TB试验、红细胞沉降率检测、涂片抗酸染色结果的阳性预测值分别为98.6%,80.8%,100%。T-STOP.TB试验的阳性预测值高于红细胞沉降率,且差异有统计学意义(χ2=25.05,P<0.05);T-STOP.TB试验的阳性预测值与抗酸染色相当,差异没有统计学意义(P=1.0),见表3。
4 T-STOP.TB试验、红细胞沉降率检测、涂片抗酸染色结果的阴性预测值分别为75.9%,27.2%,33.1%,T-STOP.TB试验的阴性预测值均高于红细胞沉降率与抗酸染色,且差异均有统计学意义(χ2=32.15,χ2=30.17,P<0.05),见表4。

表2 46例结核病患者T-STOP.TB、红细胞沉降率、抗酸染色特异度
注:﹡T-STOP.TB VS 红细胞沉降率,﹟T-STOP.TB VS 抗酸染色﹟2个单元格的期望计数小于5,使用Fisher的精确检验

表3 T-STOP.TB、红细胞沉降率、抗酸染色阳性预测值
注:﹡T-STOP.TB VS 红细胞沉降率,﹟T-STOP.TB VS 抗酸染色,﹟2个单元格的期望计数小于5,使用Fisher的精确检验
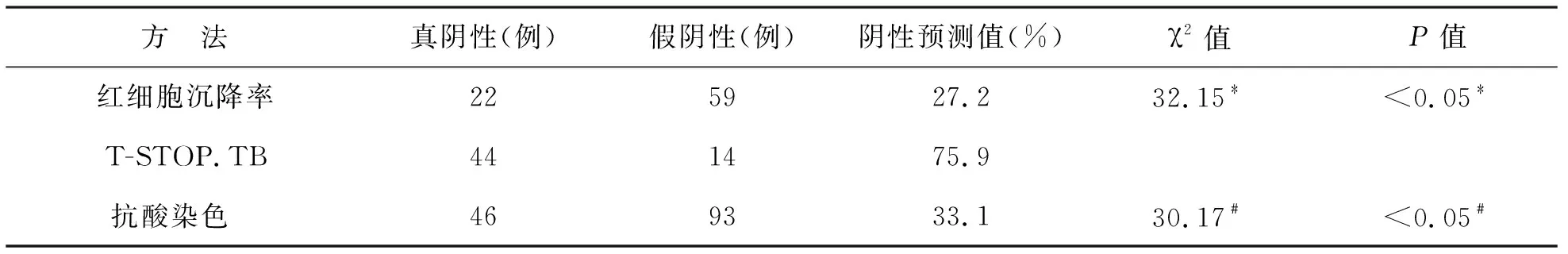
表4 T-STOP.TB、红细胞沉降率、抗酸染色阴性预测值
注:*T-STOP.TB VS 红细胞沉降率,﹟T-STOP.TB VS 抗酸染色
5 分析结核组与对照组T-SPOT.TB实验ESAT-6与CFP-10两种抗原斑点数分布情况,采用单样本Kolmogorov-Smirnov检验分析结核组两种抗原斑点数的正态性分别为Z=0.216,P=0.000;Z=0.403,P=0.00认为结核组两种抗原斑点数均为非正态分布。结核组ESAT-6抗原的斑点数中位数±四分位数间距为43.00±69.75, 对照组ESAT-6抗原的斑点数中位数±四分位数间距3.50±9.00;结核组 CFP-10抗原的斑点数中位数±四分位数间距为56.00±87.50;对照组CFP-10抗原的斑点数中位数±四分位数间距3.00±9.00。采用两独立样本非参数检验Mann-Whitney U分析两种抗原诊断结核的差异性,结果显示结核组T-SPOT.TB实验两种抗原阳性斑点数目均高于对照组(图1),且差异具有统计学意义(Z=-14.258,Z=-13.620,P=0.00)。

注:结核组与对照组比较,* P<0.05
6 上述结果可见,结核组两种抗原斑点数均为非正态分布,利用(P2.5,P97.5)计算其95%可信区间,结核组ESAT-6抗原的斑点数95%可信区间(4.03,400.00);CFP-10抗原的斑点数95%可信区间(4.03,500)。根据受试者工作特征曲线(ROC 曲线),ESAT-6抗原的斑点数cut-off值取17.5时,ROC曲线下面积为0.960(高于0.9),诊断结核的灵敏度和特异度分别可达到 81.9%和 98.7%(图2A);CFP-10抗原的斑点数cut-off值取19.0时,ROC曲线下面积为0.960(高于0.9),诊断结核的灵敏度和特异度分别可达到76.9%和 98.7%(图2B)。

图2 结核组T-SPOT.TB两种抗原斑点数ROC曲线
讨 论
近年来我国结核病疫情出现回升趋势,结核病防治形势严峻,任务紧迫,实验室的检验早期发现和准确诊断是降低结核病发病率、减少传播机会、控制结核病疫情的关键环节[9]。目前,临床诊断结核病的实验室检查方法比较多,但都并不理想,容易造成结核病的误诊及漏诊。
结核病是由结核杆菌感染引起的慢性传染病。结核菌可能侵入人体全身各种器官,潜伏期4~8周。其中73%以上发生在肺部[10],其他部位如颈淋巴、脑膜、腹膜、肠、皮肤、骨骼等也可继发感染。故涂片抗酸染色虽然操作简单、诊断快速、费用低廉,但检测结果受技术人员水平的影响,检测率低,且无法对肺外结核作出诊断[11],故敏感度低。
患者感染结核菌时结核病变呈活动性时,血中纤维蛋白原及球蛋白含量增加,红细胞沉降率会明显增快,但红细胞沉降率受影响因素较多,生理性如月经、妊娠、高龄以及增多的纤维蛋白原;病理性的有炎症、组织损伤、坏死、恶性肿瘤、高球蛋白血症、贫血、高胆固醇血症等,都能使红细胞沉降率变快。有文献报道41%活动性结核性胸膜炎血沉正常[12],而其特异度较差。
人与人之间呼吸道传播是本病传染的主要方式,传染源是排菌的肺结核患者。随着环境污染和艾滋病的传播,结核病发病率越发强烈。除少数发病急促外,临床上多呈慢性过程,常有低热、乏力等全身症状和咳嗽、咯血等呼吸系统表现[13]。结核菌感染的免疫反应主要是细胞介导的免疫反应,作为细胞介导反应的一部分,T淋巴细胞被结核菌抗原致敏,这些抗原再次刺激时,活化的效应T淋巴细胞,主要CD4、部分CD8细胞产生γ干扰素[14]。结核特异性T细胞检测实验将结核特异性抗原(ESAT-6/CFP-10)与外周血单个核细胞孵育,通过“双抗夹心法”检测释放的γ-干扰素,从而检测结核致敏的效应T淋巴细胞,判断患者是否存在结核感染,且T-SPOT.TB的T细胞定量应答反应可反映结核抗原负荷和疾病的活动性,随着活动性肺结核的有效治疗, 定量应答反应下降[15]。
本研究结果显示,T-SPOT.TB试验的敏感度、特异度、阳性预测值及阴性预测值均优于红细胞沉降率;T-SPOT.TB试验检测的敏感度及阴性预测值优于抗酸染色,特异度与阳性预测值与抗酸染色相当。且目前的报道都肯定了T-SPOT.TB试验的特异度和灵敏度[16]。进一步证实了T-SPOT.TB试验对结核病患者有较好的诊断价值。在差异性分析中, T-SPOT.TB试验无论是ESAT-6抗原还是CFP-10抗原都在结核组与对照组中有显著差异,对于结核病的诊断有极其重要的意义。此外,在ROC曲线分析中我们发现,T-SPOT.TB试验中ESAT-6抗原与CFP-10抗原对于诊断结核都有很好的敏感度和特异度,但CFP-10抗原相比ESAT-6抗原的敏感度稍差,在临床上要结合两种抗原结果综合诊断。值得注意的是,在经过抗结核治疗后的患者,其效应T淋巴细胞数目减少[15],可造成假阴性结果,部分正常人或者非结核病患者接触结核病患者可能发生潜伏感染而导致假阳性,故需要结合临床来判断。
综上所述,常用的结核病实验室的诊断方法难以满足临床早期准确诊断结核病的需要,但T-SPOT.TB检测方法以ESAT-6和CFP-10为结核特异性蛋白抗原,能够快速、准确的诊断结核病感染,对于控制传染源,降低感染率具有重要社会意义和流行病学意义,对于减少结核病额误诊漏诊率,提高结核感染诊断率和治愈率具有重要临床意义。
[1] Wallis RS, Maeurer M, Mwaba P,etal. Tuberculosis--advances in development of new drugs, treatment regimens, host-directed therapies[J].Lancet Infect Dis, 2016, 16: e34-46.
[2] 全国结核病流行病学抽样调查技术指导组. 2000年全国结核病流行病学抽样调查报告[J]. 中国防痨杂志,2002,(2):43-46.
[3] 杜森荣,侯秀英. 结核感染T细胞酶联免疫斑点试验对结核诊断价值的Meta分析[J]. 中国临床研究,2014,(5):526-529.
[4] 陆建红,陈国军,杜开齐,等. 结核T细胞酶联免疫斑点试验诊断结核感染的临床应用[J]. 武警医学,2013,24(10):866-868,871.
[5] Getnet F, Demissie M, Assefa N ,etal. Delay in diagnosis of pulmonary tuberculosis in low-and middle-income settings: systematic review and meta-analysis[J]. BMC Pulm Med ,2017,17: 202.
[6] Assael R, Cervantes J, Barrera G. Smears and cultures for diagnosis of pulmonary tuberculosis in an asymptomatic immigrant population[J]. Int J Gen Med ,2013, 6: 777-779.
[7] Rangaka MX, Cavalcante SC, Marais BJ,etal. Controlling the seedbeds of tuberculosis: diagnosis and treatment of tuberculosis infection[J]. Lancet, 2015, 386: 2344-2353.
[8] Perez-Camacho I, Rivero-Juarez A, Kindelan JM,etal. Present-day treatment of tuberculosis and latent tuberculosis infection[J]. Enferm Infecc Microbiol Clin, 2011,29(Suppl 1): 41-46.
[9] 储新民,孔建新. 酶联免疫斑点试验诊断结核的敏感性和特异性研究[J]. 安徽医科大学学报,2012,47(5):613-615.
[10] Karadakhy K, Othman N, Ibrahimm F,etal. Tuberculosis in sulaimaniyah, iraqi kurdistan: A detailed analysis of cases registered in treatment centers[J]. Tanaffos, 2016,15: 197-204.
[11] 唐硕润,梁 珍. 结核酶联免疫斑点试验、结核分枝杆菌DNA测定和痰涂片检测在肺结核诊断中的比较研究[J]. 中国当代医药,2013,20(34):122-123.
[12] 郑晓静,孙凤艳,陈 敏,等. 结核性胸膜炎积液与血沉的关系[J]. 临床肺科杂志,2005,10(1):84.
[13] Grimaud-Ayina M, Fain O, Lortholary O,etal. Neuromeningeal tuberculosis in northeastern suburbs of paris. nineteen cases[J]. Ann Med Interne (Paris), 2002,153: 75-81.
[14] Sauzullo I, Scrivo R, Mengoni F,etal. Multi-functional flow cytometry analysis of CD4+T cells as an immune biomarker for latent tuberculosis status in patients treated with tumour necrosis factor (TNF) antagonists[J]. Clin Exp Immunol ,2014,176: 410-417.
[15] Lancioni CL, Mahan CS, Johnson DF,etal. Effects of antiretroviral therapy on immune function of HIV-infected adults with pulmonary tuberculosis and CD4+>350 cells/mm3[J]. J Infect Dis, 2011, 203: 992-1001.
[16] 杨国平,叶敏霞,杨启生,等. γ-干扰素释放试验用于出入境人群结核病诊断的研究[J]. 国际检验医学杂志,2017,38(1):27-28,31.
