S100A2检测在非小细胞肺癌并发胸腔积液诊断中的价值
2018-06-12寇晓桂陈葆青
寇晓桂,陈葆青
西安市第四医院呼吸内科(西安 710004)
肺癌是发病率及致死率最高的恶性肿瘤,2012年,肺癌在全世界导致的死亡人数达到1,590,000例[1]。胸腔积液是肺癌患者常出现的一种临床症状。研究显示: 约10%~50%的恶性肿瘤患者以胸腔积液为首发临床症状[2]。癌性胸腔积液多因肿瘤累及转移至胸膜、释放趋化因子导致血管壁及胸膜通透性增加所致[3]。在临床工作中,通过测定胸腔积液中肿瘤相关物质的表达水平也成为判定良恶性胸腔积液的重要方法。然而,目前与肺癌关系密切的肿瘤标记物主要包括:癌胚抗原(CEA)、细胞角蛋白19片段(CYFRA21-1)等[4]。另一方面,相关研究表明: 通过联合测定胸腔积液中肿瘤标记物的表达水平可增加诊断的特异性及敏感性[5]。
S100A2蛋白是钙结合S100蛋白家族中重要的一个成员,其基因位于染色体1q.21。近些年来,这一钙结合蛋白家族中越来越多的成员被证实与多种恶性肿瘤有关[6]。S100A2也被证实在肺癌、大肠癌等恶性肿瘤中表达异常[7]。然而,S100A2在NSCLC相关胸腔积液中的表达情况尚未有研究证实,其临床价值也有待进一步挖掘。
资料与方法
1 一般资料 研究组选择我院2015年1月至2016年6月诊治的NSCLC患者43例的血清及胸水标本,均经过病理学明确诊断,均为初诊、尚未接受治疗的肺鳞癌、腺癌患者,并排除了转移性肺癌及有其它恶性肿瘤病史患者,其中男32例,女11例,年龄56~67岁,平均(61.02±1.51)岁。鳞癌20例,占46.5%,腺癌23例,占53.5%。对照组(39例血清来自于就诊于西安市第四医院的结核性渗出性胸膜炎患者,符合下列条件中任意一项即纳入对照组:胸水结核菌涂片阳性、胸膜活检病理为干酪样肉芽肿、胸水结核杆菌PCR阳性、胸水腺苷脱氢酶(ADA)明显升高(大于45U/L)。其中男27例,女12例,年龄55~64岁,平均(59.54±1.24)岁,无肿瘤病史及其他慢性疾病。两组在年龄、性别、吸烟史分类后相比较无统计学差异(P>0.05),具有可比性。
2 检测方法 测定S100A2水平的ELISA试剂盒采购于湖北武汉优尔生公司(USCN),CEA表达水平来自于患者住院资料,标本和信息的收集经过患者的知情并签署同意书。标本收集后离心10min,将样本每例各取100μl混合均匀,按10μl/ml加入蛋白酶抑制剂,然后将血清样本分装,编号,分组,储存于-80°C冰箱密封保存,备用。在S100A2标准品中,其浓度为40ng/ml(贮液)。将其稀释为20ng/ml, 10ng/ml, 5ng/ml, 2.5ng/ml,1.25ng/ml,0.625ng/ml,0.312ng/ml, 空白孔为标准品稀释液。实验过程包括:加样、加入检测溶液A、加入检测溶液B、加入终止液、测光密度。具体实验步骤严格参照试剂盒说明书。
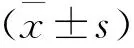
结 果
1 S100A2和CEA在两组血清和胸水的表达情况 见表1。研究组中血清S100A2值为16.48±1.33ng/ml,波动于0.99ng/ml与41.58ng/ml之间,对照组中血清S100A2值为11.1±1.16ng/ml,最小值为0.59ng/ml,最大值为35.98ng/ml,结果有统计学差异(P<0.01)。相比S100A2在血清中的表达水平,研究组S100A2在胸水中的表达水平明显升高。同样,S100A2在胸水中的表达值在研究组(45.40±2.44)及对照组(10.78±1.04)之间的差异具有统计学意义(P<0.01)。对于CEA,与对照组相比,其表达水平在研究组中亦明显升高[血清:40.34±13.61 ng/ml vs 2.27±0.13ng/ml(P<0.01);胸腔积液:105.10±27.14 ng/ml vs 2.41±0.17ng/ml(P<0.0001)。

表1 两组患者血清和胸水中的CEA和S100A2表达(ng/ml)
2 CEA和S100A2在不同类型肺癌患者血清和胸水中的表达 见表2。无论是血清还是胸水水平,S100A2在两种不同的病理类型组中均无统计学差异(P>0.05)。而相比于SCC患者,ADC患者的血清及胸水CEA均存在高表达(P<0.05或<0.01)。

表2 CEA 和 S100A2在不同类型肺癌患者血清及胸水中的表达(ng/ml)
3 血清及胸水S100A2、CEA表达水平ROC曲线 见图1~2。我们利用ROC曲线分别评估了S100A2及CEA在合并胸腔积液的NSCLC中的诊断价值。图1显示, S100A2的血清及胸水表达水平均可区分NSCLC及对照人群。前者AUC为0.743,特异度为71.8%,敏感度为76.7%,临界值(cut-off)为12.42ng/ml;后者AUC为0.962,特异度为100%,敏感度为88.4%,临界值(cut-off)为31.17ng/ml。图2显示,CEA同样可以区分实验组及对照组,且在胸水水平,其灵敏度及特异度均较S100A2高,血清水平AUC为0.806,特异度为99.7%,敏感度为69.8%,临界值(cut-off)为4.13 ng/ml;胸水水平AUC为1.000,特异度为100%,敏感度为100%,临界值(cut-off)为5.73ng/ml。
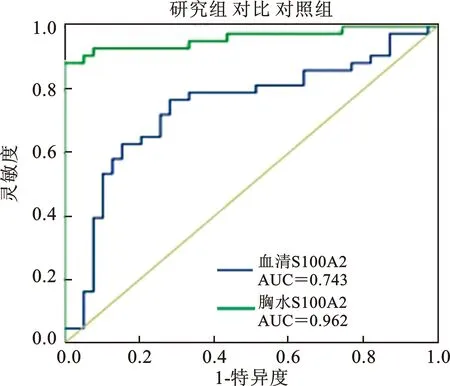
图1 两组患者血清及胸水S100A2表达水平ROC曲线

图2 两组患者血清及胸水CEA表达水平ROC曲线
讨 论
肺癌合并恶性胸腔积液,其产生机理一般认为与肿瘤所致毛细血管渗透性增加,原发肿块位于纵膈或继发纵膈淋巴结转移或放疗后纤维化所致淋巴管、血管回流受阻,压力增加,以及肿瘤细胞分泌或释放蛋白因子等有关[8]。脱落细胞学及胸膜活检的检查是恶性胸腔积液诊断的金标准。然而,两种方法的阳性率均较低[9],而诸如胸腔镜之类的检查创伤性又太大。相比之下,测定血清及胸腔积液中肿瘤标记物的水平被视作另一种有效判断良恶性胸腔积液的方法。我们通过研究与非小细胞肺癌关系密切的S100A2在合并胸腔积液的NSCLC患者血清及胸腔积液中的表达情况,期望为肺癌及恶性胸腔积液的诊断提供新的有价值的生物学标记物。
S100A2是S100蛋白家族中重要的成员,早期研究发现其在NSCLC中表达下降,视作抑癌蛋白,而后大样本研究发现其在早期NSCLC中表达升高,并与肿瘤转移和患者预后有关[10]。也有人认为S100A2可能在NSCLC中扮演双重角色:早期及晚期高表达,其他时期低表达。在相关基础的研究中,Sarwat Naz等利用S100A2稳定过表达的肺癌A549细胞株证实:S100A2可通过增加间质标记物的表达和降低上皮标记物的表达参与上皮间质转化进程(EMT),从而促进肿瘤细胞生长及远处转移[11]。过表达的S100A2还可增加p-Akt的活化,后者可在肿瘤细胞的EMT及侵袭进程中调节延长上皮细胞的生存周期。此外,S100A2还可通过调节多种基因表达而影响TGF-β/Smad3蛋白依赖信号通路从而间接影响EMT[12]。
本研究表明:S100A2在合并胸腔积液的NSCLC患者的血清及胸腔积液中均表达升高。与Wang等研究结果相比,我们的研究与其在NSCLC血清学研究结果一致[13]。而我们首次发现了S100A2在恶性胸腔积液中的诊断价值,相关的ROC曲线也表明S100A2区分良恶性胸腔积液的特异性及灵敏度均较高,这有可能成为肺癌及恶性胸腔积液诊断中的有效标记物。
虽然与传统的标记物CEA相比,S100A2区分良恶性胸腔积液尚不及前者,这可能与我们相对较小的标本数量有关,未来的研究中我们将纳入更多的标本量再次评估S100A2对合并胸前积液NSCLC的诊断价值。
[1] Islami F,Torre LA,Jemal A.Global trends of lung cancer mortality and smoking prevalence[J].Transl Lung Cancer Res,2015,4(4):327-338.
[2] Hu CY,Zhang YH,Wang T,etal.Interleukin-2 reverses CD8(+)T cell exhaustion in clinical malignant pleural effusion of lung cancer[J].Clin Exp Immunol,2016, 186(1):106-114.
[3] Lin JB,Lai FC,Li X,etal.Sequential treatment strategy for malignant pleural effusion in non-small cell lung cancer with the actived epithelial grow factor receptor mutation[J].J Drug Target,2017,25(2):119-124.
[4] 王 媛,张华丽.肿瘤标记物CEA、NSE、CA125、Pro GRP在肺癌诊断中的价值[J].陕西医学杂志,2016,45(1):14-15.
[5] Feng M,Zhu J,Liang L,etal.Diagnosticvalue of tumor markers for lung adenocarcinoma-associated malignant pleural effusion:a validation study and meta-analysis[J].Int J Clin Oncol,2017,22(2):283-290.
[6] Haase-Kohn C,Wolf S,Lenk J,etal.Copper-mediated cross-linking of S100A4, but not of S100A2, results in proinflammatory effects in melanoma cells[J].Biochem Biophys Res Commun,2011,413(3):494-498.
[7] Masuda T,Ishikawa T,Mogushi K,etal.Overexpression of the S100A2 protein as a prognostic marker for patients with stage II and III colorectal cancer[J].Int J Oncol,2016,48(3):975-982.
[8] 何宁一,洪月光.外敷中药配合腔内热化疗治疗肺癌合并胸腔积液疗效观察[J].陕西中医,2014,35(12):1576-1578.
[9] Rajawat GS,Batra S,Takhar RP,etal.Diagnostic yield and safety of closed needle pleural biopsy in exudative pleural effusion[J].Avicenna J Med,2017,7(3):121-124.
[10] Hountis P,Matthaios D,Froudarakis M,etal.S100A2 protein and non-small cell lung cancer.The dual role concept[J].Tumour Biol,2014,35(8):7327-7333.
[11] Naz S,Bashir M,Ranganathan P,etal.Protumorigenic actions of S100A2 involve regulation of PI3/Akt signaling and functional interaction with Smad3[J]. Carcinogenesis,2014,35(1):14-23.
[12] Reka AK,Kurapati H,Narala VR,etal.Peroxisome proliferator-activated receptor-gamma activation inhibits tumor metastasis by antagonizing Smad3-mediated epithelial-mesenchymal transition[J]. Mol Cancer Ther,2010,9(12):3221-3232.
[13] Wang T, Liang Y, Thakur A,etal.Diagnostic significance of S100A2 and S100A6 levels in sera of patients with non-small cell lung cancer[J].Tumor Biology,2015,37(2):2299-2304.
