黄连素对肝癌细胞系HepG2细胞体外迁移影响及其机制研究*
2018-06-12陈建卫朱忠辉宫卫东卫飞鹏刘晓宇李晓冰
陈建卫,高 娟,朱忠辉,宫卫东,卫飞鹏,刘晓宇,李晓冰
空军军医大学唐都医院介入放射科(西安 710038)
肝癌(Hepatocellular carcinoma)是我国最为常见的恶性肿瘤之一,具有易复发、易转移和预后差的特点,其发病率和致死率在我国居高不下[1]。我国每年约有40万人被确诊为肝癌。目前肝癌的治疗方式仍以手术切除为主,但对于无法切除的肝癌则只能选择放化疗,副作用巨大,给患者带来极大的精神负担,高效经济的肝癌治疗和预后药物一直是市场空白。除此之外,肝癌复发和转移是大多数患者在手术后面临的重要难题。因此,研究肝癌高复发率和高转移率的具体机制就显得尤为重要。
黄连素是临床上一种较为常见的天然生物碱药物,具有解热、抗炎[2]和抗肿瘤活性[3],且少有药物副作用。与化学合成药物相比,黄连素作为天然生物碱药物,展现出众多优势。现代药理学研究表明,黄连素对动物乳腺癌[4]、肺癌[5]、腹水瘤[6]等恶性癌症具有明显的治疗作用。同时,黄连素对肝癌细胞的细胞周期也表现出显著的阻滞作用[7]。此外,黄连素临床数据表明,其还有抗心律失常等作用。细胞实验结果表明,黄连素有较强的体外抗肿瘤活性[8],并且能诱导B16细胞分化,具有良好的生物活性,因此进一步探讨黄连素对肝癌细胞抑制作用的潜在机制对临床治疗有着重要指导意义。
有研究表明,癌症组织相比癌旁组织有着更低的自噬水平[9],癌症组织自噬水平的异常表达与其异常的细胞周期密切相关。大部分癌症细胞的细胞周期相比正常细胞更短,因此癌细胞能够迅速增殖。因此癌症细胞内环境稳态维护就尤为重要,破坏癌细胞的异常细胞周期也是常见的癌症治疗方式,如癌症的化学药物治疗。自噬是细胞维持自身内环境稳态的重要手段,同时也是细胞死亡的重要方式之一[10]。抗癌药物大多会影响肿瘤细胞自噬水平,而自噬是否参与黄连素对肝癌细胞的抑制作用依然少有报道。细胞自噬本身是个复杂的过程,细胞发生应激时,自噬能够防止有毒或致癌的损伤蛋白质和细胞器积累,抑制细胞癌变;然而癌症一旦发生,自噬为癌细胞提供营养,促进癌症发展。因此自噬在癌症发生发展过程中是一把有趣的双刃剑[11]。对于基础代谢异常的肝癌细胞而言,自噬极有可能发挥更为复杂的作用。本研究以人肝癌细胞系HepG2细胞为研究对象,阐述黄连素通过自噬抑制肝癌细胞体外迁移,为肝癌临床治疗提供新的方向。
材料与方法
1 材 料
1.1 人肝癌细胞系HepG2购自中科院上海生命科学院细胞资源中心。
1.2 DMEM高糖培养基(Hyclone公司);胎牛血清(四季青公司);青链霉素混合液、胰酶(Gibco公司);黄连素(上海信谊公司);3-MA(Sigma公司);ECL发光试剂盒、RIPA中强细胞裂解液、BCA蛋白测定试剂盒、MTT试剂盒(碧云天生物公司);LC3B抗体、β-actin抗体(Proteintech公司); 辣根过氧化物酶标记山羊抗兔二抗、山羊抗小鼠二抗(中杉金桥生物公司);GFP慢病毒、Polybrene(汉恒生物公司);PVDF膜(Millipore公司);24孔细胞培养板、96孔细胞培养板(Corning公司);甲醇、二甲基亚砜(四川科隆)。
2 方 法
2.1 MTT细胞活力检测:于细胞培养瓶中胰酶消化HepG2细胞后,以同体积10%胎牛血清培养基终止消化,细胞悬液转移至离心管中,1200 rpm离心后弃上清。2 ml培养基重悬HepG2细胞,细胞计数,稀释细胞悬液。以每孔2×104个细胞数接种至96孔细胞培养板中。HepG2细胞接种24 h后,更换10%胎牛血清培养基,并进行不同浓度黄连素处理24 h。96孔细胞培养板每孔加入MTT溶液20 μl,37 ℃孵育至紫色结晶生成,吸去细胞培养板中的上层培养基,避免触碰底部紫色结晶,每孔加入150 μl 二甲基亚砜,96孔细胞培养板置于摇床上轻轻震荡溶解板底紫色结晶。酶标仪检测各孔在490 nm波长吸光度。
2.2 蛋白质印记法检测蛋白相对表达水平: RIPA裂解液加入细胞样品中,冰上静置30 min后,样品收集转移至1.5 ml EP管中,4 ℃ 12000 r/min 离心30 min,吸取上层清液,转移至新1.5 ml EP管中。样品采用BCA蛋白测定试剂盒进行蛋白定量。以每个样品20 μg蛋白量上样,SDS-聚丙烯酰胺凝胶电泳恒压80 V分离蛋白,PVDF膜60 V恒压转印2 h。5%脱脂奶粉室温下封闭1 h后,4 ℃封入塑封膜中孵育一抗(LC3B 1∶1000;β-actin 1∶3000)过夜。TBST清洗PVDF膜3遍后,于室温下孵育辣根过氧化物酶标记的二抗(1∶2000) 1 h。TBST清洗PVDF膜6遍后,置于塑封膜上,加入适当的ECL发光液后,转移入化学发光凝胶成像系统曝光。图像使用Image J软件进行分析,将目的蛋白条带灰度值转为OD值,并与β-actin跳大进行比较,以相对值代表蛋白相对表达量。
2.3 细胞划痕迁移实验: HepG2细胞以每孔1×105个细胞接种于24孔板中,约24 h后观察细胞生长情况。待细胞均匀贴壁24孔细胞培养板80%面积后,使用移液枪头在24孔细胞培养板底部划上“十”字,吸出原有培养基,使用PBS清洗漂浮的细胞3遍。在24孔细胞培养板中重新加入10%胎牛血清培养基,并进行黄连素和3-MA药物干预。分别于药物处理0h和24 h,在荧光显微镜下拍照记录细胞位置,观察细胞迁移情况并使用Image J软件进行迁移距离测量。
2.4 细胞慢病毒转染:胰酶消化贴壁的HepG2细胞,10%胎牛血清培养基终止消化后转移至离心管中,1200 rpm离心后弃上清。离心管中加入2 ml培养基重悬HepG2细胞,细胞计数,稀释细胞悬液,每孔细胞数控制在4×104至6×104个细胞。将HepG2细胞重悬于0.5 ml无血清DMEM培养基中,加入0.5 μg polybrene和GFP慢病毒,轻轻混匀,避免气泡产生,病毒感染MOI值为5。将含有慢病毒的细胞悬液转移至24孔细胞培养板中,每孔500 μl细胞悬液,培养48 h后,更换10%胎牛血清培养基。加入嘌呤霉素纯化感染的细胞3~5 d,显微镜下观察95%以上细胞携带绿色荧光后,进行HepG2 GFP细胞传代、保种冻存以及细胞划痕迁移实验。
3 统计学方法 采用SPSS 16.0统计学软件进行数据分析,数值均采用均数±标准差表示,两组间采用t检验进行显著性分析,多组间采用ANOVA进行显著性分析,以P<0.05为差异有统计学意义。
结 果
1 不同浓度黄连素对Hepg2细胞存活的影响 为确认黄连素对HepG2细胞存活的影响,我们选择10μmol/L、25μmol/L和50μmol/L浓度的黄连素处理HepG2细胞24 h。MTT实验结果显示,与溶剂对照组相比,25μmol/L和50μmol/L的黄连素能够显著降低HepG2细胞的存活;但10μmol/L黄连素处理组并未发现细胞活力显著降低(图1)。实验结果证实,黄连素对HepG2细胞具有细胞毒性作用,且存在剂量依赖性,但低剂量黄连素并未表现出明显的细胞毒性作用。
2 黄连素抑制HepG2细胞体外迁移 考虑到黄连素对HepG2细胞的杀伤作用,为避免HepG2细胞过量死亡对迁移的影响,我们选择低剂量10μmol/L黄连素,观察其对HepG2细胞体外迁移的作用。使用黄连素处理HepG2 GFP荧光细胞,并在0 h和24 h拍照记录其细胞位置。细胞划痕迁移实验结果表明,10μmol/L黄连素显著抑制HepG2细胞的体外迁移(图2)。
3 自噬参与黄连素对HepG2细胞体外迁移的调控 使用10μmol/L黄连素处理HepG2细胞,LC3B-Ⅱ蛋白表达水平随时间依赖性变化,且在24 h达到峰值(图3 A)。黄连素作用于HepG2细胞后,出现抑制迁移和促进自噬的作用,考虑两者是否存在调控作用。为证明HepG2细胞自噬和迁移的关系,我们使用自噬抑制剂3-MA干预,观察其对黄连素抑制HepG2细胞迁移的影响。实验结果表明,3-MA能够逆转10 μmol/L黄连素对HepG2细胞体外迁移作用(图3 B)。以上结果提示,黄连素通过HepG2细胞自噬,调控其体外迁移。

图1 不同浓度的黄连素对HepG2细胞活力的影响

图2 黄连素抑制HepG2细胞体外迁移
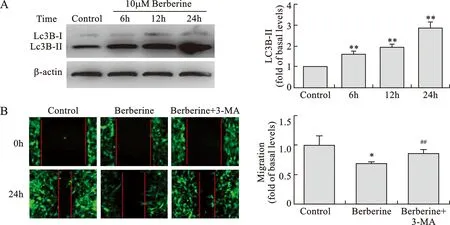
图3 自噬参与黄连素对HepG2细胞迁移的作用
讨 论
癌症致死率居高不与癌细胞能够适应各种恶劣条件密切相关,如血管性介入治疗导致的营养缺乏。不仅如此,肝癌还具有很强的侵袭性和转移性,目前仍然以手术切除为主要治疗手段,但术后易转移、易复发仍然是一大难题。因此,寻找新的化学合成药物或天然药物是解决肝癌术后转移和复发问题的关键。
细胞自噬伴随癌症发生发展过程,并且扮演重要角色[12]。癌症发生后,自噬参与癌症细胞能量供应,促进癌症发展[11]。抗癌药物治疗能够诱导癌细胞自噬水平变化,很多手术方式同样能够改变细胞自噬水平,如血管介入引起饥饿环境改变癌细胞自噬水平[13]。在药物或手术干预条件下,癌细胞自噬水平发生变化,其自噬调节作用是否发生变化?自噬作为细胞清除异常折叠蛋白和损伤细胞器的重要方式,一直以来被认为是细胞内环境的保护者[14]。近年来,过量自噬被证明参与细胞死亡调控,自噬也被认为是一种细胞新的死亡方式。如何利用自噬的双重作用治疗癌症是当前基础医学研究所面临的重要问题之一。此外,目前还未有针对自噬关键蛋白LC3B的工具药物面世,传统的自噬调控工具药物3-MA等也很难用于临床治疗。黄连素作为临床上较为常见的天然药物,具有杀菌、抗炎、降血压、降血脂等功效,其对肝癌细胞也表现出明显的细胞毒性作用。体外实验表明,黄连素对HepG2的细胞活力有显著的抑制作用,并且呈现剂量和时间相关性。在此结果上,黄连素对HepG2细胞除了细胞毒性作用,是否还存在其他作用,如抑制其细胞迁移。为探究黄连素对HepG2细胞的迁移作用,我们选择低剂量的黄连素作用于肝癌细胞,避免因细胞毒性造成迁移实验假阳性结果。低剂量黄连素尚未表现出显著的细胞毒性作用,但显著地抑制HepG2细胞迁移,并且引起肝癌细胞发生自噬。进一步实验发现,自噬抑制剂3-MA能够逆转黄连素对肝癌细胞的迁移抑制作用,这表明黄连素通过自噬抑制肝癌细胞的体外迁移。黄连素干预HepG2细胞后,自噬发挥"有害"作用,抑制HepG2细胞体外迁移,这一结论与传统认识相悖。从生物体整体角度理解,黄连素干预肝癌细胞后,自噬保护机体不被癌细胞侵犯,维护机体的正常新陈代谢,这与自噬是机体"保护者"观点相一致。
自噬在不同组织、不同器官中同样发挥着不同的作用,这也一定程度上体现了自噬在癌症中的复杂作用[15]。研究自噬与癌症的关系,应从单器官或单细胞角度出发,以便清晰的揭示自噬在其癌症发生发展过程中的具体机制。体外细胞模型不能很好的模拟细胞真实的生存状态,因此自噬相关基因全身敲除小鼠和自噬相关基因条件性敲除小鼠的开发显得极为重要,也是自噬研究过程的里程碑。山东大学构建了心肌细胞特异性ATG5基因缺失小鼠进行心肌细胞自噬相关研究[16]。上海交通大学为更好地研究肠上皮细胞自噬对肠道微环境的影响,使用了肠上皮细胞特异性敲除ATG5/ATG7基因小鼠[17]。随着自噬研究的更加深入,自噬与肝癌的关系一定会被深入挖掘。
综上所述,研究自噬在肝癌发生发展中的作用对未来肝癌临床治疗和术后康复有着重要意义,极有可能为抗癌药物的开发提供新的靶点和可靠依据。
[1] Hernandez-Gea V,Toffanin S,Friedman SL,etal. Role of the microenvironment in the pathogenesis and treatment of hepatocellular carcinoma[J]. Gastroenterology,2013,144(3):512-527.
[2] Jiang Y,Huang K,Lin X,etal. Berberine attenuates NLRP3 inflammasome activation in macrophages to reduce the secretion of interleukin-1β[J]. Ann Clin Iab Sci,2017,47(6):720-728.
[3] Palmieri A,Iapichino A,Cura F,etal. Pre-treatment with berberine enhances effect of 5-fluorouracil and cisplatin in HEP2 laryngeal cancer cell line[J]. J Biol Regul Homeost Agents,2018,32(2 Suppl. 1):167-177.
[4] Kim S,Lee J,You D,etal. Berberine suppresses cell motility through downregulation of TGF-beta1 in Triple negative breast cancer cells[J]. Cell Physiol Bio Chem,2018,45(2):795-807.
[5] Meng M,Geng S,Du Z,etal. Berberine and cinnamaldehyde together prevent lung carcinogenesis[J]. Oncotarget,2017,8(44):76385-76397.
[6] Bhatnagar P,Kumari M,Pahuja R,etal. Hyaluronic acid-grafted PLGA nanoparticles for the sustained delivery of berberine chloride for an efficient suppression of Ehrlich ascites tumors[J]. Drug Deliv Transl Res,2018(2):1-5.
[7] Li F,Dong X,Lin P,etal. Regulation of Akt/FoxO3a/Skp2 axis is critically involved in berberine-induced cell cycle arrest in hepatocellular carcinoma cells[J]. Int J mol Sci,2018,19(2):327-340.
[8] 刘 冰,臧 琳,金 嵩,等.黄连素抗胶质瘤的作用机制[J].中国老年学,2016,36(16):3900-3901.
[9] Qu X,Yu J,Bhagat G,etal. Promotion of tumorigenesis by heterozygous disruption of the beclin 1 autophagy gene[J]. J Clin Invest,2003,112(12):1809-1820.
[10] Sledzinski P,Zeyland J,Slomski R,etal. The current state and future perspectives of cannabinoids in cancer biology[J]. Cancer Med,2018,7(3):765-775.
[11] Wang RC,Wei Y,An Z,etal. Akt-mediated regulation of autophagy and tumorigenesis through Beclin 1 phosphorylation[J]. Science,2012,338(6109):956-959.
[12] 李东繁,杜旭升,刘 安.PM2.5对大鼠气管上皮细胞氧化应激及自噬的影响[J]. 陕西医学杂志,2017,46(1):3-4.
[13] 周 云,付秀莉,高 远,等. 饥饿诱导环境下人牙周膜成纤维细胞的自噬作用研究[J]. 陕西医学杂志,2014,43(2):152-154.
[14] 孙远航.绵羊肺炎支原体诱导肺脏上皮细胞自噬的初步研究[D].银川:宁夏大学,2016.
[15] 吴雅春.自噬在结肠癌及胃癌细胞体外药物干预过程中的作用研究[D].杭州:浙江大学,2010.
[16] 秦庆云. 在自噬功能障碍情况下Nrf2调节失代偿性心脏重构及功能障碍的机制研究[D]. 济南:山东大学,2016.
[17] 赵文静. 肠上皮特异性敲除自噬基因Atg5/Atg7小鼠肠道微生物宏基因组测序分析[D].上海:上海交通大学,2015.
