胰岛素泵持续皮下注射胰岛素对1型糖尿病酮症酸中毒患儿机体代谢紊乱纠正效果研究
2018-06-12王旭艳邹宗毅
李 佳,王旭艳,刘 超,邹宗毅,陈 镜
西安市儿童医院(西安 710003)
1型糖尿病(T1DM)是临床常见的慢性代谢性疾病,胰岛β细胞破坏造成的胰岛素的绝对分泌不足是该病的主要原因,持续的血糖升高是其主要临床表现。相关研究显示[1]:受环境污染、生活方式改变等多种因素影响,糖尿病发生率正逐年升高,因其并发症所致的死亡患者占疾病死亡的第5位,我国作为糖尿病高发国家,近30年来患病率增加约10倍之多,其相关并发症危害也受到高度关注。研究显示:儿童作为T1DM的高发人群,其发病率也呈爆发式升高,且较成年人出现并发症几率更高,危害更为严重[2]。糖尿病酮症酸中毒(DKA)是糖尿病最常见的并发症,常因治疗控制不佳、急性感染等因素所致,具有起病急、病情进展迅速及预后差等特点,以严重血糖升高、高血酮症、酸碱水电解质紊乱为主要病理表现,可引起多器官功能的损害,具有较高的疾病致死率。研究发现:T1DM患儿多达20.0%~30.0%[3],以DKA为首发症状起病,且DKA发生率与年龄呈负相关,极大增加患儿治疗难度。研究证实:有效控制血糖至正常水平,纠正机体酸中毒和高酮血症是治疗儿童T1DM的关键。胰岛素是儿童T1DM主要治疗药物,既往临床多行MSII治疗,但多次皮下注射不仅加重患儿痛苦,降低治疗依从性,且伴随强化治疗开展,导致其疗效受限、低血糖风险增加等多种问题[4]。研究发现[5],CSII能较好模拟胰岛素生理功能,更利于机体血糖水平的稳定,更好改善患儿中毒症状,减少低血糖等并发症风险。因此,本研究笔者就对MSII和CSII治疗T1DM患儿疗效及安全性,以及对血细胞因子表达影响展开报道,旨在为临床提供指导。
资料与方法
1 一般资料 选取我院2015年12月至2017年3月收治的1型DKA患儿94例,纳入标准[6]:①均符合2010年世界卫生组织(WHO)关于TIDM诊断标准;②年龄均在2~15岁;③未合并严重心脑血管、肝肾肺等器官组织疾病;④患儿或家属均自愿参与并签署知情同意书。排除标准:①因药物、消化道出血等原因等因素所致的DKA;②2型糖尿病患儿;③对本研究药物过敏或近期服用免疫抑制剂;④合并急慢性感染、免疫系统、血液系统等严重疾病;⑤合并恶性肿瘤。采用随机数字法将其分为对照组和观察组,每组各47例。对照组患儿中,男30例,女17例,年龄2~15岁,平均8.20±5.68岁,病程5个月至6年,平均2.79±0.88年;观察组患儿中,男28例,女19例,年龄2~15岁,平均8.14±5.62岁,病程4个月至5年,平均2.61±0.83年。两组患儿在性别、年龄及病程等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2 治疗方法 两组患儿入院后均给予常规纠正DKA疗法治疗,包括抗生素抗感染、及时静脉补液、营养支持等及对症治疗等。观察组患儿应用胰岛素泵皮下持续输注生物合成胰岛素治疗,首先以0.1U/(kg·h)剂量和滴速治疗,当尿酮转阴和酸中毒消退后,将剂量调整为0.6~1.0U/(kg·d),同时餐前需追加胰岛素治疗。对照组患儿首先接受生物人工合成胰岛素持续静脉滴注治疗,开始以0.1U/(kg·h)剂量,随后根据血糖控制效果调节剂量,当血糖控制在13.0 mmol/L时改为4.0 g 5.0%葡萄糖注射液与1U胰岛素混合滴注,当尿酮转阴和酸中毒消失后,改用皮下注射胰岛素治疗,于三餐前及睡前皮下注射治疗。
3 观察指标 ①比较两组患儿的血糖达标时间、DKA纠正时间、尿酮转阴时间、pH值纠正时间、每日胰岛素用量、住院时间及低血糖发生率;②比较两组患儿治疗前后的二氧化碳结合力(CO2-CP)、糖化血红蛋白(HbAlc)、阴离子间隙(AG)、C肽等指标水平;③比较两组患儿治疗前后的巨噬细胞移动抑制因子(MIF)和单核细胞趋化蛋白-1 (MCP-1)表达水平。
4 检测方法 采用德国拜耳血气分析仪监测两组患儿pH值、酸碱水电解质代谢变化;同时采用CGMS-2009型实时动态血糖监测仪(湖南天泰保健器械销售有限公司)监测血糖水平变化;采用微标法测定治疗前后HbAlc水平,试剂盒由沈阳万类生物科技有限公司生产,采用酶联免疫吸附法(ELISA)测定MIF和MCP-1表达水平,试剂盒由生产,所有步骤均严格参考操作说明书进行。
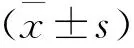
结 果
1 两组患儿疗效指标比较 见表1。观察组患儿的血糖达标时间、DKA纠正时间、尿酮转阴时间、pH值纠正时间、每日胰岛素用量、住院时间均明显低于对照组(P<0.05)。
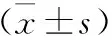
表1 两组患儿疗效指标比较
注:与对照组比较,*P<0.01
2 两组患儿治疗前后的各T1DM转归指标比较 见表2。两组患儿的基线CO2-CP、HbAlc、AG及C肽水平比较均无统计学差异(P>0.05);治疗后,观察组患儿的CO2-CP和C肽水平均明显高于对照组(P<0.01),而HbAlc和AG水平均明显低于对照组(P<0.01)。
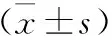
表2 两组患儿治疗前后各T1DM转归指标比较
注:与对照组比较,*P<0.01;与治疗前比较,#P<0.05
3 两组患儿治疗前后的MIF和MCP-1表达水平比较 见表3。两组患儿治疗前的MIF和MCP-1表达水平比较均无统计学差异(P>0.05);治疗后,观察组患儿的MIF和MCP-1表达水平均明显低于对照组(P<0.01)。
4 两组患儿的低血糖发生率比较 观察组患儿的低血糖发生率为4.26%,对照组患儿的低血糖发生率为19.19%,观察组明显低于对照组(P<0.05)。
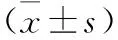
表3 两组患儿治疗前后MIF和MCP-1表达水平比较
注:与对照组比较,*P<0.01;与治疗前比较,#P<0.05
讨 论
糖尿病是儿童常见的慢性代谢性疾病,且多以T1DM为主,主要因机体胰岛素β细胞破坏引起的胰岛素绝对分泌不足所致,机体血糖如得不到及时控制,可导致各系统急慢性感染、神经病变、心血管病变以及DKA等多种并发症,直接危及患儿生命安全。研究显示[7]:DKA是儿童T1DM最常见的急性并发症,常由急性感染、过度劳累、暴饮暴食及应激反应的因素引起,具有起病急、病情进展快及多变等特点,是造成T1DM患儿死亡的重要原因,且患儿往往就诊时已合并DKA,极大提高临床就诊难度。研究显示[8]:当T1DM患儿出现DKA时,机体血糖水平可出现显著升高,并伴有胰岛素严重分泌不足,引起脂肪大量分解产能,而该过程中酮体过多产生,超过正常肝肾代谢能力,使血液中酮体聚集,导致机体酸中毒,直接威胁患儿生命安全。而1型DKA患儿对胰岛素敏感度较高,机体血糖波动幅度大。因此,如何在短时间内控制血糖和HbAlc至正常水平,纠正机体中毒状态是抢救1型DKA患儿的关键所在[9]。
研究证实[10],强化胰岛素治疗1型DKA患儿最强有力的治疗手段,可迅速控制机体血糖,促进胰岛β细胞功能恢复,抑制脂肪分解产生酮体,从而改善机体重症症状,并能抑制视网膜、神经、肾脏及心血管并发症进展。小剂量胰岛素静脉输注是既往常用的治疗方法,根据患儿血糖波动情况调整胰岛素用量,促进血糖及酮体代谢恢复。但研究发现:该方法每日需多次行皮下注射,胰岛素剂量控制难度大,无法实现持续性治疗,导致机体胰岛素分布不均匀,易诱发低血糖甚至脑水肿等并发症[11]。同时多次皮下注射易造成患儿依从性降低,影响胰岛素治疗疗效。CSII在临床开展已有20余年,被称之为“人工胰岛”[12],其优势体现在微电脑控制下的人工智能控制,经微电脑控制下的脉冲式皮下注射模式,有效模拟生理胰岛素分泌,实现24h动态胰岛素合理补充,使夜间和用餐间期血糖更为稳定,同时根据食物类型及用量,调节胰岛素剂量及输注方式,保证了用餐前后血糖稳定,降低低血糖发生率,并能减少每日胰岛素用量,使血糖持续维持在理想范围,抑制脂肪过度分解从而减少酮体生成,进而纠正DKA状态[13]。本研究结果显示,观察组患儿的血糖达标时间、DKA纠正时间、尿酮转阴时间、pH值纠正时间、每日胰岛素用量、住院时间及低血糖发生率均明显低于对照组,表明CSII对1型DKA患儿的降血糖和改善DKA效果更为迅速,且控制血糖效果更好,使低血糖发生率及胰岛素用量得以降低。研究证实:1型DKA患儿氧化应激明显增强,并伴有炎症因子和脂质过氧化物大量生成,出现二氧化碳结合力(CO2-CP)降低和阴离子间隙(AG)增加等代谢性酸中毒表现。本研究结果显示:观察组治疗后的CO2-CP明显高于对照组,而AG明显低于对照组,证实CSII对1型DKA患儿DKA纠正效果更佳。既往研究证实,MIF和MCP-1表达与2型糖尿病发生发展密切相关。而最近研究发现[14],MIF和MCP-1同样参与儿童T1DM发生发展,参与心血管、肾脏等并发症发生,对患儿预后转归具有一定指导意义。本研究结果显示:观察组治疗后的MIF和MCP-1表达水平均明显低于对照组,进一步证实CSII对患儿血糖控制和延缓并发症进展效果更佳。
综上所述,胰岛素泵持续皮下注射胰岛素能有效纠正1型DKA患儿机体代谢紊乱,促进中毒症状消退,抑制血细胞因子表达,且治疗安全性较高。
[1] 郭 红,白 玲,米尔班.1型糖尿病患儿胰岛素泵治疗与多次皮下注射胰岛素强化治疗效果比较[J].中国医药,2014,9(3):342-344.
[2] Cohen M,Leibovitz N,Shilo S,etal.Subcutaneous regular insulin for the treatment of diabetic ketoacidosis in children[J].Pediatric Diabetes,2016, 18(4):290-296.
[3] 刘贵阳,辜 勇,廖学东,等.不同胰岛素给药方式救治糖尿病酮症酸中毒临床研究[J]. 现代生物医学进展,2013,13(26):5075-5078.
[4] 庞雅玲,杨丽华.胰岛素泵治疗对2型糖尿病合并妊娠产妇血糖控制及新生儿的影响观察[J].中国妇幼保健,2016,31(24):5501-5503.
[5] Blackman SM,Raghinaru D,Adi S,etal.Insulin pump use in young children in the T1D Exchange clinic registry is associated with lower hemoglobin A1c levels than injection therapy[J].Pediatric Diabetes,2014,15(8):564-572.
[6] 段素静,谌剑飞,谭 薇.短期持续胰岛素输注治疗酮症起病的2型糖尿病疗效观察[J]. 中西医结合心脑血管病杂志,2013,11(3):363-364.
[7] 叶先智.不同方案胰岛素静注治疗糖尿病酮症酸中毒疗效对比研究[J].实用临床医药杂志,2015,19(15):103-105.
[8] Aronson R,Reznik Y, Conget I,etal. Sustained efficacy of insulin pump therapy compared with multiple daily injections in type 2 diabetes: 12‐month data from the OpT2mise randomized trial[J]. Diabetes Obesity & Metabolism, 2016, 18(5):500-507.
[9] 李东风.小剂量胰岛素持续静脉滴注联合胰岛素泵治疗糖尿病酮症酸中毒的疗效观察[J].山西医药杂志,2013,42(6):671-672.
[10] 余晓慧.短期持续皮下胰岛素输注对初诊2型糖尿病患者胰岛功能、血脂及C反应蛋白的影响[J].中国综合临床,2014,30(8):863-865.
[11] Peters AL, Henry RR,Thakkar P,etal.Diabetic ketoacidosis with canagliflozin, a sodium-glucose cotransporter 2 inhibitor, in patients with type 1 diabetes[J].Diabetes Care,2016,39(4):532-539.
[12] Bruce B,Beck RW,Ruedy KJ,etal.Effectiveness of early intensive therapy on β-cell preservation in type 1 diabetes[J].Diabetes Care,2013, 36(12):4030-4035.
[13] 高秀艳.门冬胰岛素和生物合成人胰岛素治疗妊娠期糖尿病的疗效观察[J].中国妇幼保健,2014,29(19):3068-3070.
[14] Reznik Y,Cohen O,Aronson R,etal.Insulin pump treatment compared with multiple daily injections for treatment of type 2 diabetes (OpT2mise): a randomised open-label controlled trial[J]. Lancet, 2014, 384(50):1265-1272.
