外泌体在人类免疫缺陷病毒1型感染中的研究进展
2018-06-12邱勇马晶曾毅
邱勇,马晶,曾毅
1. 北京工业大学生命科学与生物工程学院,北京 100124; 2. 中国疾病预防控制中心病毒病预防控制所传染病预防控制国家重点实验室,北京 102206
外泌体作为细胞分泌的结构和组分中被研究得最为明确的纳米颗粒,自1983年在绵羊网织红细胞培养上清液中发现以来[1],广泛用于各种生理病理机制研究。最初,研究者认为外泌体是细胞排除代谢废物的工具;后来证实,外泌体能独立于自分泌、旁分泌、内分泌、细胞接触等经典途径来促进细胞间的信号传递,参与生理病理调节。病毒相关研究发现,外泌体能转运有活性的病毒蛋白、病毒核酸、病毒粒子及病毒相关免疫分子,成为病毒感染机制、病毒免疫调节、抗病毒药物载体等研究领域中的热点。目前已证实,多种病毒可借助外泌体的生物学特性进化出有利于自身复制和感染的策略,其中RNA病毒尤为突出。此类病毒能将自身组分载入外泌体,实现胞间传播并增强后续感染;还可能劫持外泌体形成过程来完成病毒组装并获得免疫逃避[2-3]。人类免疫缺陷病毒1型(human immunodeficiency virus type 1,HIV-1)是首个用于外泌体研究的RNA 病毒,也是目前研究最多、最深入的病毒之一。由于对外泌体形成及其体内作用机制的认识尚不完善,以其为基础的 HIV-1感染病理机制更是知之甚少,导致研究外泌体与HIV-1感染的关系极具挑战性。本文着眼于HIV-1,根据目前相对清楚的研究结果,介绍外泌体的生物源性和特性,并重点阐明HIV-1如何通过外泌体促进自身传播及外泌体如何介导HIV-1感染相关免疫反应,探讨外泌体在HIV-1感染研究中的应用前景及障碍,为进一步了解外泌体与HIV-1感染的关系提供新认识。
1 外泌体的生物源性和特性
外泌体是大多数动物细胞代谢过程中分泌的磷脂双层膜包裹的纳米颗粒,直径50~100 nm,密度 1.13~1.19 g/cm3。一般认为,细胞膜经内吞作用在胞质中形成早期核内体,早期核内体向其腔内出芽,形成含有多个管腔内泡(intraluminal vesicle,ILV)的成熟核内体,即多囊泡体(multivesicular body,MVB)。MVB与胞膜融合后,将ILV释放到胞外,即为外泌体。该过程经两次膜向内折叠,使细胞膜来源的表面分子在外泌体膜上保留了原有的拓扑结构[4]。EVPedia[5],Vesiclepedia[6]和ExoCarta[7]等数据库显示,已发现的外泌体内含物中蛋白、核酸、脂质均达数千种,这些分子大多数继承于外泌体母细胞,也有部分为外泌体所特有,且不同细胞和组织液来源的外泌体在内含物和表面分子的种类及数量方面有所差异。大量研究表明,外泌体形成和内含物分拣机制主要受来自Rab家族[8-9]、四跨膜蛋白家族[10-11]、内吞体分选转运复合物(endosomal sorting complex required for transport,ESCRT)家族[12-13]成员的调控,但该过程尚缺乏精准的描述。分泌到胞外的外泌体,可通过膜融合、胞吞、细胞类型特异性吞噬方式进入受体细胞[14-16]。在前临床和临床试验中,根据大小、密度、富集度、表面分子种类等特性可将外泌体从体液和体外细胞培养上清液中分离。分离物中通常会伴随部分微泡(microvisicle,MV)和凋亡小泡(apoptotic vesicle,AV)等,与外泌体的大小、密度、膜蛋白种类等特性部分重叠,因此很难对外泌体进行彻底分离。为描述方便,研究者习惯将分离所得混合物统称为细胞外囊泡(extracellular vesicle,EV)。国际细胞外囊泡协会 (International Society for Extracellular Vesicles,ISEV)在2014年对外泌体进行了准确定义,以其表面特殊标记,如TSG101、Alix、flotillin 1、四跨膜蛋白(CD9、CD63、CD81)和某些整合素作为区别外泌体与其他EV的依据[17]。
2 外泌体与HIV-1的基本关系
在生理特性上,外泌体与HIV-1有很多相似之处[18]。它们的形成均依赖胞中核内体系统,如ESCRT家族介导的出芽机制;颗粒大小相当,均为100 nm左右;均由含蛋白的脂双层膜包绕而成;均能携带遗传物质。
在生理功能上,外泌体能促进HIV-1感染及其相关免疫反应[19]。感染细胞内,HIV-1可将某些病毒蛋白与核酸载入外泌体,传递至靶细胞促进后续感染。同时,HIV-1可能劫持外泌体的形成过程来完成病毒组装,或将整个病毒颗粒包裹在外泌体内获得免疫逃避。 HIV-1感染也会引发机体内一系列外泌体介导的HIV-1相关免疫反应,主要体现在外泌体对机体内抗HIV-1天然免疫分子的传递。目前,在HIV感染或非感染细胞产生的外泌体中,部分蛋白和核酸与HIV感染存在密切关系已得到证实(图1)。
临床应用中,外泌体可作为HIV-1感染进程的监视指标和抗HIV-1感染药物载体。在HIV-1感染不同阶段,外泌体携带的病毒成分和病毒相关免疫分子的种类和丰度会发生变化,检测这一变化可对艾滋病病情进行跟踪;而某些组织液来源的外泌体本身就携带抗HIV-1免疫分子,且工程化的外泌体能作为靶向药物载体已得到证实,使得将外泌体改造为抗HIV-1感染药物载体成为可能。
3 外泌体与HIV-1感染
3.1 外泌体传递HIV-1蛋白
HIV-1感染细胞中,外泌体可携带某些病毒蛋白,目前发现的有负调控因子(negative regulatory factor,Nef)[20]和群特异性抗原(group-specific antigen,Gag)[21]。
作为HIV-1 复制相关的毒力因子,Nef是目前研究最多的外泌体相关病毒蛋白。Nef分泌调节区与线粒体热休克蛋白70(mitochondrial 70 kD heat shock protein,mtHsp70)相互作用,使大部分Nef 被分拣入外泌体,经外泌体传递,Nef进入靶细胞,诱导细胞凋亡、淀粉样蛋白发生、 血脑屏障破坏等。
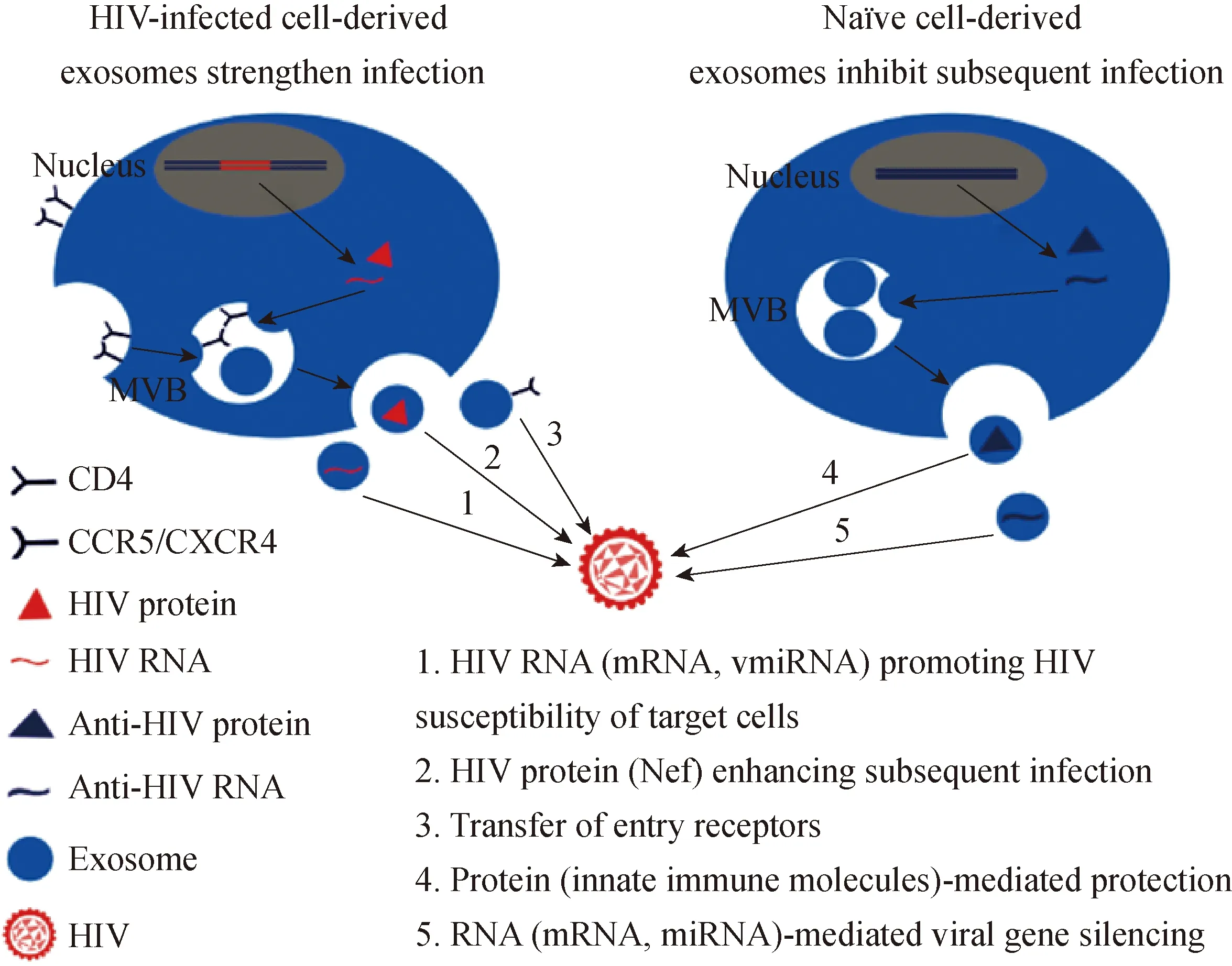
图1外泌体分子与HIV感染的关系
Fig.1TherelationshipbetweenexosomalmoleculesandHIVinfection
研究表明,通过外泌体的传递,Nef可激活静息CD4+T 细胞,增加其对HIV-1的易感性,促进病毒的后续入侵。这也在一定程度上解释了HIV-1 感染早期大量CD4+T细胞致死的原因,可能是感染初期HIV-1在体内大量传播的机制之一[22]。其次,Nef还能与靶细胞中Argonaute-2结合,阻断RNA诱导沉默复合物(RNA-induced silencing complex,RISC)中Argonaute-2核酸剪切酶活性,抑制细胞中内生抗HIV-1 微小RNA(microRNA,miRNA)介导的病毒基因沉默,表明外泌体能借助转移Nef以促进HIV-1感染[23]。再者,被外泌体转运至靶细胞的Nef能与CD4、主要组织相容性复合体Ⅰ型 (major histocompatibility complex classⅠ,MHC-Ⅰ)胞内段尾区结合,经细胞内吞后转至溶酶体,致使CD4 和MHC-Ⅰ降解,从而使靶细胞部分或完全丧失抗病毒免疫功能[23]。而巨噬细胞中的Nef 经外泌体传递至B细胞,抑制IgG2 和IgA产生,阻断抗体,介导一系列抗HIV-1体液免疫活动[24]。
HIV-1核衣壳蛋白Gag在感染细胞中参与外泌体形成过程,该过程又能促进HIV-1颗粒的装配和出芽,促进HIV-1复制与传播。但具体机制十分复杂,尚有待研究[21]。
有趣的是,某些HIV-1宿主细胞来源的外泌体能将HIV-1 辅助受体C-C 趋化因子受体5(C-C chemokine receptor type 5,CCR5)[25]和CXCR4[26]传递至不表达HIV-1辅助受体的细胞,赋予了这些细胞对HIV-1的易感性,大大拓宽了HIV-1感染的靶细胞谱,使得其在非易感细胞中也能扩散,但该现象是否在体内发生还无从知晓。除CCR5 和CXCR4外,还发现宿主来源的外泌体蛋白有促HIV-1感染活性。Esser 等[27]在HIV-1 感染细胞所释放的外泌体中发现CD86、CD45、MHC-Ⅰ等免疫分子,可能通过竞争性结合免疫效应细胞来阻断共刺激免疫信号,帮助病毒躲避免疫系统。
3.2 外泌体传递HIV-1 核酸
HIV-1感染细胞中外泌体可携带某些病毒RNA,目前发现的有Nef mRNA[20]、反式激活反应元件(transactivation response element,TAR)RNA及其加工而成的vmiR-TAR[28]、vmiR88和vmiR99[29]、未剪切的HIV-1 mRNA[30]。
Nef mRNA经由外泌体进入靶细胞后,具有翻译活性,发挥与Nef相似的促进HIV-1感染的功能[20]。有研究认为,某些细胞中Nef只能依赖质膜靶向功能,通过细胞接触进入邻近细胞,但其对远处细胞发生作用,将受限于外泌体介导的Nef mRNA进行转运[31]。
TAR RNA 位于HIV 5′长末端重复序列(5′ long terminal repeat,5′-LTR),为52 个碱基组成的RNA茎环结构。HIV-1感染细胞的外泌体中存在TAR RNA及其加工而成的vmiR-TAR[28]。TAR RNA能降低受体细胞中周期蛋白依赖性激酶9(cyclin-dependent kinase 9,Cdk9)和 Bim(Bcl-2 interacting mediator of cell death)水平,下调细胞凋亡。作为含量最高的HIV-1 miRNA,vmiR-TAR通过沉默Bcl-2 互作蛋白mRNA,也能下调感染细胞凋亡,延长病毒潜伏期,以产生更多的病毒,从而有利于病毒感染。后来,在艾滋病患者血清外泌体中发现,HIV-1 5′-LTR 编码的vmiR88 和vmiR99 能激活巨噬细胞中Toll样受体8(Toll-like receptor 8,TLR8)介导的信号通路,促进前炎症细胞因子如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)大量释放[29]。HIV-1进入潜伏期后,由于免疫系统对miRNA识别能力差,病毒趁机利用外泌体释放miRNA,使邻近细胞更易感,待有信号触发病毒复制后,加速病毒感染[32]。
HIV-1 mRNA以未剪切的形式在外泌体中被发现,但外泌体容载空间小,缺少反转录酶,因此判断HIV-1 mRNA 并非通过感染载入外泌体,而是劫持外泌体形成过程载入外泌体。当HIV-1基因组不能顺利包装时,HIV-1 mRNA 整合入外泌体的数量明显增加,从侧面反映包装病毒组分至外泌体可能是HIV-1在宿主细胞内解决组装问题的一种策略[30]。这些未剪切的HIV mRNA经外泌体传递进入靶细胞后,仍有机会翻译出病毒蛋白或生成病毒miRNA,从而促进HIV-1感染。
3.3 外泌体传递HIV-1颗粒
外泌体木马假说(Trojan exosome hypothesis)认为,反转录病毒能劫持外泌体形成过程来完成病毒颗粒的组装,形成的病毒粒子可通过不依赖病毒包膜蛋白及包膜蛋白受体的方式感染靶细胞[33]。如ESCRT家族成员TSG101是外泌体表面标记分子,也是外泌体形成的必需分子,HIV-1需依靠招募TSG101来完成组装。更有甚者,巨噬细胞等来源的HIV-1表面携带外泌体标记分子如CD63、CD81,这些HIV-1颗粒通过与外泌体相似的核内体向内出芽方式来完成组装,很好地支持了外泌体木马假说[34-35]。然而,越来越多的研究认为,ESCRT家族成员在细胞活动中具有广泛功能,且HIV-1组装与核内体的出芽过程无关,即外泌体木马假说可能不成立。
另一种假说认为,外泌体能吸收并传递完整病毒粒子,也是一种独立于病毒受体和病毒包膜的感染模式。HIV-1感染的单核-巨噬细胞来源的外泌体中病毒粒子显示了比裸露的病毒颗粒更强的感染活性[36]。HIV-1感染的未成熟树突细胞(dendritic cell,DC)来源的外泌体能捕捉HIV-1颗粒,并将其呈递给T 细胞,实现HIV-1感染转移,且载入外泌体的病毒颗粒占外排病毒颗粒的主体[37]。然而,对于外泌体包裹完整的HIV-1 颗粒,意见不一,因为HIV-1的包装出芽被认为是在细胞质膜上完成的,与核内体膜向内出芽过程无关。
3.4 外泌体传递HIV-1感染相关免疫分子
外泌体在体内存在非细胞杀伤依赖的抗HIV-1免疫保护和预防功能。Konadu等[38]从艾滋病患者和非艾滋病患者血浆中分别分离出外泌体,检测21种细胞因子和趋化因子含量,发现大多数细胞因子和趋化因子在艾滋病患者血浆外泌体中的富集量明显高于非艾滋病患者。进一步的实验证明,艾滋病患者血浆中的外泌体有助于诱导初始和中央型记忆CD4+T和CD8+T细胞表达CD38,激活免疫细胞增殖以帮助机体抵抗HIV-1。Tumne等[39]发现,CD8+T细胞来源的外泌体在体外对CCR5和CXCR4表达细胞存在无细胞毒性的抗病毒复制效果,该外泌体无需靶细胞内化,可能通过特殊表面蛋白来触发靶细胞内干扰素介导的信号转导途径(STAT1)来抑制HIV-1 LTR 启动子启动病毒转录。该发现为探索CD8+T细胞在体内抗HIV-1复制的机制提供了新思路。Näslund等[40]发现,从健康人乳汁中分离的外泌体能通过特有表面分子与HIV-1竞争DC表面的DC-SIGN受体,阻断DC对HIV-1的呈递,防止HIV-1对T细胞的入侵,进一步证实外泌体具有抗HIV-1免疫调节功能。后来,Madison等[41]发现,健康男性精液中外泌体内部富含宿主抑制性因子Apobec3G和Apobec3G mRNA。作为限制反转录病毒复制的Apobec3胞嘧啶脱氨基酶家族成员,Apobec3G能对HIV-1前病毒DNA进行脱氨基催化使其产生致死性突变,或通过某种尚未完全研究清楚的非酶催化方式来限制HIV-1 RNA反转录。含Apobec3G及其mRNA的外泌体在小鼠体内经阴道上皮细胞内吞,能有效阻断HIV-1逆转以阻断病毒的跨阴道传播。Smith等[42]从阴道分泌液中分离的外泌体同样具有显著的抗HIV-1天然免疫保护功能,可抵抗HIV-1性传播。有趣的是,某些免疫细胞外泌体本身携带miRNA如miR-28、miR-29a、miR-29b、miR-125b、miR-149、miR-150、miR-198、miR-223、miR-324、miR-378和miR-382,它们大多可结合HIV-1转录子LTR,进入靶细胞后阻断HIV-1转录后翻译[18]。而在表达HIV-1 Nef的细胞中,Nef能促进胞吞和胞吐,刺激细胞产生大量外泌体,并干涉外泌体分子分拣机制,控制 miRNA载入外泌体的过程,这可能是宿主细胞与HIV-1在机体中的对抗机制[23,43-44]。
3.5 外泌体在HIV-1感染中的应用
外泌体在HIV-1感染过程中能传递病毒组分,后者可作为标记对HIV-1感染进程进行跟踪。事实上,HIV-1感染后的不同时期,患者血液、尿液、精液、唾液、母乳、阴道分泌液等体液中外泌体携带的HIV-1核酸及蛋白的种类和丰度会有所变化。在HIV-1刺激下,外泌体的数量、大小等也可能发生变化,根据这些变化可监测艾滋病的发展情况。但必须清楚鉴定各种体液来源的外泌体所携带的分子种类,并明确解释它们与HIV-1感染相关生理病理的关系。例如,Hubert等[45]发现,与接受抗反转录病毒治疗(antiretroviral therapy,ART)的患者相比,未接受ART的艾滋病患者血浆中外泌体丰度较高,与中性粒细胞、血小板和CD4+T细胞的数量成反比,与CD8+T细胞的数量成正比,还与其包裹的miR-155和miR-223的量呈强烈负相关。
既然外泌体本身具有传递抗HIV-1感染分子的能力,那么将其开发为抗HIV-1药物载体极具可能性。作为内生性纳米颗粒运载体,外泌体具有很好的生物兼容性。相对传统病毒载体、纳米聚合物等传递介质,外泌体更加低毒、高效。Alvarez-Erviti等[46]开创性地将一段脑部神经元靶向肽克隆到外泌体表面溶酶体相关膜蛋白2b(lysosomal-associated membrane protein 2b,LAMP-2b)基因,经体外转染DC获得携带目的融合膜蛋白的外泌体。该外泌体在小鼠体内能跨血脑屏障,转运药物至多种脑部神经细胞,且具有靶向性良好、免疫原性低、生理毒性小等优点。多种细胞来源的外泌体具有跨血脑屏障的运输能力,如果将CD4、CCR5、gp120等的配体肽或抗体克隆或化学偶联到这类外泌体的表面分子上,可跨血脑屏障,靶向抑制脑部病毒库如巨噬细胞、小神经胶质细胞、星形胶质细胞、少突胶质细胞中的HIV-1将成为可能。近年来,已有研究者用外泌体模拟病毒颗粒,使其获得与HIV-1相似的免疫原性,并建立抗HIV-1新型疫苗。Lattanzi等[47]将生物表达法获得的含Nef突变子的外泌体在体外作用于CD8+T细胞,能引起与携带该抗原的假病毒相似的免疫反应。Godinho等[48]通过融合基因方式将HIV-1 Gag蛋白克隆到外泌体膜分子LAMP-1,携带LAMP-1/Gag融合膜蛋白的外泌体在小鼠体内诱导多功能CD4+T细胞介导的抗HIV-1免疫反应,启动CD8+T细胞的杀伤作用并使其产生记忆功能,而表达相应抗原的裸露DNA疫苗只能触发短暂的体液免疫。
3.6 外泌体在HIV-1感染研究中的困扰
在理论层面上,外泌体与EV的概念难以区分。在外泌体相关HIV-1感染发生机制的研究中,研究者对外泌体和其他EV的描述十分暧昧,部分研究直接将两者笼统概述为EV,并利用外泌体与其他类型的EV混合物进行了一系列实验,对不同研究结果的比较因此变得异常困难;其次,外泌体的产生和分子分拣机制尚无定论,即以外泌体为基础的HIV-1感染机制研究缺乏理论根基。
在技术层面上,外泌体与HIV-1颗粒具有相近的大小和密度,感染者体液中两者甚至可能携带相同的表面标记,因此以沉降系数和免疫特性为基础的分离技术很难从HIV-1感染者体液中彻底分离外泌体与HIV-1颗粒而分别进行研究[49]。此外,要将外泌体作为抗HIV-1分子载体,还会面临如何使外泌体达到临床应用级数量和质量的问题,因为外泌体在实验室很难大规模获得;同时由于分离手段的局限,外泌体的纯度很难得到保证。
4 结语
外泌体在HIV-1感染过程中扮演两种角色。HIV-1感染细胞来源的外泌体可促进病毒复制和传播,而某些未感染或感染细胞来源的外泌体能保护机体免受HIV-1侵袭,这取决于其携带的分子种类。然而,如何做到以毒攻毒,必须对外泌体进行更加有效的分离、纯化,并鉴定外泌体介导的HIV-1病毒组分或相关免疫分子的转移,从而有助于监视病情进展,确定合理给药方法。目前,借助外泌体研究HIV-1感染相关的病理机制还处于早期阶段,存在诸多灰色地带;开发外泌体为抗HIV-1药物的靶向载体也处于概念阶段,其临床应用绝非一日之功。
[1] Harding C, Heuser J, Stahl P. Receptor-mediated endocytosis of transferrin and recycling of the transferrin receptor in rat reticulocytes [J]. J Cell Biol, 1983, 97(2): 329-339.
[2] Schwab A, Meyering SS, Lepene B, Iordanskiy S, van Hoek ML, Hakami RM, Kashanchi F. Extracellular vesicles from infected cells: potential for direct pathogenesis [J]. Front Microbiol, 2015, 6: 1132. doi: 10.3389/fmicb.2015.01132.
[3] Alenquer M, Amorim MJ. Exosome biogenesis, regulation, and function in viral infection [J]. Viruses, 2015, 7(9): 5066-5083.
[4] Théry C, Ostrowski M, Segura E. Membrane vesicles as conveyors of immune responses [J]. Nat Rev Immunol, 2009, 9(8): 581-593.
[5] Kim DK, Kang B, Kim OY, Choi DS, Lee J, Kim SR, Go G, Yoon YJ, Kim JH, Jang SC, Park KS, Choi EJ, Kim KP, Desiderio DM, Kim YK, Lotvall J, Hwang D, Gho YS. EVpedia: an integrated database of high-throughput data for systemic analyses of extracellular vesicles [J]. J Extracell Vesicles, 2013. doi: 10.3402/jev.v2i0.20384.
[6] Kalra H, Simpson RJ, Ji H, Aikawa E, Altevogt P, Askenase P, Bond VC, Borràs FE, Breakefield X, Budnik V, Buzas E, Camussi G, Clayton A, Cocucci E, Falcon-Perez JM, Gabrielsson S, Gho YS, Gupta D, Harsha HC, Hendrix A, Hill AF, Inal JM, Jenster G, Krämer-Albers EM, Lim SK, Llorente A, Lötvall J, Marcilla A, Mincheva-Nilsson L, Nazarenko I, Nieuwland R, Nolte-’t Hoen EN, Pandey A, Patel T, Piper MG, Pluchino S, Prasad TS, Rajendran L, Raposo G, Record M, Reid GE, Sánchez-Madrid F, Schiffelers RM, Siljander P, Stensballe A, Stoorvogel W, Taylor D, Thery C, Valadi H, van Balkom BW, Vázquez J, Vidal M, Wauben MH, Yáez-Mó M, Zoeller M, Mathivanan S. Vesiclepedia: a compendium for extracellular vesicles with continuous community annotation [J]. PLoS Biol, 2012, 10(12): e1001450.
[7] Keerthikumar S, Chisanga D, Ariyaratne D, Al Saffar H, Anand S, Zhao K, Samuel M, Pathan M, Jois M, Chilamkurti N, Gangoda L, Mathivanan S. ExoCarta: A web-based compendium of exosomal cargo [J]. J Mol Biol, 2016, 428(4): 688-692.
[8] Savina A, Fader CM, Damiani MT, Colombo MI. Rab11 promotes docking and fusion of multivesicular bodies in a calcium-dependent manner [J]. Traffic, 2005, 6(2): 131-143.
[9] Ostrowski M, Carmo NB, Krumeich S, Fanget I, Raposo G, Savina A, Moita CF, Schauer K, Hume AN, Freitas RP, Goud B, Benaroch P, Hacohen N, Fukuda M, Desnos C, Seabra MC, Darchen F, Amigorena S, Moita LF, Thery C. Rab27a and Rab27b control different steps of the exosome secretion pathway [J]. Nat Cell Biol, 2010, 12(1): 19-30; sup pp 1-13.
[10] Perez-Hernandez D, Gutiérrez-Vázquez C, Jorge I, López-Martín S, Ursa A, Sánchez-Madrid F, Vázquez J, Yáez-Mó M. The intracellular interactome of tetraspanin-enriched microdomains reveals their function as sorting machineries toward exosomes [J]. J Biol Chem, 2013, 288(17): 11649-11661.
[11] van Niel G, Charrin S, Simoes S, Romao M, Rochin L, Saftig P, Marks MS, Rubinstein E, Raposo G. The tetraspanin CD63 regulates ESCRT-independent and -dependent endosomal sorting during melanogenesis [J]. Dev Cell, 2011, 21(4): 708-721.
[12] Hoshino D, Kirkbride KC, Costello K, Clark ES, Sinha S, Grega-Larson N, Tyska MJ, Weaver AM. Exosome secretion is enhanced by invadopodia and drives invasive behavior [J]. Cell Rep, 2013, 5(5): 1159-1168.
[13] Colombo M, Moita C, van Niel G, Kowal J, Vigneron J, Benaroch P, Manel N, Moita LF, Théry C, Raposo G. Analysis of ESCRT functions in exosome biogenesis, composition and secretion highlights the heterogeneity of extracellular vesicles [J]. J Cell Sci, 2013, 126(Pt 24): 5553-5565.
[14] Morelli AE, Larregina AT, Shufesky WJ, Sullivan ML, Stolz DB, Papworth GD, Zahorchak AF, Logar AJ, Wang Z, Watkins SC, Falo LD Jr, Thomson AW. Endocytosis, intracellular sorting, and processing of exosomes by dendritic cells [J]. Blood, 2004, 104(10): 3257-3266.
[15] Feng D, Zhao WL, Ye YY, Bai XC, Liu RQ, Chang LF, Zhou Q, Sui SF. Cellular internalization of exosomes occurs through phagocytosis [J]. Traffic, 2010, 11(5): 675-687.
[16] Svensson KJ, Christianson HC, Wittrup A, Bourseau-Guilmain E, Lindqvist E, Svensson LM, Mörgelin M, Belting M. Exosome uptake depends on ERK1/2-heat shock protein 27 signaling and lipid Raft-mediated endocytosis negatively regulated by caveolin-1 [J]. J Biol Chem, 2013, 288(24): 17713-17724.
[17] Lötvall J, Hill AF, Hochberg F, Buzás EI, Di Vizio D, Gardiner C, Gho YS, Kurochkin IV, Mathivanan S, Quesenberry P, Sahoo S, Tahara H, Wauben MH, Witwer KW, Théry C. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles [J]. J Extracell Vesicles, 2014, 3: 26913. doi: 10.3402/jev.v3.26913.
[18] Madison MN, Okeoma CM. Exosomes: implications in HIV-1 pathogenesis [J]. Viruses, 2015, 7(7): 4093-4118.
[19] Ellwanger JH, Veit TD, Chies JAB. Exosomes in HIV infection: A review and critical look [J]. Infect Genet Evol, 2017, 53: 146-154.
[20] Khan MB, Lang MJ, Huang MB, Raymond A, Bond VC, Shiramizu B, Powell MD. Nef exosomes isolated from the plasma of individuals with HIV-associated dementia (HAD) can induce Aβ(1-42) secretion in SH-SY5Y neural cells [J]. J Neurovirol, 2016, 22(2): 179-190.
[21] Fang Y, Wu N, Gan X, Yan W, Morrell JC, Gould SJ. Higher-order oligomerization targets plasma membrane proteins and HIV gag to exosomes [J]. PLoS Biol, 2007, 5(6): e158.
[22] de Carvalho JV, de Castro RO, da Silva EZ, Silveira PP, da Silva-Januário ME, Arruda E, Jamur MC, Oliver C, Aguiar RS, daSilva LL. Nef neutralizes the ability of exosomes from CD4+T cells to act as decoys during HIV-1 infection [J]. PLoS One, 2014, 9(11): e113691.
[23] Aqil M, Naqvi AR, Bano AS, Jameel S. The HIV-1 Nef protein binds argonaute-2 and functions as a viral suppressor of RNA interference [J]. PLoS One, 2013, 8(9): e74472.
[24] Gray LR, Gabuzda D, Cowley D, Ellett A, Chiavaroli L, Wesselingh SL, Churchill MJ, Gorry PR. CD4 and MHC class 1 down-modulation activities of nef alleles from brain-and lymphoid tissue-derived primary HIV-1 isolates [J]. J Neurovirol, 2011, 17(1): 82-91.
[25] Mack M, Kleinschmidt A, Brühl H, Klier C, Nelson PJ, Cihak J, Plachy J, Stangassinger M, Erfle V, Schlöndorff D. Transfer of the chemokine receptor CCR5 between cells by membrane-derived microparticles: a mechanism for cellular human immunodeficiency virus 1 infection [J]. Nat Med, 2000, 6(7): 769-775.
[26] Rozmyslowicz T, Majka M, Kijowski J, Murphy SL, Conover DO, Poncz M, Ratajczak J, Gaulton GN, Ratajczak MZ. Platelet-and megakaryocyte-derived microparticles transfer CXCR4 receptor to CXCR4-null cells and make them susceptible to infection by X4-HIV [J]. AIDS, 2003, 17(1): 33-42.
[27] Esser MT, Graham DR, Coren LV, Trubey CM, Bess JW Jr, Arthur LO, Ott DE, Lifson JD. Differential incorporation of CD45, CD80 (B7-1), CD86 (B7-2), and major histocompatibility complex class I and II molecules into human immunodeficiency virus type 1 virions and microvesicles: implications for viral pathogenesis and immune regulation [J]. J Virol, 2001, 75(13): 6173-6182.
[28] Narayanan A, Iordanskiy S, Das R, Van Duyne R, Santos S, Jaworski E, Guendel I, Sampey G, Dalby E, Iglesias-Ussel M, Popratiloff A, Hakami R, Kehn-Hall K, Young M, Subra C, Gilbert C, Bailey C, Romerio F, Kashanchi F. Exosomes derived from HIV-1-infected cells contain trans-activation response element RNA [J]. J Biol Chem, 2013, 288(27): 20014-20033.
[29] Bernard MA, Zhao H, Yue SC, Anandaiah A, Koziel H, Tachado SD. Novel HIV-1 miRNAs stimulate TNFα release in human macrophages via TLR8 signaling pathway [J]. PLoS One, 2014, 9(9): e106006.
[30] Columba Cabezas S, Federico M. Sequences within RNA coding for HIV-1 Gag p17 are efficiently targeted to exosomes [J]. Cell Microbiol, 2013, 15(3): 412-429.
[31] Luo X, Fan Y, Park IW, He JJ. Exosomes are unlikely involved in intercellular Nef transfer [J]. PLoS One, 2015, 10(4): e0124436.
[32] Laganà A, Russo F, Veneziano D, Bella SD, Giugno R, Pulvirenti A, Croce CM, Ferro A. Extracellular circulating viral microRNAs: current knowledge and perspectives [J]. Front Genet, 2013, 4: 120. doi: 10.3389/fgene.2013.00120.
[33] Gould SJ, Booth AM, Hildreth JE. The Trojan exosome hypothesis [J]. Proc Natl Acad Sci USA, 2003, 100(19): 10592-10597.
[34] Nguyen DG, Booth A, Gould SJ, Hildreth JE. Evidence that HIV budding in primary macrophages occurs through the exosome release pathway [J]. J Biol Chem, 2003, 278(52): 52347-52354.
[35] Kramer B, Pelchen-Matthews A, Deneka M, Garcia E, Piguet V, Marsh M. HIV interaction with endosomes in macrophages and dendritic cells [J]. Blood Cells Mol Dis, 2005, 35(2): 136-142.
[36] Kadiu I, Narayanasamy P, Dash PK, Zhang W, Gendelman HE. Biochemical and biologic characterization of exosomes and microvesicles as facilitators of HIV-1 infection in macrophages [J]. J Immunol, 2012, 189(2): 744-754.
[37] Wiley RD, Gummuluru S. Immature dendritic cell-derived exosomes can mediate HIV-1 trans infection [J]. Proc Natl Acad Sci USA, 2006, 103(3): 738-743.
[38] Konadu KA, Chu J, Huang MB, Amancha PK, Armstrong W, Powell MD, Villinger F, Bond VC. Association of cytokines with exosomes in the plasma of HIV-1-seropositive individuals [J]. J Infect Dis, 2015, 211(11): 1712-1716.
[39] Tumne A, Prasad VS, Chen Y, Stolz DB, Saha K, Ratner DM, Ding M, Watkins SC, Gupta P. Noncytotoxic suppression of human immunodeficiency virus type 1 transcription by exosomes secreted from CD8+T cells [J]. J Virol, 2009, 83(9): 4354-4364.
[40] Näslund TI, Paquin-Proulx D, Paredes PT, Vallhov H, Sandberg JK, Gabrielsson S. Exosomes from breast milk inhibit HIV-1 infection of dendritic cells and subsequent viral transfer to CD4+T cells [J]. AIDS, 2014, 28(2): 171-180.
[41] Madison MN, Jones PH, Okeoma CM. Exosomes in human semen restrict HIV-1 transmission by vaginal cells and block intravaginal replication of LP-BM5 murine AIDS virus complex [J]. Virology, 2015, 482: 189-201.
[42] Smith JA, Daniel R. Human vaginal fluid contains exosomes that have an inhibitory effect on an early step of the HIV-1 life cycle [J]. AIDS, 2016, 30(17): 2611-2616.
[43] Ali SA, Huang MB, Campbell PE, Roth WW, Campbell T, Khan M, Newman G, Villinger F, Powell MD, Bond VC. Genetic characterization of HIV type 1 Nef-induced vesicle secretion [J]. AIDS Res Hum Retroviruses, 2010, 26(2): 173-192.
[44] Muratori C, Cavallin LE, Kratzel K, Tinari A, De Milito A, Fais S, D’Aloja P, Federico M, Vullo V, Fomina A, Mesri EA, Superti F, Baur AS. Massive secretion by T cells is caused by HIV Nef in infected cells and by Nef transfer to bystander cells [J]. Cell Host Microbe, 2009, 6(3): 218-230.
[45] Hubert A, Subra C, Jenabian MA, Tremblay Labrecque PF, Tremblay C, Laffont B, Provost P, Routy JP, Gilbert C. Elevated abundance, size, and microRNA content of plasma extracellular vesicles in viremic HIV-1+patients: correlations with known markers of disease progression [J]. J Acquir Immune Defic Syndr, 2015, 70(3): 219-227.
[46] Alvarez-Erviti L, Seow Y, Yin H, Betts C, Lakhal S, Wood MJ. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes [J]. Nat Biotechnol, 2011, 29(4): 341-345.
[47] Lattanzi L, Federico M. A strategy of antigen incorporation into exosomes: comparing cross-presentation levels of antigens delivered by engineered exosomes and by lentiviral virus-like particles [J]. Vaccine, 2012, 30(50): 7229-7237.
[48] Godinho RM, Matassoli FL, Lucas CG, Rigato PO, Gonçalves JL, Sato MN, Maciel M Jr, Peçanha LM, August JT, Marques ET Jr, de Arruda LB. Regulation of HIV-Gag expression and targeting to the endolysosomal/secretory pathway by the luminal domain of lysosomal-associated membrane protein (LAMP-1) enhance Gag-specific immune response [J]. PLoS One, 2014, 9(6): e99887.
[49] Konadu KA, Huang MB, Roth W, Armstrong W, Powell M, Villinger F, Bond V. Isolation of exosomes from the plasma of HIV-1 positive individuals [J]. J Vis Exp, 2016. doi: 10.3791/53495.
