中段直肠癌术前磁共振成像对术后复发及转移的预测价值研究
2018-06-12张修石
徐 晔,周 洋,唐 娜,张修石
哈尔滨医科大学附属肿瘤医院影像科,黑龙江 哈尔滨 150000
直肠癌是消化系统常见的恶性肿瘤,发病率仅次于食管癌及胃癌,并呈逐年上升趋势[1],严重影响患者生命健康及生活质量。目前对于直肠癌的治疗主要为手术治疗,但直肠癌患者术后复发及远处转移常给患者带来极大的痛苦,并且预后较差。直肠癌的术前诊断及评估仍需借辅助检查完成,磁共振成像(magnetic resonance imaging,MRI)有较高的组织分辨率,可以清晰地显示肿块位置、大小、侵犯深度、距离环周切缘距离、与腹膜返折的关系、周围血管侵犯及周围淋巴结情况等,可以提供较准确的直肠癌术前分期。该研究旨在探讨直肠癌术前MRI对直肠癌预后的预测价值,以便于临床术前筛选局部复发、远处转移的高危人群,并制定个性化的治疗方案,从而改善患者预后,此外,由于中段直肠癌跨越腹膜返折,肿瘤与腹膜返折的关系是否影响患者预后也是本研究的一部分。
1 资料和方法
1.1 临床资料
本研究经哈尔滨医科大学附属肿瘤医院伦理委员会审核通过。回顾性分析哈尔滨医科大学附属肿瘤医院结直肠外科2013年3月—2014年12月经手术病理证实为直肠癌的278例患者的完整影像资料及随访资料,其中男性165例,女性113例,年龄31~80岁,平均年龄(59.58±10.28)岁。
入组标准:① 术后病理证实为直肠癌;②术前MRI诊断为中段直肠癌;③ 随访满2年及以上(包括随访期间因肿瘤死亡的患者);④ 术前未接受新辅助放化疗。
排除标准:① 合并其他恶性肿瘤者;② 术前或术中发现远处转移者;③ 非根治性治疗者;④ 术后6个月内发现远处转移者。
1.2 MRI扫描技术
扫描前1晚嘱患者服用清肠药,禁食,第2天早晨行直肠MRI检查。应用Philips Achieva 3.0T MR扫描仪,16通道体部相控阵线圈。头先进,嘱患者平卧,尽量采用胸式呼吸,以耻骨联合为中心,将线圈固定于患者盆壁前方。扫描序列:① 矢状位T2WI-TSE-HR,重复时间(repetition time,TR)/回波时间(echo time,TE)=3 000 ms/100 ms,信号平均次数(number of signal averaged,NSA)2次,层厚4.0 mm,层间距0.4 mm;② 通过矢状位确定直肠病变位置,垂直于病变肠管,进行病变处横轴位T2WI-TSE-HR扫描,TR 3 824 ms,TE 110 ms,NSA 3次,层厚3.5 mm,层间距0.2 mm;③ 病变处横轴位 T1WI-TSE扫描,TR 573 ms,TE 8 ms,NSA 2次,层厚4.0 mm,层间距0.5 mm;④ 根据矢状位病变定位,平行病变肠管行病变处冠状位T2WITSE-HR扫描,TR 3 824 ms,TE 110 ms,NSA 3 次,层厚3.0 mm,层间距0.2 mm。
1.3 MRI图像分析
由两位高年资影像医师共同分析所有术前MRI图像,两者意见不一致时,协商解决。两位医师阅片前均不知晓患者的手术病理结果。直肠癌MRI评估包括肿瘤MRI评价T(mrT)分期、MRI评价N(mrN)分期、壁外血管侵犯(extramural vascular invasion,EMVI)评估及腹膜返折侵犯评估。直肠癌T、N分期依据第7版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)/国际抗癌联盟(International Union Against Cancer,UICC)TNM分期系统:① T1期肿瘤仅局限于黏膜层及黏膜下层;② T2期肿瘤累及固有肌层;③ T3期肿瘤穿透固有肌层;④ T4期肿瘤达到腹膜或累及其他器官。因T1和T2在MRI图像上鉴别困难,本研究将两者统一记为T1-2期。N分期标准:Nx为区域淋巴结无法评估,N0为无可疑淋巴结,N1为1~3个可疑淋巴结,N2为4个以上可疑淋巴结。可疑淋巴结标准:短轴长度>9 mm全为可疑,5~9 mm需2个恶性特征(图1A),<5 mm需3个恶性特征(恶性特征包括边缘不清、混杂信号及圆形)。
T3及T4期肿瘤评估EMVI,EMVI影像学评估按照Smith等[2]提出的评分系统进行,具体如下:0分为肿瘤呈非结节状浸润到肌层,肿瘤周围无血管侵犯;1分为肿瘤呈结节状浸润到肌层或存在极小的肠管壁外血管,但是不在肿瘤周边;2分为肿瘤周边存在肠壁外血管,但血管大小正常且血管内没有明确的肿瘤信号;3分为肿瘤周边血管内出现中等强度的信号,但是血管的轮廓及直径只是略有改变;4分为肿瘤周边血管内出现肿瘤信号,血管轮廓明显的不规则或血管呈结节性扩张。0~2分记作EMVI阴性;3~4分记作EMVI阳性(图1B)。
病变跨越腹膜返折者评价腹膜返折是否受侵,腹膜返折受侵特征:腹膜返折增厚,并有明确的信号改变(图2)。
1.4 手术及病理学检查
所有患者行全直肠系膜筋膜切除术(total mesorectal excision,TME),术后行组织病理学检查。将病理T、N分期结果与MRI分期结果加以对比。
1.5 随访
患者术后每3个月复查1次肠镜及血清癌胚抗原(carcinoembryonic antigen,CEA),术后第6个月行胸、腹及盆腔CT检查,之后每年复查1次。记录出现局部复发或异时远处转移的时间、转移部位,死亡患者记录死亡时间、死亡原因。异时远处转移定义为首次发现远处转移的时间超过术后6个月。
1.6 统计学处理
采用R-3.3.3统计学软件进行数据分析,P<0.05为差异有统计学意义。使用受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)评价mrT、mrN的总体诊断效能。采用Fisher精确检验分析MRI各指标与直肠癌局部复发及异时远处转移的相关性。对mrT分期、mrN分期、EMVI及腹膜返折受侵4个征象和术后局部复发、异时远处转移进行逐步回归,分析术后局部复发和异时远处转移的风险因素,以病理结果作为金标准。
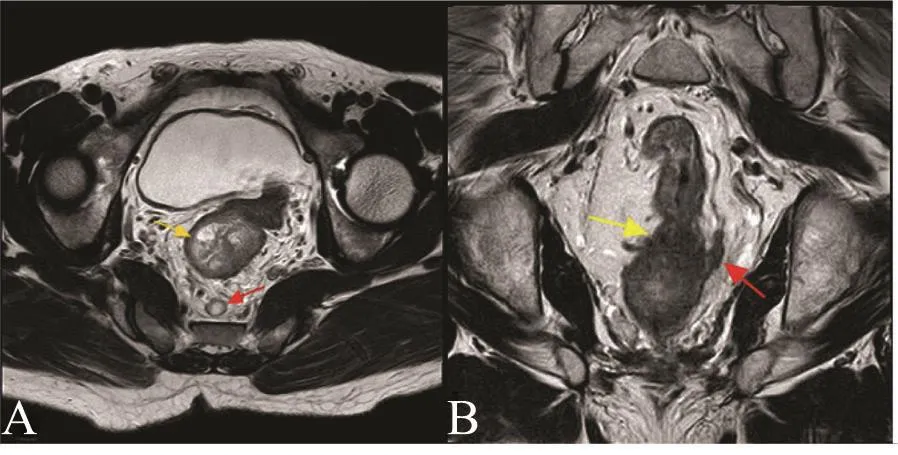
图1 可疑淋巴结及EMVI阳性征象Fig.1 Suspicious lymph node and EMVI-positive signs
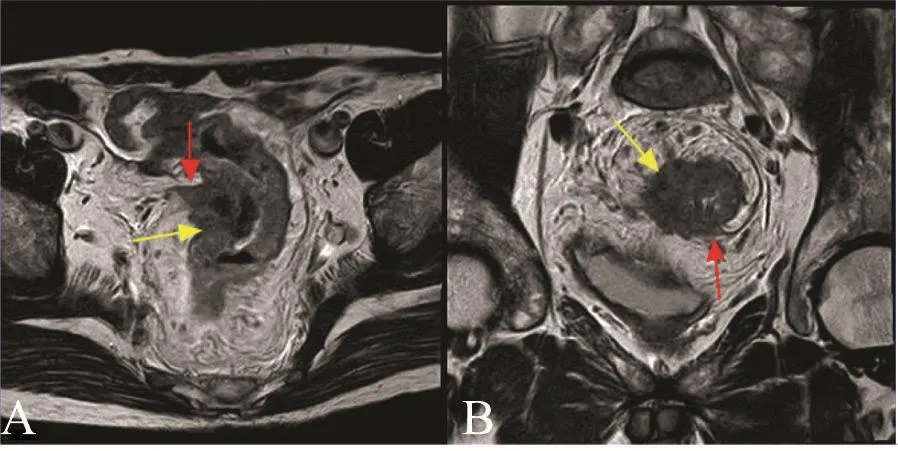
图2 腹膜返折受侵征象Fig.2 Peritoneal re flection invasion signs
2 结 果
2.1 MRI诊断直肠癌T、N分期准确性评价
将术后病理分期与mrT分期、mrN分期进行对照(表1),结果显示,mrT总体诊断效能AUC=0.889 1(图3A);mrN总体诊断效能AUC=0.908 3(图3B)。
2.2 随访结果
本研究随访时间截至2017年9月1日,278例患者中18例患者死亡,其中因肿瘤死亡者16例,其余2例因心血管疾病死亡。术后局部复发者19例,均经肠镜下活检病理证实;异时远处转移者42例(表2),其中经手术或穿刺病理证实转移者23例,余无法手术或穿刺者经影像学检查有典型表现时考虑为转移。

表1 MRI分期与病理分期结果Tab.1 MRI staging and pathological staging results
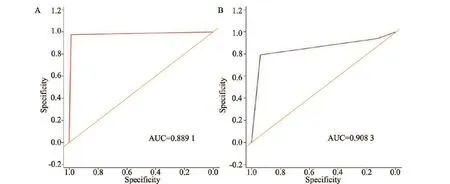
图3 MRI诊断直肠癌T、N分期准确性评价结果Fig.3 Accuracy of MRI in diagnosis of rectal cancer by T and N staging
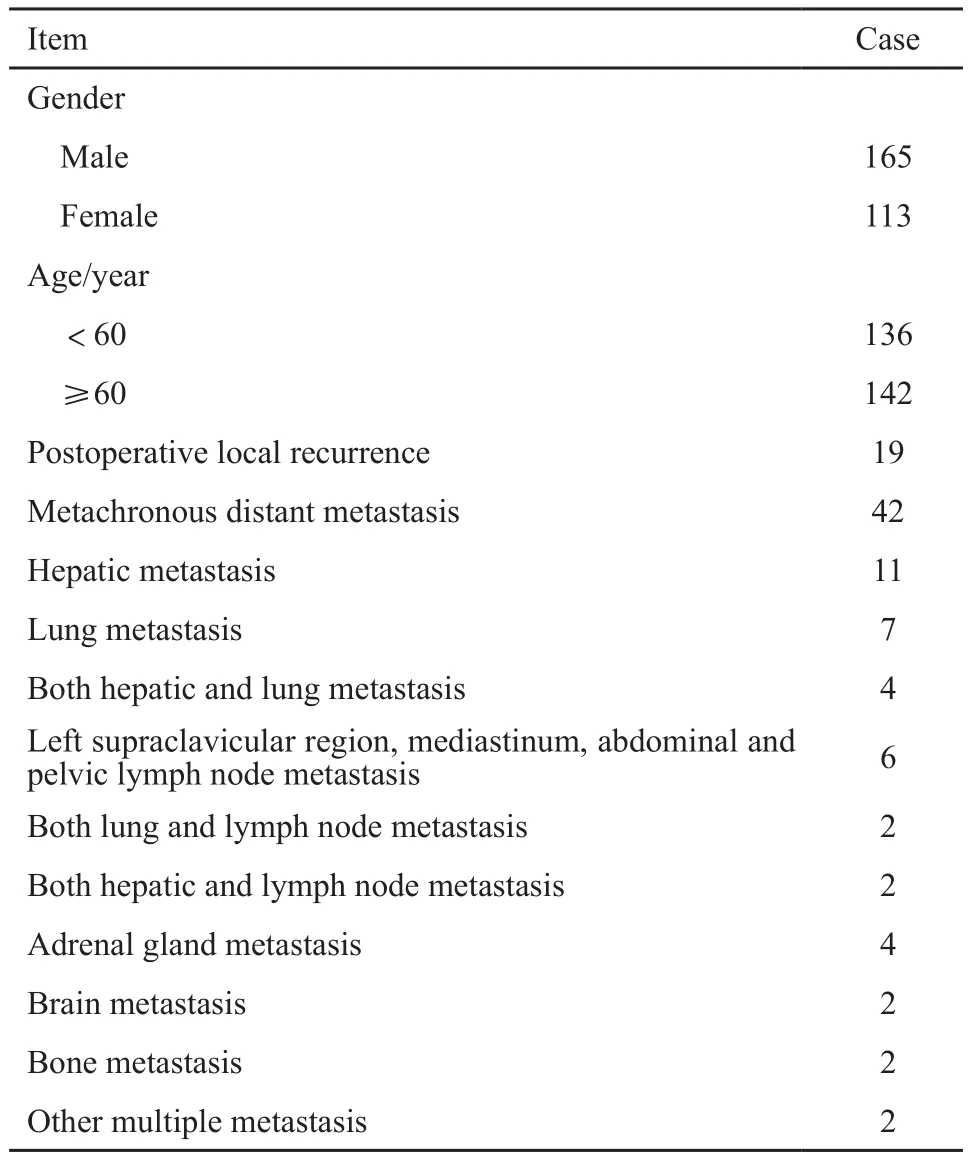
表2 研究对象临床资料Tab.2 Clinical data of all subjects
2.3 术后局部复发与异时远处转移的危险因素分析
经过统计学分析发现,m r T分期(P <0.001)、腹膜返折受侵(P<0.001)与直肠癌术后局部复发具有相关性(表3);腹膜返折受侵是直肠癌术后局部复发的重要风险因素(P <0.001,表4)。
mrT分期(P=0.013)、mrN分期(P<0.001)、EMVI阳性(P<0.001)及腹膜返折受侵(P<0.001)与直肠癌异时远处转移具有相关性(表5)。mrN1期(P=0.017)、mrN2期(P<0.001)是直肠癌异时远处转移的重要风险因素,EMVI阳性亦考虑为直肠癌异时远处转移的风险因素,但相关性较小(P=0.134,表6)。

表4 MRI征象与术后复发逐步回归分析Tab.4 Multiple regression analysis of MRI features and postoperative local recurrence
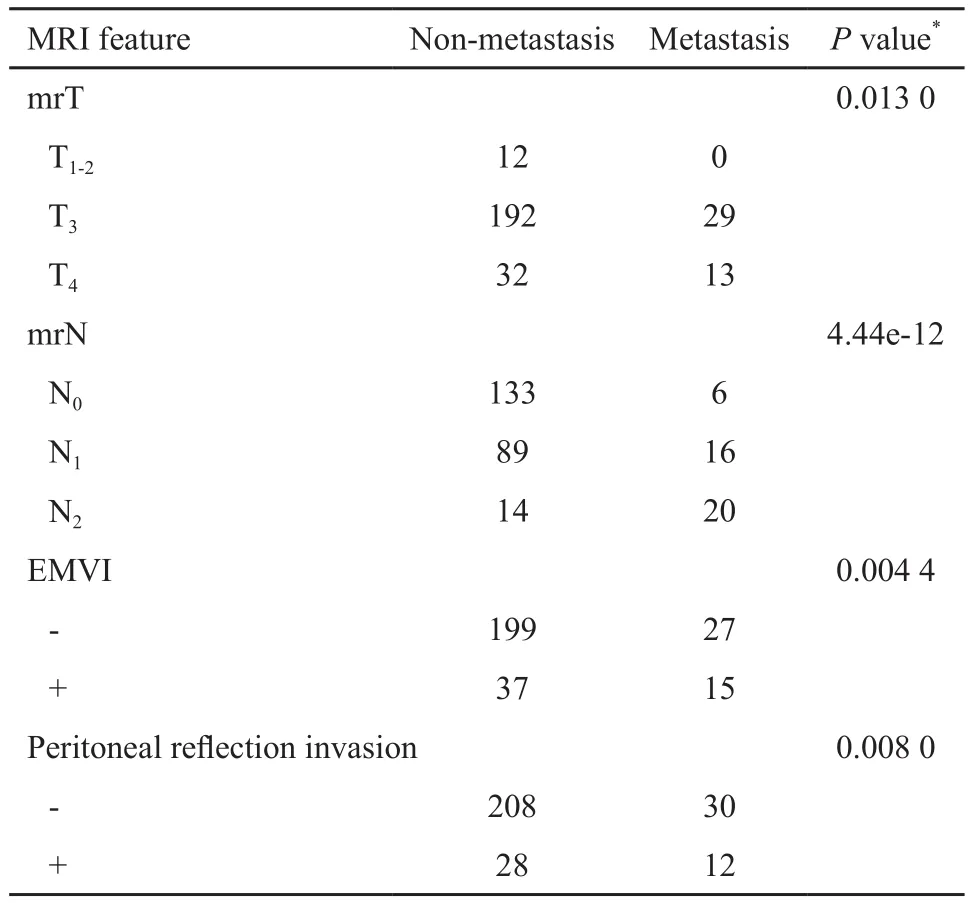
表5 MRI征象与异时远处转移的相关性Tab.5 Correlation between MRI features and metachronous distant metastasis

表6 MRI征象与异时远处转移逐步回归分析Tab.6 Multiple regression analysis of MRI features and metachronous distant metastasis
3 讨 论
目前,全球直肠癌的发病率呈逐年上升的趋势,在我国结直肠癌发病率为3.1/10万~10.7/10万,直肠癌所占比例约为70%,其中,中低位直肠癌占70%~80%[3]。随着直肠癌全直肠系膜筋膜切除术的广泛应用,总体直肠癌局部复发率已有所下降,近年来报道,局部复发率为5%~15%[4-5],5年总生存率仅为14.9%[6],中段直肠癌由于其特殊位置关系,前壁肿瘤易累及腹膜返折,根治性切除术后局部复发率高于平均值,预后较差。直肠癌远处转移率为20%~50%[7],肝转移最多见,预后差。因此,如果能在术前筛选出直肠癌术后局部复发及远处转移的高危人群,就可在术前对高危人群进行针对性的系统治疗,加大治疗程度,改善患者预后。同时,对于高危人群的术后复查时间间隔应适当缩短,争取及早发现病灶,从而积极采取治疗手段。本研究通过分析中段直肠癌MRI与术后局部复发、异时远处转移的相关性,发现直肠癌术前MRI能较好地预测术后局部复发和异时远处转移,可以作为筛选高危人群的临床指标。
既往研究通过Kappa检验分析mrT分期、mrN分期的诊断准确性,提出MRI对直肠癌术前T分期的诊断准确率可达到88.8%~89.5%[8,9],N分期准确率约为75.6%[8]。本研究采用ROC曲线的AUC进行评估,结果可信度更高,表明MRI能较准确地评估直肠癌术前T分期和N分期。
本研究结果显示,mrT分期与直肠癌术后局部复发具有相关性,并且本研究的所有术后局部复发患者均为T3-4期,说明肿瘤的侵犯程度与术后局部复发相关,这与既往报道结果一致[10-11]。目前,国内外对腹膜返折受侵与直肠癌预后相关性研究较少,在本研究中,不仅单因素分析发现,腹膜返折受侵与直肠癌术后局部复发相关,同时多因素分析发现,腹膜返折受侵是直肠癌术后局部复发的重要风险因素,这一结果值得引起重视,分析其原因可能是原发肿瘤如侵及腹膜返折,即说明肿瘤浸透浆膜,并且腹膜已有肿瘤细胞浸润,易导致肿瘤细胞种植或脱落至腹盆腔,为手术根治造成困难,同时还容易侵犯邻近血管、淋巴管,从而导致肿瘤复发率升高,患者的生存率降低[12]。
周超熙等[13]研究直肠癌的临床病理特点与预后相关性发现,T、N分期是直肠癌预后的独立影响因素,这与本研究结果相似,在本研究中,mrT分期、mrN分期、EMVI阳性及腹膜返折受侵均与直肠癌术后异时远处转移具有相关性。已有研究证实,组织学肠壁周围血管侵犯是直肠癌远处转移的独立预测指标[14]。Bugg等[15]研究直肠癌的预后指标发现,MRI提示的EMVI阳性直肠癌患者在术后1年内发生转移的概率显著增加;Hunter等[16]的研究也显示,MRI预测存在EMVI增加直肠癌转移的风险。但本研究与上述结果不完全相同,本研究表明,MRI预测EMVI阳性可作为直肠癌异时远处转移的风险因素,但相关性较小(P=0.134),分析原因可能是T4期患者样本量小、随访时间短,也可能是部分受侵血管细小、MRI识别较困难。
此外,本研究发现,淋巴结转移是直肠癌异时远处转移的重要风险因素,这与既往研究相似[13],mrN1期和mrN2期患者发生异时远处转移的OR值分别为3.40和27.61,说明N分期越高,发生异时远处转移风险越大,因此对于MRI诊断为N1-2期的直肠癌患者应予以重视,积极制定个性化治疗方案,缩短术后复查时间间隔,及时发现并治疗转移病灶,提高患者生存率,改善预后。
本研究尚存在一些不足:① 随访时间较短,部分患者不足5年,可能会影响研究结果;② 部分远处转移病灶由于多种原因无法获得病理,仅由影像学检查和临床分析判定,可能会造成误判。
综上所述,腹膜返折受侵是直肠癌术后局部复发的重要风险因素;淋巴结转移是直肠癌异时远处转移的重要风险因素,MRI判断EMVI阳性也可考虑为异时远处转移的风险因素,这些研究结果有助于临床在术前根据MRI挑选术后复发和异时远处转移的高危患者,采取相应治疗和复查手段,以改善患者预后,实现个性化治疗。
[1] CHO E Y, KIM S H, YOON J H, et al. Apparent diffusion coefficient for discriminating metastatic from non-metastatic lymph nodes in primary rectal cancer [J]. Eur J Radiol,2013, 82(11): e662-668.
[2] SMITH N J, BARBACHANO Y, NORMAN A R, et al.Prognostic significance of magnetic resonance imaging-detected extramural vascular invasion in rectal cancer [J]. Br J Surg,2008, 95(2): 229-236.
[3] 金哲柱, 金永军, 何 琳, 等. 直肠癌根治术后预测复发高危因素分析研究 [J]. 浙江中西医结合杂志, 2017, 27(2):137-140.
[4] AKIYOSHI T, WATANABE T, UENO M. Is lateral pelvic lymph node dissection no longer necessary for low rectal cancer after neoadjuvant therapy and TME to reduce local recurrence?[J]. J Gastrointest Surg, 2012, 16(12): 2341-2342.
[5] 赵 虹. 全直肠系膜切除术后局部复发的危险因素分析[J]. 中国医药指南, 2014, 12(33): 241-242.
[6] HANSEN M H, BALTESKARD L, DRUM L M, et al. Locally recurrent rectal cancer in Norway [J]. Br J Surg, 2009,96(10):1176-1182.
[7] RASANEN M, CARPELAN-HOLMSTROM M, MUSTONEN H, et al. Patern of rectal cancer recurrence after curative surgery[J]. Int J Colorectal Dis, 2015, 30(6): 775-785.
[8] 杨解宇, 王 杰, 吕兴隆, 等. 高分辨MRI双重造影结合DWI对直肠癌术前分期的研究 [J]. CT理论与应用研究, 2017,26(2): 195-202.
[9] 唐 娜, 尚乃舰, 张红霞. 3.0T高分辨率MRI在直肠癌术前T分期中的价值 [J]. 中国临床医学影像杂志, 2016, 27(8):562-564, 569.
[10] KOCA D, BINICIER C, OZTOP I, et al. Prognostic factors affecting recurrence and survival in patients with locally advanced rectal cancer [J]. J BUON, 2012, 17(2): 291-298.
[11] 袁友红, 邢祖民, 林春水. 影响结直肠癌手术预后因素的回顾性分析 [J]. 实用医学杂志, 2012, 28(17): 2912-2915.
[12] 钟清华, 马腾辉, 王怀明,等. 手术治疗结直肠癌腹膜转移75例预后分析 [J]. 中国实用外科杂志, 2016, 36(11): 1215-1219.
[13] 周超熙, 于 滨, 苏 明, 等. 结直肠癌预后的不同影响因素临床病理特点研究 [J]. 河北医药, 2016, 38(03): 378-381.
[14] CHAND M, SWIFT R I, TEKKIS P P, et al. Extramural venous invasion (EMVI) is a potential imaging predictive biomarker of neoadjuvant treatment in rectal cancer [J]. Br J Cancer,2014, 110(1): 19-25.
[15] BUGG W G, ANDREOU A K, BISWAS D, et al. The prognostic significance of MRI-detected extramural venous invasion in rectal carcinoma [J]. Clin Radiol, 2014, 69(6): 619-623.
[16] HUNTER C J, GARANT A, VUONG T, et al. Adverse features on rectal MRI identify a high-risk group that may benefit from more intensive preoperative staging and treatment [J]. Ann Surg Oncol, 2012, 19(4): 1199-1205.
