牛奶中β-内酰胺高灵敏度检测试剂条研制(胶体金法)
2018-06-11宋文何鲁江
宋文 何鲁江
目前,快速检测试剂条一般采用抗原抗体反应的原理来检测目标检测物。但是由于牛奶样本中蛋白质含量较高,容易干扰检测结果,且对于灵敏度要求高,普通的抗体无法达到现场检测灵敏度的要求。胶体金法采用受体结合的原理来检测目标物,由于受体结合的亲和力是抗原抗体结合亲和力的两个数量级以上,因此在牛奶中使用受体结合的原理来制备β-内酰胺高灵敏度检测试剂条成为一个有效的手段。
1 材料与方法
1.1 材料与试剂
阳性奶样、阴性奶样、酪蛋白、Tris、BSA、Borax等化学试剂(采购自Sigma)。镍柱(GE life)、PET-30a质粒(通用生物)、β-内酰胺BSA偶联物(购自杭州隆基生物)。
1.2 仪器与设备
高速冷冻离心机(湘仪)、摇床(湘仪)、蛋白分离柱(Bio-Rad)、分光光度计(新世纪)。
1.3 方法
1.3.1 重组β-内酰胺受体制备


1.3.1.1 单克隆阳性菌体制备
①将合成的质粒冻干粉使用100μL灭菌超纯水稀释。
②吸取稀释后的质粒溶液10μL,加入到100μL的感受態细胞中,冰浴30min。
③完成冰浴后,42℃金属浴热击90s后冰浴2min。
④将制备好的感受态细胞接种于1mL LB液体培养基(加入终浓度万分之一的卡纳抗生素),37℃ 、250rpm培养1h。
⑤培养后的菌体吸取200μL,涂LB固体培养基平板(卡纳抗性),37℃烘箱静止过夜。
⑥挑取菌落生长旺盛,边缘清晰的单菌落,接种于1mL LB液体培养基,37℃ 、250rpm培养过夜。
1.3.1.2 阳性单克隆蛋白表达鉴定
①吸取单克隆菌10μL,加入到10mL LB液体培养基中(2管),37℃、250rpm过夜培养。
②将10mL培养好的菌体加入到250mL LB培养基培养(37℃ 、250rpm),每1h测试菌体浓度,当菌体吸光度超过0.6之后,加入IPTG诱导蛋白表达(4h),其中一管为对照管不进行诱导。
③将两瓶菌液分别离心10分钟,转速为8000rpm,温度设为4℃。然后弃去上清,将沉淀使用PBS稀释搅拌30min。将稀释后的菌体放入到细胞粉碎仪中粉碎15min。在 12000rpm的转速下离心30min,温度控制为4℃,保留上清。
④离心后的沉淀物使用inding Buffer A(50mM Tris,8M Urea,0.5M NaCl,pH8.0)室温溶解10min后,12000rpm,4℃离心30min,取上清。
⑤将收集到的两份上清进行蛋白电泳。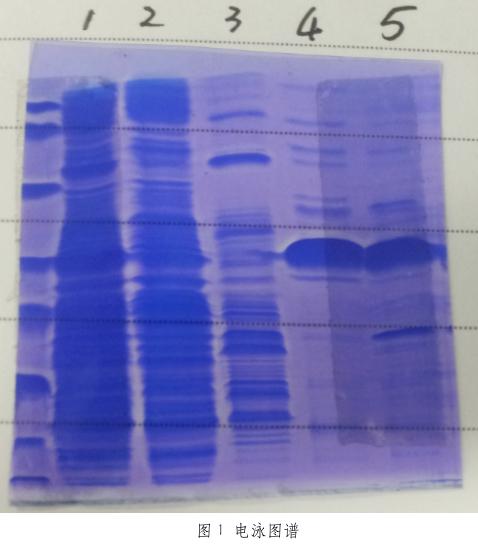
经蛋白电泳鉴定,β-内酰胺受体蛋白主要为包涵体表达,上清表达量较低。
1.3.2 试纸的制作
1.3.2.1 重组β-内酰胺受体标记胶体金
①500mL超纯水加热至沸腾,加入终浓度为1.5/10000的氯金酸后再加入2.25/10000的柠檬酸三钠。搅拌反应10min后,水浴冷却。
②100mL制备好的胶体金溶液使用0.2M碳酸钾溶液调节PH到9.0,加入重组的β-内酰胺受体蛋白,室温搅拌30min。
③加入1mL 10%的BSA水溶液,封闭30min。
④以12000rpm的转速离心30min,弃去上清,沉淀使用金标保存液稀释(Tris:0.25%、BSA:1%)回收冷藏保存。
⑤将标记好的金标溶液,使用金标稀释液稀释到OD540吸光度为OD5(溶液中加入终浓度为2%的蔗糖和1%的海藻糖),每个酶标孔加入稀释的金标溶液10μL,放置于45℃烘箱过夜干燥。
1.3.2.2 β-内酰胺BSA偶联物包被
①将β-内酰胺BSA偶联物使用PBS稀释到0.2mg /mL(终浓度1%蔗糖)。
②使用划膜仪将稀释好的β-内酰胺BSA偶联物包被到NC膜上,45℃烘箱过夜干燥
1.3.2.3 试纸条组装
将包被好的底板与吸水滤纸、滤膜按照正常程序组装黏贴。
1.3.3 试纸条检测
将青霉素使用阴性奶样稀释,建立梯度浓度标准品,浓度值分别为0.25ppb、0.5ppb、1ppb、2ppb、4ppb、8ppb、16ppb、32ppb。该试纸条采用免疫竞争法原理,阳性为一条线,阴性为两条线。分别吸取不同浓度值的标准质控品各100μL,使用移液器反复抽打10次后将组装好的试纸条插入到酶标孔中10秒钟,5min后观察并记录相应结果。
2 结果与讨论
检测结果(见表1)表明,该方法建立的牛奶中β-内酰胺快速检测试纸条的灵敏度为0.5ppb,当检测样本中的β-内酰胺浓度超过0.5ppb将被检出阳性。
