雷洛昔芬抗体的制备及ELISA方法的初步建立
2018-06-11童雅琪张羽伍金娥常超
童雅琪,张羽,伍金娥,2,常超,2
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023)(2.武汉轻工大学教育部大宗粮油精深加工省部共建重点实验室,湖北省农产品加工与转化重点实验室,湖北武汉 430023)
抗雌激素药物是一类人工合成的雌激素拮抗剂,广泛应用于激素依赖型疾病(如乳腺癌和卵巢癌等)的治疗,这类药物与激素类似,属于内分泌干扰物质[1~5]。内分泌干扰物质所引发的一系列问题已经引起了世界各国尤其是欧美和日本等发达国家的广泛关注。雷洛昔芬(raloxifene,结构式见图 1)是一种抗性激素药物,具有模仿激素的作用[6],其内分泌干扰作用也是值得关注的科学问题。已有数据表明,雷洛昔芬对生物体内分泌系统、神经系统及生殖系统造成一定的危害[7~9],甚至有致畸作用,易引起DNA损伤,造成基因毒性[10~12]。同时,可以通过对类固醇激素生物合成路径中相关的基因表达、酶活效应的干扰,改变生物体内相应性激素的含量,从而干扰生物体的正常发育和生长[13]。随着雷洛昔芬在预防和治疗骨质疏松症等疾病上的广泛应用,在环境水体中也检测到了相应的药物残留,不能完全消除[14,15],这也与其他化学物质的大量使用而造成的环境污染情况较相似,并且由于雷洛昔芬具有特殊的激素作用,雷洛昔芬有可能被用于水产养殖[16,17]。从环境水体间接污染和水产养殖直接使用两方面来看,雷洛昔芬将是威胁食品安全的一大类新的化学药物,研究抗性激素药物的安全控制技术显得十分必要。
目前国内外关于雷洛昔芬的检测主要是关于血浆[18~20]、药物制剂[21~23]中的检测,中国疾病控制中心报道了鱼组织中雷洛昔芬检测方法[24],已有的检测方法都是基于色谱法,色谱法具有准确度高等优点,但是检测成本高、设备昂贵、不适用于高通量的筛选检测。而酶联免疫吸附测定(enzyme-linked immuno sorbent assay,ELISA)方法具有快速、灵敏、高效等优点,越来越广泛地被用于大批量药物残留筛选,是食品安全检测常用的筛选方法,目前国内外未见抗性激素免疫化学方法的相关报道。本研究采用丁二酸酐对雷洛昔芬进行改造合成雷洛昔芬半抗原,采用碳二亚胺法合成人工抗原,免疫动物制备抗体,通过优化抗原抗体反应浓度初步建立雷洛昔芬ELISA方法,为建立污水和食品中雷洛昔芬免疫化学方法奠定基础。

图1 雷洛昔芬的分子结构式Fig.1 Structures of raloxifene
1 材料与方法
1.1 材料
1.1.1 试验动物
2月龄雄性健康新西兰大白兔,体重1.5±0.5 kg,购于湖北省疾病预防控制中心。
1.1.2 试剂
盐酸雷洛昔芬、他莫昔芬、丁二酸酐、托瑞米芬、氯米芬、二甲基甲酰胺(dimethylformamide,DMF),国药集团化学试剂有限公司上海分公司;N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)、二环已基碳二亚胺(N,N-dicyclohexylcarbdiimide,DCC)、弗氏完全佐剂、弗氏不完全佐剂、牛血清白蛋白(bovine serum albumin,BSA)、卵清蛋白(ovabulmin,OVA),美国 sigma公司;羊抗兔 IgG-辣根过氧化物酶偶合物(goat anti-rabbit IgG-horseradish peroxidase,GaR IgG-HRP),碧云天生物技术研究所。
1.1.3 仪器
Aglient8453紫外分光光度计,美国Aglient公司;Magenllan CE 2.5型酶标仪,瑞士Sunrise公司;Milli-Q超纯水器,美国Millipore公司;RE52CS型旋转蒸发器、SHZ-Ⅲ型循环水真空泵,上海亚荣;HH-2型数显恒温水浴锅,上海维城。
1.2 方法
1.2.1 雷洛昔芬半抗原改造
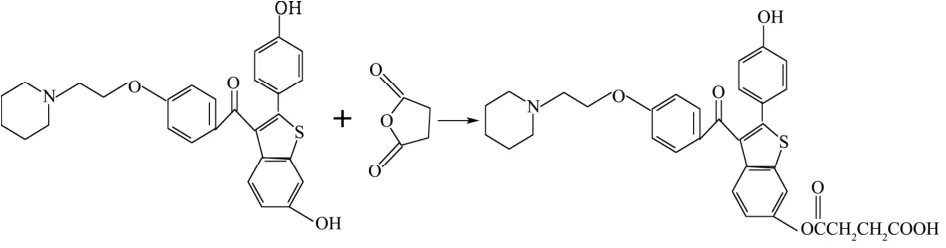
图2 雷洛昔芬的半抗原合成Fig.2 Synthesis of raloxifene hapten
雷洛昔芬半抗原改造见图 2,具体操作方法:精确称取盐酸雷洛昔芬1.02 g,置于圆底烧瓶中,加入10 mL DMF作为溶剂,再加入丁二酸酐0.2 g,加热回流5 h,冷却待用。
1.2.2 雷洛昔芬免疫原的合成及鉴定

图3 雷洛昔芬免疫原的合成Fig.3 Synthesis of raloxifene immunogen
雷洛昔芬免疫原的合成见图 3,具体操作方法:采用碳二亚胺法将改造后的雷洛昔芬的羧基与载体蛋白上的氨基进行偶联。取出制备好的半抗原反应物 1 mL,再加入 DMF1 mL,并在搅拌的过程中加入NHS23 mg,DCC41.2 mg,在4 ℃下搅拌反应过夜,以5000 r/min离心10 min,上清液为A液。称取BSA 340 mg,溶于10 mL 0.1 mol/L pH 8.0磷酸盐缓冲液(phosphate belanced solution,PBS),搅拌并溶解制备B液。在磁力搅拌下,将A液逐滴加入到B液,密封烧杯,4 ℃下搅拌反应4 h,以5000 r/min离心10 min,取上清液,4 ℃ PBS溶液(pH 7.4)透析3 d,每天更换PBS溶液1次,除去未反应的NHS、DMF、DCC以及雷洛昔芬半抗原的小分子物质。最后将无色免疫原溶液分装,于-20 ℃冰箱中保存,以供免疫使用。产物经紫外图谱扫描鉴定。同法合成包被抗原。
1.2.3 免疫程序
取健康新西兰大白兔6只,随机分为2组,设计两个剂量(0.5 mg/只、1 mg/只),免疫时间间隔均为30 d。将免疫原使用无菌生理盐水配制成2 mg/mL,与等量的弗氏完全佐剂充分乳化后,进行背部多点注射。基础免疫用弗氏完全佐剂,加强免疫用弗氏不完全佐剂。从第3次免疫开始,每次免疫后7~10 d 耳静脉采血,监测抗体质量。
1.2.4 抗体质量的监测
抗体效价测定:直接ELISA测定抗体效价,将包被抗原用包被缓冲液倍比稀释成8个浓度包被,置于4 ℃冰箱过夜。洗涤后用1%OVA封闭1 h,从首列开始加入倍比稀释的待测血清,37 ℃避光反应1 h。洗涤后加入 1:10000 的 GaR IgG-HRP 100 μL,37 ℃避光反应 1 h。洗涤后每孔加入新鲜配制的底物溶液 100 μL,置37 ℃显色10 min,每孔加入终止液50 μL,于450 nm测定各孔的吸光值,以光密度值(optical density,OD)1.0左右的抗血清稀释倍数为抗体效价。
抗体灵敏度测定:采用间接竞争ELISA测定,以抗体IC50值(抑制率为50%所对应的药物浓度)为指标判定抗体灵敏度。抗体特异性测定:采用间接竞争ELISA程序测定,选择结构与雷洛昔芬类似的抗雌激素药物做交叉反应,以抗体的交叉反应率为指标判定抗体的特异性,交叉反应率(%)=(雷洛昔芬 IC50值/其他竞争药物IC50值)×100
1.2.5 方法的建立
采用方阵滴定法初步确定抗原抗体工作浓度,间接竞争ELISA法优化抗原包被浓度、抗体工作浓度。在上述最佳条件下,将雷洛昔芬母液稀释成0、0.4、1.6、6.4、25.6和102.4 µg/L,按间接竞争ELISA方法进行测定,以雷洛昔芬溶液浓度的对数为横坐标,抑制率为纵坐标,绘制标准曲线,其中抑制率(%)=100*B/B0,B0和B分别为零标准孔和含药物孔所对应的OD值。
2 结果与分析
2.1 雷洛昔芬人工抗原鉴定

图4 雷洛昔芬人工抗原紫外图谱,Fig.4 Ultraviolet spectra of raloxifene artificial antigen
雷洛昔芬免疫抗原和包被原的紫外图谱见图 4,如图4a所示,载体蛋白BSA最大吸收波长为278 nm,雷洛昔芬最大吸收波长为296 nm,免疫原Ra-BSA最大吸收波长为290 nm,载体蛋白偶联半抗原后最大吸收波长发生明显改变,该现象可以提示半抗原与蛋白偶联成功[25]。紫外测定结果初步证明雷洛昔芬与BSA偶联成功,同理初步推断雷洛昔芬与 OVA偶联成功(图4b)。
2.2 抗体效价与灵敏度

表1 各免疫组抗体的效价与灵敏度Table 1 Antibody titers and sensitivities for each immunization group
免疫3次后,直接ELISA测定各免疫组效价,间接竞争ELISA测定IC50,结果见表1。
各免疫大白兔均有免疫反应,高剂量组(1 mg/只)效价 6.4×104~1.28×105,低剂量组(0.5 mg/只)效价 1.6×104~3.2×104,其中效价最高为 1.28×105,抗体效价的产生也佐证了雷洛昔芬人工抗原合成成功。灵敏度结果显示,1号实验兔(Rab-1)所产生的抗体最灵敏,IC50为16.8 µg/L,故选择Rab-1抗体初步建立ELISA方法。
2.3 抗体特异性
抗体与其他结构类似的抗雌激素药物交叉反应如表2所示,抗体除了能与雷洛昔芬小分子特异性结合,与其他结构类似抗雌激素没有交叉反应,说明本抗体特异性好,可以特异地捕获雷洛昔芬。

表2 抗体与其他结构类似抗雌激素的交叉反应Table 2 Cross-reactivity of antibodies with other anti- estrogens
2.4 方法的建立
2.4.1 抗原抗体初步工作浓度的确定
采用方阵滴定法,确定抗原抗体初步工作浓度(表3),以OD值在1.0左右所对应的抗原浓度(400µg/L)和抗体稀释倍数(1:128000)为最初工作浓度,进一步优化最优的抗原抗体工作浓度。
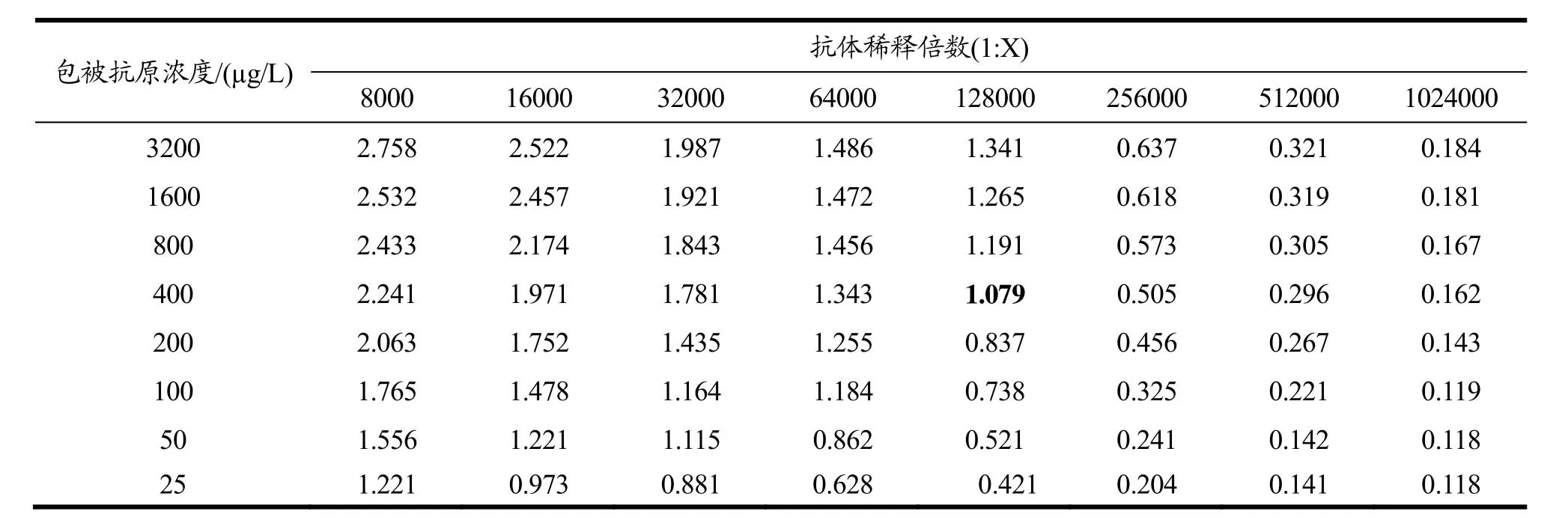
表3 方阵滴定结果Table 3 Results of chessboard titration
2.4.2 抗原最佳包被浓度

表4 包被不同抗原浓度的IC50值Table 4 IC50 values for different antigen concentrations
以表3中确定的包被抗原浓度400 µg/L为中心浓度,设计5个浓度梯度,采用间接竞争ELISA,测定包被不同抗原浓度的IC50见表4。
结果表明,包被300 µg/L的抗原,IC50最小,此浓度下抗体反应最灵敏。
2.4.3 抗体最佳工作浓度

表5 不同抗体浓度的IC50值Table 5 IC50 values for different antibody concentrations
以表3中确定的抗体工作浓度1.2×105为中心浓度,设计5个浓度梯度,采用间接竞争ELISA,测定不同抗体工作浓度的IC50见表5。结果表明,抗体稀释倍数为1.0×105,IC50最小,抗体反应最灵敏。
2.4.4 标准曲线
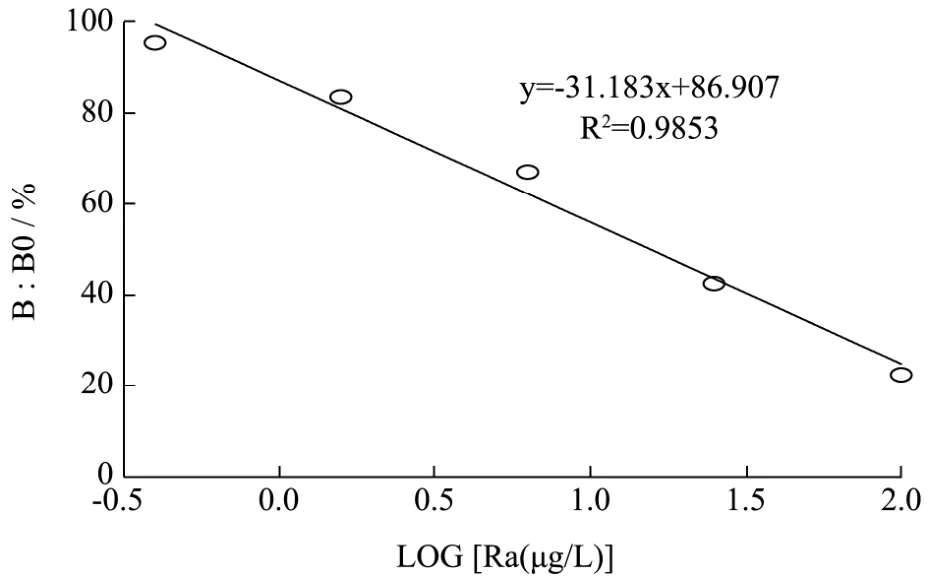
图5 标准曲线Fig.5 Standard curve for raloxifene
在最优的抗原抗体工作浓度下建立雷洛昔芬标准曲线,以抑制率为纵坐标,雷洛昔芬浓度的对数为横坐标,结果见图5。曲线在0.4~102.4 µg/L范围内线性关系好,R2=0.9853,最低检测能力可达0.4 µg/L。
3 讨论
高质量的抗体是建立免疫化学方法的基础,而高质量的抗体取决于小分子半抗原的改造和人工抗原的合成。雷洛昔芬属小分子化合物,属于半抗原,没有免疫原性,必须与载体蛋白偶联才才能刺激机体产生抗体。雷洛昔芬分子式上有活性的羟基,不能直接与载体蛋白偶联,需要进行人工改造。丁二酸酐法是改造羟基最常用的方法,碳二亚胺法是偶联羧基最常用的方法[26]。
本研究运用丁二酸酐法对雷洛昔芬进行衍生改造,引入活性基团羧基,采用碳二亚胺法将雷洛昔芬与载体蛋白偶联,通过紫外图谱扫描和动物免疫试验显示雷洛昔芬半抗原和人工抗原合成成功,能够刺激机体产生抗体。免疫剂量对抗体的质量也会产生很大的影响,本实验的结果(表 1)显示出低剂量的免疫原较高剂量的免疫原更易产生高效价、灵敏的抗体,这与先前的报道一致[27],其原因可能是低剂量抗原长时间刺激B细胞,有助于B细胞识别抗原,更易产生高效价的抗体。抗原抗体的工作浓度也是影响ELISA灵敏度的一个重要因素,本研究摸索了不同抗原抗体浓度对方法灵敏度的影响,结果显示出,在方阵滴定的结果基础上,降低抗原抗体浓度有助于提高方法的灵敏度,这与先前的报道一致[28]。方法的检测限是评价方法的重要指标,本方法最低检测能力可达 0.4µg/L,与肖甚圣[24]建立的超高效液相色谱-串联质谱法的最低检测能力(0.3 µg/L)接近,可用于水体中雷洛昔芬的筛查。
4 结论
本研究完成了雷洛昔芬抗体的制备和 ELISA检测方法的初步建立,所制备的抗体效价高,特异性好。通过对抗原抗体反应浓度的优化,标准曲线在0.4~102.4 µg/L范围内线性关系好,R2=0.9926,最低检测能力0.4 µg/L。本方法可以用于水体中雷洛昔芬的筛查,但对于食品基质中的检测,还需要进一步研究食品基质对方法的影响,包括样品的提取净化、准确度以及精密度等。
[1]Ah D V S, Alexi X, Van W E, et al. An antiestrogenic activity score for tamoxifen and its metabolites is associated with breast cancer outcome [J]. Breast Cancer Research &Treatment, 2017, 161(3): 567-574
[2]Chu S C, Hsieh C J, Wang T F, et al. Antiestrogen use in breast cancer patients reduces the risk of subsequent lung cancer: a population-based study [J]. Cancer Epidemiology,2017, 48: 22-28
[3]Suba Z. Activating mutations of esr1, brca1 and cyp19 aromatase genes confer tumor response in breast cancers treated with antiestrogens [J]. Recent Patents On Anti-Cancer Drug Discovery, 2017, 12(2): 136-147
[4]Kurebayashi J, Kanomata N, Yamashita T, et al. Antitumor and anticancer stem cell activities of eribulin mesylate and antiestrogens in breast cancer cells [J]. Breast Cancer, 2016,23(3): 425-436
[5]Janakiram N B, Mohammed A, Brewer M, et al. Raloxifene and anti-estrogenic gonadorelin inhibits intestinal tumorigenesis by modulating immune cells and decreasing stem like cells [J]. Cancer Prevention Research, 2014, 7(3):300-309
[6]孟娟,孙晓霞.选择性雌激素受体调节剂-雷洛昔芬[J].医学综述,2012,18(24):4223-4225 MENG Juan, SUN Xiao-xia. Raloxifene-a new selective estrogen receptor modulator [J]. Medical Recapitulate, 2012,18(24): 4223-4225
[7]Kathleen O, Shuhua C, Roberta D B. Impact of the selective estrogen receptor modulator, tamoxifen, on neuronal outgrowth and survival following toxic insults associated with aging and alzheimer's disease [J]. Experimental Neurology, 2004, 188(2): 268-278
[8]Yu L, Liu H, Li W, et al. Oxidation of raloxifene to quinoids:potential toxic pathways via a diquinone methide and o-quinones [J]. Chemical Research In Toxicology, 2004,17(7): 879-888
[9]Hirsimaki P, Aaltonen A, Mantyla E. Toxicity of antiestrogens [J]. Breast Journal, 2002, 8(2): 92-96
[10]White I N. Anti-oestrogenic drugs and endometrial cancers[J]. Toxicology Letters, 2001, 120(1): 21-29
[11]Liu X, Pisha E, Tonetti D A, et al. Antiestrogenic and DNA damaging effects induced by tamoxifen and toremifene metabolites [J]. Chemical Research In Toxicology, 2003, 16:832-837
[12]李彦斌,滕良珠,吴洪喜,等.雷洛昔芬对大鼠垂体瘤GH3细胞 Seladin-1基因表达与增殖的影响[J].山东大学学报(医学版),2012,50(4):47-50 LI Yan-bin, TENG Liang-zhu, WU Hong-xi, et al. Effects of raloxifene on proliferation and seladin-1 gene expression in GH3 cells [J]. Journal of Shandong University, 2012, 50(4):47-50
[13]卢翔,陈江宁,张峻峰.雷洛昔芬通过促进一氧化氮释放诱导脂肪干细胞向成骨细胞分化[J].中国药理学通报,2011,27(1):24-28 LU Xiang, CHEN Jiang-ning, ZHANG Jun-feng. Raloxifene enhances osteoblastic differentiation in adipose derived stem cells via nitric oxide pathway [J]. Chinese Pharmacological Bulletin, 2011, 27(1): 24-28
[14]Heberer T. Occurrence, fate, and removal of pharmaceutical residues in the aquatic environment: a review of recent research data [J]. Toxicology Letters, 2002, 131(1-2): 5-17
[15]Zuccato E, Castiglioni S, Fanelli R, et al. Pharmaceuticals in the environment in Italy: causes, occurrence, effects and control [J]. Environmental Science & Pollution Research,2006, 13(1): 15-21
[16]李广丽,刘晓春,林浩然.芳香化酶抑制剂letrozole对赤点石斑鱼(Epinephelus akaara)性逆转的作用[J].生理学报,2005,57(4):473-479 LI Guang-li, LIU Xiao-chun, LIN Hao-ran. Aromatase inhibitor letrozole induces sex inversion in the protogynous red spotted grouper (Epinephelus akaara) [J]. Acta Physiologica Sinica, 2005, 57(4): 473-479
[17]Park I S, Oh H S, Koo J G. Effect of oral tamoxifen on growth and survival in the bagrid catfish pseudobagrus fulvidraco [J]. Aquaculture Research, 2003, 34(15):1471-1474
[18]Yang Z, He X, Zhang Y. The determination of raloxifene in rat tissue using hplc [J]. Biomedical Chromatography, 2007,21(3): 229-233
[19]Bagheri A, Hosseini H. Electrochemistry of raloxifene on glassy carbon electrode and its determination in pharmaceutical formulations and human plasma [J].Bioelectrochemistry, 2012, 88(88): 164-170
[20]胡雯娟,张逸凡,陈笑艳,等.液相色谱-串联质谱法测定人血浆中雷洛昔芬及其在制剂生物等效性研究中的应用[J].中国新药杂志,2011,20(22):2233-2237 HU Wen-juan, ZHANG Yi-fan, CHEN Xiao-yan, et al.Determination of raloxifene in human plasma using liquid chromatography-tandem mass spectrometry and its application in bioequivalence study [J]. Chinese Journal of New Drugs, 2011, 20(22): 2233-2237
[21]Basavaiah K, Tharpa K, Anil Kumar U R, et al. Optimized and validated spectrophotometric methods for the determination of raloxifene in pharmaceuticals using permanganate [J]. Archives of Pharmacal Research, 2009,32(9): 1271-1279
[22]赵娴,蔡梅,王洪韵,等.HPLC 法测定盐酸雷洛昔芬及其片剂中的有关物质[J].药物分析杂志,2014,12:2192-2197 ZHAO Xian, CAI Mei, WANG Hong-yun, et al. HPLC determination of impurities in raloxifene hydrochloride and its tablets [J]. Chinese Journal of Pharmaceutical Analysis,2014, 12: 2192-2197
[23]王倩,张红梅,于治国.高效液相色谱法测定盐酸雷洛昔芬含量[J].沈阳药科大学学报,2002,19(2):105-108 WANG Qian, ZHANG Hong-mei, YU Zhi-guo.Determination of the content of raloxifene hydrochloride by HPLC [J]. Journal of Shenyang Pharmaceutical University,2002, 19(2): 105-108
[24]肖甚圣,杨奕,张晶,等.超高效液相色谱-串联质谱法测定鱼组织中的 6种抗雌激素药物[J].色谱,2011,29(11): 1055-1061 XIAO Shen-sheng, YANG Yi, ZHANG Jing, et al.Determination of 6 antiestrogens in fish tissues by ultra performance liquid chromatography-tandem mass spectrometry [J]. Chinese Journal of Chromatography, 2011,29(11): 1055-1061
[25]刘波,袁利鹏,聂燕华,等.氟西汀快速免疫检测用人工抗原的合成与鉴定[J].现代食品科技,2016,32(8):290-294 LIU Bo, YUAN Li-peng, NIE Yan-hua, et al. Synthesis and identification of artificial antigen for the rapid immunological detection of fluoxetine [J]. Modern Food Science &Technology, 2016, 32(8): 290-294
[26]王晶,王耀,王方雨,等.草甘膦人工抗原的制备及兔源多抗的ELISA鉴定[J].食品科学,2017,38(4):65-69 WANG Jing, WANG Yao, WANG Fang-yu, et al. Preparation of artificial antigen and ELISA identification of rabbit polyclonal antiserum for the detection of glyphosate [J]. Food Science, 2017, 38(4): 65-69
[27]Chang C, Peng D P, Wu J E, et al. Development of an indirect competitive elisa for the detection of furazolidone marker residue in animal edible tissues [J]. Journal of Agricultural &Food Chemistry, 2008, 56(5): 1525-1531
[28]Wu J, Chang C, Ding W P, et al. Determination of florfenicol amine residues in animal edible tissues by an indirect competitive elisa [J]. Journal of Agricultural & Food Chemistry, 2008, 56(18): 8261-8267
