宫颈癌发生与肿瘤组织代谢物变化及代谢途径的分析研究
2018-06-11阿仙姑哈斯木努尔满古力肉孜徐丽秀哈提拉吐尔逊马俊旗
阿仙姑·哈斯木,努尔满古力·肉孜,2,徐丽秀,哈提拉·吐尔逊,马俊旗
(1新疆医科大学基础医学院病理学教研室,乌鲁木齐 830011;2新疆维吾尔自治区人民医院妇科,乌鲁木齐 830000;3新疆医科大学第一附属医院妇科,乌鲁木齐 830054)

专题研究
作者简介:阿仙姑·哈斯木,医学博士,教授,博士生导师。研究方向:宫颈癌病因、发病机制研究。兼任中国抗癌协会肿瘤病因学学会青年委员、中华医学会医学细胞生物学青年委员、新疆医学会病理学专业委员、新疆免疫学学会理事。入选新疆维吾尔自治区法医病理专家库。担任《Plos One》、《Molecular Biology Reports》、《新疆医科大学学报》等期刊审稿人。以通信作者及第一作者身份发表论文30余篇,包括SCI收录论文20篇。先后主持科研课题共10项(包括国家自然科学基金3项、中国科学院西部之光科学基金1项、新疆维吾尔自治区课题2项、新疆国家重点实验室面上项目1项等)。作为主要贡献者,获得各级科技成果奖共4项,包括2017年度新疆维吾尔自治区科学技术进步奖三等奖1项(排名第一)、2015年度新疆医学科技奖一等奖1项(排名第三)、2013年度新疆维吾尔自治区科学技术进步奖三等奖1项(排名第一)、发表的学术论文分别获得2014年和2013年自治区优秀科技论文一等奖和二等奖,2014年度新疆维吾尔自治区科协新疆转化医学青年杰出贡献三等奖1项(排名第一)。先后获得新疆维吾尔自治区人民政府第七届新疆青年科技奖(2014年)、新疆医科大学科技之星(2015年)、新疆维吾尔自治区天山英才工程第三层次培养人选和第二层次培养人选(2013年、2017年)。带领的研究团队2017年荣获新疆维吾尔自治区宫颈癌研究创新团队。
宫颈癌发生与脂肪酸代谢重编程及代谢调控的分子机制研究
恶性增殖是肿瘤的基本特征,消耗大量的原料和能量,故肿瘤细胞可能通过改变代谢谱式来调整能量短缺状态。这种代谢重编程很大程度上是由肿瘤细胞基因表达和代谢网络调控的,其通过直接作用于代谢酶或者通过一系列胞内信号传导,间接影响细胞代谢,使营养物质在代谢网络中的流向和流量被重新定义。本研究在前期研究的基础上进一步探讨宫颈癌组织代谢组分的变化并分析其关键代谢通路,检测代谢关健酶及能量代谢效应分子在宫颈癌中的表达及对宫颈癌脂肪酸代谢的影响,为改善宫颈癌患者预后及肿瘤的靶向治疗提供新的参考。
宫颈癌发生与肿瘤组织代谢物变化及代谢途径的分析研究
阿仙姑·哈斯木1,努尔满古力·肉孜1,2,徐丽秀1,哈提拉·吐尔逊1,马俊旗3
(1新疆医科大学基础医学院病理学教研室,乌鲁木齐830011;2新疆维吾尔自治区人民医院妇科,乌鲁木齐830000;3新疆医科大学第一附属医院妇科,乌鲁木齐830054)
摘要:目的探讨子宫颈癌发生与肿瘤组织代谢物及代谢途径关键酶表达变化的关系。方法收集子宫颈鳞癌、宫颈上皮内瘤变(CIN)及慢性宫颈炎(正常对照)新鲜及石蜡包埋组织标本,采用超高效液相色谱联合三重四级杆串联质谱(UHPLC-MS/MS)技术检测宫颈组织代谢组分,应用正交偏最小二乘判别分析法(OPLS-DA )对UHPLC-MS/MS数据进行模式识别分析,确定3种宫颈组织差异性代谢物组分,并应用代谢通路分析软件(Metabo Analyst和KEGG)综合分析,预测关键代谢通路。采用定量RT-PCR方法和免疫组织化学 SP法检测关键代谢通路关键酶谷氨酸脱羧酶1(GAD1)、糖原合成激酶3(GSK-3)、丙酮酸激酶(PKM2)和肉毒碱棕榈酰基转移酶(CPT1)的转录及蛋白表达情况。结果3种宫颈组织之间有34种差异性小分子代谢物;代谢通路分析预测出18条关键代谢通路,其中能量代谢与宫颈癌发生可能最为密切;定量RT-PCR方法结果显示,宫颈癌组织内GAD1及GSK-3β表达水平明显降低(P<0.05),而PKM2及CPT1表达水平明显升高(P<0.05);免疫组织化学结果显示,从正常对照组织到CIN和宫颈癌,GAD1和GSK-3β表达水平明显下降(P<0.05),从强阳性和中等阳性逐渐向弱阳性和阴性变化,而PKM2和CPT1蛋白质表达水平明显上升(P<0.05),进一步验证了定量RT-PCR结果。结论宫颈癌发生伴有肿瘤组织内糖和脂肪酸分解代谢加剧,能量代谢增强,处于物质代谢紊乱的病理状态,其可能与关键代谢途径的限速酶表达调控存在密切关系。
关键词:宫颈癌;能量代谢;组织代谢组分;关键酶
中图分类号:R737.33
文献标识码:A
文章编号:1009-5551(2018)05-0521-08
doi:10.3969/j.issn.1009-5551.2018.05.001
在本研究中,学生完成二稿的基本程序是,课下按照批改网反馈提示反复修改作文,然后提交。因教师并没有对修改提出具体要求,所以学生往往只根据反馈提示修改个别错误,看到分数提高即提交,导致词汇运用能力没有得到显著提高。因此,教师应该提出修改次数的要求,并规定学生按批改网的反馈提示逐条修改,如果放弃采纳某一提示,需给出原因。这样做可以使学生认真对待批改网的反馈,从而将批改网作为促改工具应用于写作教学,这二者的有机结合程度会影响学生对批改网的接受程度和利用率(2016)。如果放弃修改的原因是连续修改失败,学生可以求助于同伴或教师。
基金项目:国家自然科学基金(81360332)
作者简介:阿仙姑·哈斯木(1974-),女,博士,教授,博士生导师,研究方向:妇科肿瘤,E-mail:axiangu75@126.com。
本文引用:阿仙姑·哈斯木,努尔满古力·肉孜,徐丽秀,等.宫颈癌发生与肿瘤组织代谢物变化及代谢途径的分析研究J].新疆医科大学学报,2018,41(5):521-527,533.doi:10.3969/j.issn.1009-5551.2018.05.001
Analysisofthemetabolicchangesandmetabolicpathwaysintumortissuesofcervicalsquamouscellcarcinoma
AxianguHaimu1,NuermanguRouzi1,2,XULixiu1,HatilaTuerxun1,MAJunqi3
(1DepartmentofPathology,SchoolofPre-clinicalMedicine,XingjiangMedicalUniversity,Urumqi830011,China;2DepartmentofGynaecologyofthePeople′sHospitalofXinjiangAutonomousRegion,Urumqi830000,China;3DepartmentofGynecology,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830054,China)
Abstract:ObjectiveTo explore the relationship between the progress of squamous cell carcinoma of the cervix and the regulation of metabolic network.MethodsFresh specimens and paraffin-embedded tissue slices form patients with cervical squamous cell carcinoma(CSCC),cervical intraepithelial neoplasia(CIN)Ⅱ-Ⅲ and normal controls(NC)were collected.Ultra high-performance liquid chromatography coupled with triple-quadrupole mass spectrometry(UHPLC-MS/MS)was performed to identify metabolites in the three group specimens.Orthogonal partial least-squares discriminant analysis(OPLS-DA)was used to model the systematic variation related to patients with CIN or CSCC with healthy controls.The metabolomics data was additionally analyzed by professional softwares recognizing metabolic pathways(KEGG;MetaboAnalyst 2.0)and online databases,to identify certain metabolic pathways and key enzymes associated with the metabolic regulation.Quantitative RT-PCR was used to reveal the association of cervical carcinoma with the mRNA expression level of candidate key enzymes.Meanwhile,the protein expression level of candidate key enzymes in paraffin-embedded tissue specimens were provided by the pathological tissue specimen bank.Results34small molecular metabolites were identified that were different in cervical carcinoma.This profile was comprehensively analyzed by professional softwares for recognizing metabolic pathways(MetaboAnalyst and KEGG)and predicted 18 key metabolic pathways,among which cervical carcinogenesis was the most probably associated with 4key metabolic pathways,the energy metabolism may be the most closely related to the occurrence of cervical cancer.By analysis of transcriptions for candidate genes coding these key enzymes by quantitative RT-PCR,the results showed that the expression of PKM2 and CPT1 was significantly upregulated,and GAD1 and GSK-3β downregulated,respectively,in tissue specimens of cervical carcinoma compared with normal controls(P<0.05).In immunohistochemical staining analysis further confirmed the result of quantitative RT-PCR,the protein expression of GAD1 and GSK-3β was gradually decreased,and PKM2 and CPT1 increased,respectively,from normal controls to precancerous lesions(CIN Ⅱ-Ⅲ)and cervical carcinoma with significant differences(P<0.05).ConclusionThe occurrence of cervical cancer is accompanied by increased glucose and fatty acid catabolism and increased energy metabolism in the tumor tissue.It is in a pathological state of substance metabolism disorder.It may be closely related to the expression of speed limiting enzymes in key metabolic pathways.
Keywords:cervical cancer;energy metabolism;tissue metabolism component;key enzymes
恶性增殖是肿瘤的基本特征,消耗大量的原料和能量,肿瘤细胞通过改变特定代谢谱来调整能量短缺状态[1]。近期,研究者通过细胞代谢组分分析发现了快速鉴别宫颈癌风险的标志物和检测方法[2-3]。课题组在前期研究中,对子宫颈鳞癌和正常对照的血浆进行代谢组分分析,发现一系列宫颈鳞癌特异的血浆代谢物群,主要是肿瘤患者糖酵解、脂肪酸代谢、氨基酸和核苷酸分解代谢紊乱,间接地反映肿瘤组织能量代谢失调,肿瘤细胞基因表达及代谢调控的异常[4-7]。宫颈癌细胞的诞生与生存不仅伴随着自身的基因表达调控改变,并与代表整体水平变化的代谢水平动态变化也存在一定的因果关系。临床上大部分的宫颈癌(cervical carcinoma,CC)都是由宫颈上皮内瘤样变(cervical intraepithelial neoplasia,CIN)演变而来,因此CIN 是与宫颈浸润癌密切相关的一组癌前病变,反应了宫颈癌发生、发展的一个连续性过程。为了明确宫颈癌演进过程与代谢网络调控的关系,本研究拟利用宫颈鳞癌、宫颈上皮内瘤变及慢性宫颈炎组织进行组织代谢组学研究,并进一步分析代谢网络调控与关健酶表达的关系,从分子水平上进一步认识宫颈癌的发病机制。
1 资料与方法
1.1临床标本的收集收集2015年1月-2015年9月在新疆维吾尔自治区人民医院妇科收治的宫颈鳞癌(CSCC)、癌前病变(CINⅡ~Ⅲ)及慢性宫颈炎(正常对照,NC)活检组织标本共57例,其中宫颈鳞癌患者22例,年龄42~67岁,平均52.7岁,CINⅡ~Ⅲ患者为16例,其中6例为CINⅡ级,10例为CINⅢ级,年龄27~51岁,平均47.4岁,慢性宫颈炎29例。宫颈鳞癌患者按照国际妇产科联盟(FIGO 2009)的诊断标准进行分期。手术后的肿瘤组织样本用0.9%氯化钠清洗3次,洗去残余的血液,迅速于液氮中冷冻,并转移至-80℃冰箱中保存。由于伦理原因及组织学改变特点,临床上获得CIN新鲜组织的难度大,故qRT-PCR方法只验证癌及正常组织关键酶转录表达变化。关键酶蛋白表达检测所需标本为石蜡包埋组织标本,其中慢性宫颈炎51例,CINⅡ~Ⅲ38例,宫颈鳞癌34例。
1.2UHPLC-QqQ-MS技术检测组织样本代谢组分(1)样本制备及检测:取100mg组织样本,加入200μL H2O后进行研磨,然后加入800μL 甲醇:乙腈(1∶1,v/v),涡旋混匀30s;-20℃静置1 h;紧接着将样本4℃,12 000 r/min离心15min;取800μL上清,并用旋转真空浓缩仪室温下进行干燥;加入100μL乙腈:水(1∶1,v/v)进行复溶;4℃水浴超声10min,助溶;4℃,12 000 r/min离心15min;取上清,-80℃保存直至上机检测。(2)UHPLC色谱条件:柱温40℃,进样量5μL,样品室温度4℃。流动相:纯水(A),乙腈(B),流速为0.4mL/min。(3)TOFMS质谱条件:多反应监测(MRM)扫描,电喷雾离子模式,离子源温度为100℃,除溶剂温度为300℃;除溶剂气体流量是3.0L/min。(4)数据处理与分析:从原始数据中,共获得9个质量控制样品(Quality control,QC)和67个样品,137个峰,过滤后,还有126个峰。采用 OPLS-DA 模型结合 student′st检验(t-test)的P值(阈值0.05)来寻找差异性表达代谢物。在每组P<0.05的数据中,对每个代谢物进行倍数变化,选取同时倍数变化明显的结果作为差异性代谢物。为了进一步分析宫颈癌、癌前病变患者体内发生紊乱的代谢通路,利用发现的潜在标志物进行代谢通路分析。通路分析模块(pathway analysis module)用于识别在所设计的实验条件下获得的与病理状态最相关的代谢通路。通路分析模块利用KEGG代谢通路作为后台数据库。
1.3qRT-PCR法验证候选限速酶转录变化提取组织总RNA提取,采用定量RT-PCR法分别对各候选基因进行定量检测及分析,采用标准曲线法,根据每个基因的标准曲线和每个待测样品的Ct值为每个样品换算出SQ值,即为该候选基因在该样品中的相对转录水平。以管家基因β-actin为内参基因,对每个待测样品的候选基因进行标准化处理,得到其标准化的相对转录水平。通过融解曲线和扩增效率分析来评估扩增产物的特异性。最终按照候选基因[谷氨酸脱羧酶1(GAD1)、糖原合成激酶3(GSK-3)、丙酮酸激酶(PKM2)和肉毒碱棕榈酰基转移酶(CPT1)]和内参基因平均SQ值的比较评估或推算候选基因的相对表达量。编码候选基因mRNA序列特异性引物信息见表1。
1.4免疫组织化学方法对选择的石蜡包埋的组织标本,进行3 μm 厚的切片,按照北京中杉金桥生物技术有限公司免疫组织化学SP检测试剂盒说明书的方法检测宫颈组织中GAD1、GSK-3、PKM2和CPT1蛋白质的表达。显微镜下评分(阳性范围+强度,0~6分),评分标准:阳性范围:0分:阴性,1分:0<范围≤30%,2分:30%<范围≤60%,3分:>60%;阳性强度:0分:阴性;1分:弱阳性;2分:阳性;3分:强阳性。综合积分=(阳性范围+阳性强度)/2。综合判定:积分<1:阴性(-);1 分:+;2分:++;3分:+++。
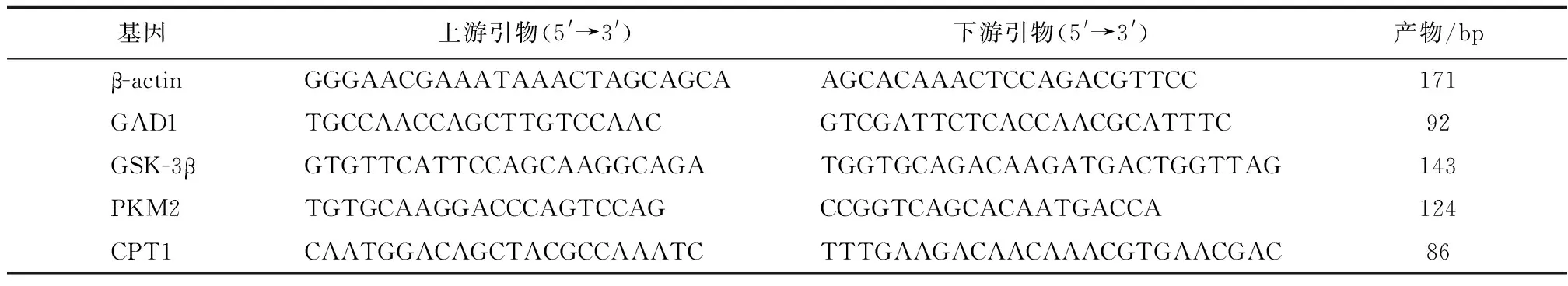
表1 编码候选基因的mRNA序列特异性引物信息
1.5统计学处理本研究用SPSS17.0对实验数据进行统计学分析,P值采用双边检测,3组数据之间比较采用单因素方差分析,2组数据之间比较采用t检验;等级资料用秩和检验,多组间比较用Kruskall-Wallis检验,两两比较用Mann-WhitneyU检验,以P<0.05为差异有统计学意义。
2 结果
2.1宫颈癌、CIN和慢性宫颈炎组织代谢组分分析UHPLC-QqQ-MS技术检测宫颈组织代谢组分,发现原始数据中有137个峰,对其进行主成分PCA分析和OPLS-DA分析,分别获得Total PCA得分图(图1)和OPLS-DA得分图(图2)。PCA得分图不能有效地区分宫颈癌、CIN及慢性宫颈炎组织的代谢组分,故进一步进行OPLS-DA 分析,发现R2Y、Q2越接近1,说明OPLS-DA 模型越能很好地解释2组样本之间的差异(图2a~图2c)。通过排列实验随机多次(n=200)改变分类变量y的排列顺序得到相应不同的随机Q2值对模型有效性做进一步的检验,结果如图2d~2f所示,置换检验截距(R2=0.722,Q2=-0.229)可以很好体现模型的稳健性。鉴于结合模型的高度有效性,我们接下来的标志物筛查均建立在结合模型基础上。不同组模型参数的排列分析如下:正常对照与宫颈癌:(R2=0.72,Q2=-0.23);正常对照与 CIN:(R2=0.67,Q2=-0.29);CIN与宫颈癌:(R2=0.72,Q2=-0.23)。

宫颈癌与NC,CIN与NC,宫颈癌与CIN之间的差异性代谢物的比较见表1(表中红色和蓝色字体为取阈值VIP>1 且P-VALUE<0.05的差异物,红色表示上调,蓝色表示下调)。经过严格的筛查步骤,共发现34个有意义的代谢物。与NC相比,宫颈癌有14个差异性代谢物;与NC相比,CIN有15个差异性代谢物;与CIN相比,宫颈癌有9个差异性代谢物,见表2。

图2 不同宫颈组织OPLS-DA得分图及置换检验图

表2 CSCC、CIN 与正常对照之间的差异性代谢物的比较
2.2宫颈癌、CIN和正常对照组织差异代谢物的通路分析根据代谢通路KEGG数据库,与正常对照相比共发现了18条与宫颈癌相关的发生紊乱的代射通路(图3)。这些代谢途径组成能量和氨基酸代谢,包括脂肪酸合成及分解、氨酰-tRNA生物合成、氨基酸生物合成和蛋白质的消化及吸收等。
2.3宫颈癌发生与肿瘤组织内候选限速酶转录表达关系对61例宫颈癌和正常对照组织RNA进行定量RT-PCR筛查分析,发现宫颈癌组织内GAD1及GSK-3β等调节氨基酸代谢和糖原合成代谢途径的限速酶表达水平明显降低(P<0.05),而PKM2及CPT1等调节糖酵解和脂肪酸分解代谢的限速酶表达水平明显升高(P<0.05)。提示宫颈癌发生与肿瘤组织内限速酶表达异常可能相关,见表3。
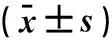
表3 4种候选基因表达水平的定量RT-PCR分析
2.4宫颈癌发生与肿瘤组织内候选限速酶蛋白表达关系GSK-3β、PKM2和CPT1的阳性表达主要定位于细胞质,GAD1的阳性表达主要定位于细胞核(图4)。从慢性宫颈炎到CIN和宫颈癌,GAD1和GSK-3β表达水平显著下降(P<0.05),从强阳性和中等阳性逐渐向弱阳性和阴性变化,而PKM2和CPT1蛋白质表达水平显著上升(P<0.05)验证了上述定量RT-PCR分析结论(表4~7)。
图3 差异性代谢物的代谢通路图

图4 PKM2、CPT1、 GSK-3β和GAD1在宫颈癌及慢性宫颈炎组织中的表达(×200)

表4 不同宫颈病变组织中GAD1蛋白水平差异
注:多组间秩和检验,aP<0.05;与慢性宫颈炎比较,bP<0.05;与CIN比较,cP<0.05。
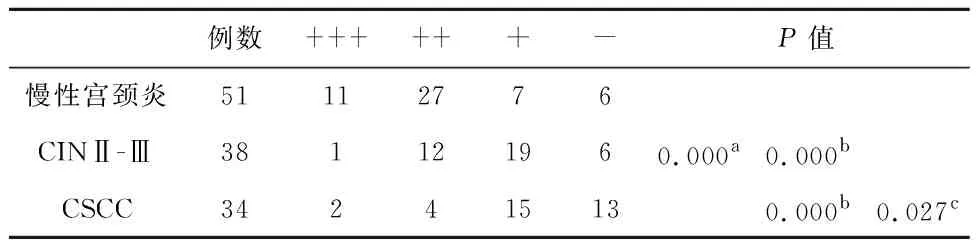
表5 不同宫颈病变组织中GSK-3β蛋白水平差异
注:多组间秩和检验,aP<0.05;与慢性宫颈炎比较,bP<0.05;与CIN比较,cP<0.05。

表6 不同宫颈病变组织中PKM2蛋白水平差异
注:多组间秩和检验,aP<0.05;与慢性宫颈炎比较,bP<0.05;与CIN比较,cP<0.05。
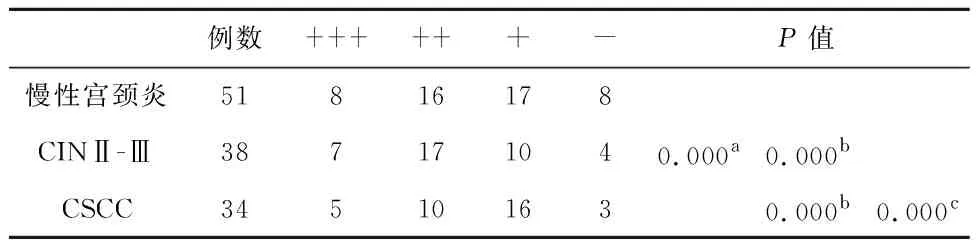
表7 不同宫颈病变组织中CPT1蛋白水平差异
注:多组间秩和检验,aP<0.05;与慢性宫颈炎比较,bP<0.05;与CIN比较,cP<0.05。
3 讨论
研究证实,肿瘤细胞的存活和快速增殖与肿瘤细胞的代谢密切相关[8-10]。而肿瘤细胞代谢改变很大程度上是由肿瘤细胞基因表达和代谢网络调控的,其通过直接作用于代谢通路关健酶或者通过一系列细胞内信号传导,间接影响肿瘤细胞代谢,使营养物质在代谢网络中的流动方向和流动量被重新定义[11-12]。因此,异常的肿瘤细胞代谢的改变可作为恶性肿瘤的一个重要特点。
本研究前期研究通过NMR技术手段和OPLS-DA分析方法对宫颈癌和CIN患者血浆进行代谢组学分析,发现CIN患者血浆中极低密度脂蛋白、不饱和脂肪酸和丙酮含量增加,而乳酸、丙氨酸、缬氨酸、亮氨酸、肌酸、异亮氨酸和1-甲基组氨酸等多种氨基酸含量减少。宫颈癌患者血浆中有较高水平的甲酸和乙酸,但支链氨基酸等水平降低,提示宫颈癌患者多种能量代谢的紊乱[4-5]。利用高效液相色谱(HPLC)代谢组学技术检测宫颈癌、宫颈上皮内瘤变及健康人血浆游离氨基酸含量改变,发现CIN和宫颈癌患者在不同发展阶段血浆存在明显的氨基酸代谢异常,由此得出,宫颈癌细胞可能选择性地从血浆中摄取特定氨基酸来满足自身不同阶段的生长需求[6-7]。以上研究提示,肿瘤的发生伴随着组织或细胞代谢网络发生明显改变,这种变化可能已经体现在机体体液代谢物中,其表现为一种体液代谢水平或代谢物的含量的“微调”,是肿瘤早期预警的重要标记。此种“微调”暗示或预示着肿瘤发生或生存,并提供肿瘤组织中各种代谢通络发生相关的重要信息。
为了明确宫颈癌演进过程与代谢网络调控的关系,我们利用宫颈癌、CIN和正常对照组织进行组织代谢组学研究,发现糖酵解代谢,脂肪酸-β氧化和谷氨酰胺氧化代谢增强,并筛选出与宫颈癌进展相关的34种小分子代谢物。进一步分析代谢通路关健酶活性,发现宫颈肿瘤组织内GAD1转录和蛋白质表达水平显著下降,从氨基酸代谢调控角度分析,推测肿瘤组织细胞可能处于一种逆转氨基酸分解代谢的应激状态,不仅是保护细胞内氨基酸资源的早期事件,也是肿瘤细胞补充氨基酸的补偿性反应,此为揭示肿瘤细胞内氨基酸合成代谢和分解代谢之间调控网络的机制提供重要依据。GSK-3β是一个多功能激酶,参与蛋白合成、细胞增殖、细胞分化、细胞运动以及肿瘤发生等多方面,扮演着重要角色 。目前,GSK3β在肿瘤发生和发展方面存在争议,研究者认为p-GSK3βtyr216是一种GSK3β激活状态,在肿瘤组织内以高表达,促进Cyclin D等细胞周期相关的蛋白质表达,促进肿瘤细胞的生存和增殖,而抑制p-GSK3βtyr216活性,可抑制肿瘤细胞增殖,促进肿瘤细胞死亡[13]。p-GSK3βser9是GSK3β失活状态,而肿瘤组织内高表的GSK3β可能以p-GSK3βser9形式存在[14]。本研究中,GSK-3β在宫颈癌组织中表达下调,提示GSK-3β在宫颈癌的发生、发展过程中可能起到一定的抑制作用,其具体作用机制有待于进一步研究。
PKM2作为糖酵解途径中重要的限速酶,参与的反应是催化磷酸烯醇式丙酮酸生成丙酮酸。在研究中,PKM2编码基因的转录和蛋白质表达水平在肿瘤组织内显著升高,提示PKM2高表达使肿瘤细胞在高速增殖、缺氧和能量匮乏的微环境中,获得以糖酵解方式摄取能量的能力,在肿瘤代谢形式的变更及能量供给过程中起着重要作用。本研究中,脂肪酸β-氧化的关键酶CPT-1在宫颈癌组织表达上调。脂质合成与分解代谢的异常是肿瘤细胞代谢重编程的重要特征。在肿瘤细胞中,一方面脂肪酸的从头合成明显增加,以满足细胞增殖对脂质的需要;另一方面当肿瘤细胞缺乏葡萄糖时,将通过增强脂肪酸β-氧化来满足细胞对能量的需求[15],促进肿瘤细胞的增殖和迁移。
本研究宫颈癌组织中糖酵解代谢,脂肪酸-β氧化和谷氨酰胺氧化代谢增强,同时发现其代谢关键酶表达异常,说明宫颈癌的发生、发展与肿瘤细胞代谢异常相关,而代谢酶异常表达可能是引起肿瘤细胞代谢异常的关键。可见,研究肿瘤细胞异常代谢与肿瘤细胞增殖的关系,以及研究代谢关键酶异常表达对肿瘤细胞代谢的调控机制对揭示肿瘤发病的分子机制非常必要。本课题组将进一步从细胞和动物模型水平上,明确代谢关键酶、能量代谢效应分子调控肿瘤细胞代谢网络的分子机制以及影响整体代谢组的规律。
[收稿日期:2018-02-27]
(本文编辑杨晨晨)
