铝的活化及其水解吸附分离镁锂
2018-06-11李艳红刘崇武陈星宇刘旭恒赵中伟
李艳红,姜 怀,刘崇武,陈星宇,刘旭恒,赵中伟
铝的活化及其水解吸附分离镁锂
李艳红,姜 怀,刘崇武,陈星宇,刘旭恒,赵中伟
(中南大学 冶金与环境学院,长沙 410083)
针对高镁锂比盐湖中锂难以提取的难题,一种通过活性铝水解吸附锂的方法被用于从高镁锂比盐湖卤水结晶产物中高效提取锂。考察氯化钾、氯化钠和氯化锂及其混合物对铝的活化效果,进而对从NaCl和LiCl混合盐中提取锂进行研究,然后研究MgCl2和LiCl混合盐活化金属Al及水体分解Mg和Li,考察机械活化及活化铝水解反应条件对镁锂分离的影响。结果表明:含有LiCl的盐能使金属铝完全能被活化,经活化后铝快速与水反应生成活性氢氧化铝,同时吸附其中的锂。通过控制合适的机械活化和水浸出条件,活性铝水解吸附法能有效从混合盐中提取锂,锂的吸附率能达到96%。当在镁锂质量比为20:1的混合盐中加入6%的铝,机械活化时间60min后,采用50℃的水浸出活化后的物料2.0 h,锂的吸附率达到85%,而镁的吸附率仅约为0.6%,所得吸附沉淀中的镁锂质量比降低到0.12。因此,采用含镁锂的混合盐直接活化铝然后水解能实现很好的镁锂分离。
锂;铝;镁;水浸;吸附;机械活化
锂及其化合物具有优良的物理化学性能,被广泛的应用于国民生产的各种行业[1]。随着信息技术和电动汽车的迅猛发展,锂离子电池材料成为重要的研究领域[2]。因而,锂已经成为推动世界前进的重要元素,被誉为能源金属,其需求量正逐年增加[3]。
自然界中的锂主要赋存于花岗伟晶岩矿床和盐湖中,其中盐湖锂资源占全球锂储量基础的80%[4]。从矿物中提取锂由于开采冶炼成本高,无法满足市场对锂需求的增长[5]。从盐湖中提取锂成本相对较低,且锂资源储量巨大,这使得从盐湖中提取锂成为一种非常重要的获取锂的途径[6]。目前,全球80%以上的锂产品是通过从盐湖中提取获得的,但是这些锂产品均是从优质盐湖中提取获得[7]。这些优质盐湖具有一个共同的特点是溶液中镁锂质量比低,一般都低于8[8]。因此,目前在盐湖提锂研究领域,溶液的镁锂质量比作为衡量盐湖优劣的关键指标。
我国盐湖锂资源非常丰富,主要分布在青藏高原,这些盐湖的锂资源储量占我国金属锂总储量79%[9]。然而,这些盐湖都存在一个显著特征——镁锂质量比高,大部分都在40:1以上[10]。由于Mg2+与Li+的化学性质非常相似,两者难以分离。目前,一些成熟的工业技术均是针对低镁锂比盐湖,无法应用于从高镁锂比盐湖中提取锂[11]。
为了能高效地利用高镁锂比盐湖资源,研究者们开发了许多盐湖提锂的方法,如沉淀法、溶剂萃取法、锻烧浸取法、电渗析法、碳化法和吸附法等[12−18]。在这些方法中,无定型氢氧化铝吸附法被认为是最有效的一种方法。该方法是利用了活性氢氧化铝对锂离子具有选择性吸附的特性,特别适合从高镁锂比溶液中选择性吸附提取锂,该方法的关键是如何获得活性氢氧化铝。也有研究者通过铝酸钠溶液与盐酸反应或者氯化铝与氢氧化钠反应制备得到活性氢氧化铝,然后再投入到含锂的溶液中进行吸附[19]。通过向铝酸钠溶液中通入二氧化碳进行碳化分解得到氢氧化铝,然后再用于吸附锂[20]。尽管这些方法能制备活性氢氧化铝,具有较好的吸附性能。但是在一定条件下,这些活性氢氧化铝将发生晶型转变形成三水铝石或一水软铝石,从而失去对锂的吸附性能[21]。研究者们通过向卤水中加入铝盐,然后调节pH值原位生成活性氢氧化铝同时吸附锂,锂的吸附率达到94%[22−23]。尽管此方法能避免活性氧化铝的净化提高锂的吸附,但是为了获得活性氢氧化铝,需要往盐湖中加入酸或者碱来调节pH值。酸碱的加入将会影响盐湖的溶液平衡,破坏生态环境。如果在不破坏环境的条件下能够制备活性氢氧化铝,锂的清洁提取将可以实现。
大量研究表明[24−25],金属铝通过活化处理后能直接在各种水溶液中快速反应产生氢气,同时生成氢氧化铝。在这些金属铝的活化方法中,通过机械球磨铝粉与氯化盐的混合物,就能使铝的活性得到提高,与水反应时铝能完全转变成氢氧化铝[26],研究结果表明:氯化盐确实能活化铝。而盐湖卤水本身就是盐的溶液,且有相当部分盐湖就是由氯化盐型的溶液。这些氯化盐型的盐湖卤水通过自然蒸发结晶,就能得到大量的各种氯化盐的混合物。通过控制结晶的步骤和程度,锂也能随其它盐一起结晶。然后,采用这些含锂的混合盐去活化铝,通过水浸可以使铝转变成能吸附锂的氢氧化铝,实现锂的清洁提取。
基于以上分析,本文作者提出采用含锂以及含镁锂的混合氯化盐通过机械球磨活化铝后,再经水浸出提取分离混合盐中的镁锂。
1 实验
首先将铝粉(99.9%(质量分数),分析纯,150 μm)、氯化钾(99.6%(质量分数),分析纯)、氯化钠(99.5%(质量分数),分析纯)、氯化锂(97%(质量分数),分析纯)和氯化镁(99%(质量分数),分析纯)等试剂按实验要求进行混合。
1.1 混合盐机械活化铝
1) 盐(不含MgCl2)活化铝:将20 g上述混合物加入到500 mL的球磨罐中,再根据实验需求按照不同球料比(10:1~25:1)加入4~5 mm大小的钢球;然后将球磨罐固定在行星球磨机上进行球磨,转速被设定在38 Hz,球磨时间为1.0~3.0 h。球磨完成以后,待球磨罐冷却取出物料,即为活化后的铝粉。将活化后的0.8 g铝粉混合物加入到50 mL的塑料瓶子,加入20 mL纯水,采用文献[28]中所描述的排水法测量反应产生的氢气,以此来评价铝的活化效果。
2) 含镁锂的盐活化铝:将20g混合物加入到振动磨(XZM−100型,武汉探矿机械厂)中,振动磨由研钵(直径153 mm,高41.5 mm),圆柱环(内径100.5 mm,高38.5 mm,厚10.5 mm)和实心圆柱(直径76 mm,高38.5 mm)组成;设定振动转速为960r/min机械活化时间为20~120 min;机械活化完成以后,待研钵冷却取出物料,即为活化后的铝粉。
1.2 锂的提取及镁锂分离
先将100 mL纯水加入到250 mL的烧杯中,并采用水浴加热到实验设定的温度;然后将8~10 g活化后的粉末加入到烧杯中进行搅拌反应不同时间(1.0~3.0 h);反应完成后,对烧杯中的混合物进行过滤洗涤,分析滤液中的锂和镁浓度,并由此计算出锂和镁的吸附率以及沉淀中的镁锂质量比。
2 结果与讨论
2.1 铝的活化
氯化钠和氯化钾是卤水中最主要的成分。利用盐湖中原本存在的物质进行铝的活化,可以避免提锂时有害物质的引入。为此,本文作者首先研究不同氯化物活化铝的效果。将不同氯化物与铝的混合物按球料比为20:1进行机械球磨不同时间,然后与纯水反应产生氢气。
图1所示为不同氯化物机械球磨活化铝后与纯水反应产生氢气的曲线(产生的氢气越多,说明铝被活化的效果越好)。从图1中可以看出,当采用70%(质量分数)氯化钾进行活化后,活性铝与水能快速反应,当反应时间仅为9 min时,就有90%的铝已经参与反应了。当反应进行20 min时,氢气的产率达到95%。而采用80%(质量分数)的NaCl进行活化时,尽管开始阶段活性铝与水反应的速率较慢,但是当反应进行到7 min时,氢气开始快速产生,最终也能获得较高的产氢率(约95%)。由此可见,单独采用氯化钾或氯化钠都能很好起到活化金属铝的作用。

图1 不同氯化物机械球磨活化铝的效果
另外,考虑到卤水蒸发得到的干固体盐中会含有锂盐,因此含锂的氯化盐活化铝也被研究。从图1中还可以看出,采用60%NaCl(质量分数)和10%LiCl(质量分数)混合盐对铝进行机械活化,球磨1.0 h后,铝与水的反应活性明显被提高,反应进行20 min后,氢气还在持续产生。当球磨时间达到2.0 h后,氢气产生的速率显著增加。延长机械活化时间有利于混合盐对铝的活化,提高铝与水的反应速率。机械球磨时添加一定量的氯化盐确实能够起到提高铝反应活性的作用,其主要原因是氯化盐晶体具有一定脆性,在球磨时被磨碎的氯化盐晶粒分布在金属铝表面和裂缝中,阻止由于冷焊造成的铝粉颗粒团聚,从而加速颗粒被磨细,最终使得铝的化学反应活性被提高[27]。另外,氯化盐的添加可以增加水溶液的电导率,使氯离子易于穿透氧化膜层到达铝金属表面造成点蚀,将铝的电极电位变的更负[28]。这些作用都能加速铝的腐蚀,从而加快与水反应的速率。
上述实验表明,通过金属铝与氯化盐混合机械球磨,铝的反应活性的确会被提高。
2.2 含锂盐直接活化铝提取锂
2.2.1 机械球磨对锂吸附率的影响
将金属铝经过含氯化锂的混合盐机械活化后,金属铝与水反应产生氢氧化铝同时对锂进行吸附。因此,铝的机械活化效果将会直接影响锂的吸附提取。图2所示为机械活化对锂吸附率的影响。将铝与60%NaCl(质量分数)和10%LiCl(质量分数)混合盐按球磨比为20:1球磨不同时间后,再与70℃的纯水反应3.0 h,锂的吸附率如图2(a)所示。由图2(a)可看出,当球磨时间为1.0 h时,通过水浸出后,大约有83%锂被活性铝水解产物氢氧化铝吸附。随着球磨时间的增加,锂的吸附率逐渐增加。当球磨时间达到3.0 h后,锂的吸附率增加到92%。锂的吸附率是随着机械球磨时间的延长而增加。这主要是由于铝颗粒在球磨过程中经过反复的机械力冲击而破碎,导致粒度变细,反应活性提高。随着球磨时间越长,破碎和细化的程度越高,铝的活化程度也就越高。
在与水反应时,活化程度高的铝能生成更多的氢氧化铝,从而能够吸附更多的锂。机械活化时,球料比是另外一个重要因素。将按不同球料比机械球磨3.0 h后得到的铝盐混合物与水反应在70℃的条件下反应3.0 h进行锂的吸附,其结果如图2(b)所示。由图2(b)可看出,当球料比为10:1时,93%锂就能被吸附。将球料比增加到15:1时,锂的吸附有少许的下降,但是仍超过90%。继续增加球料比,锂的吸附率没有很大的波动,依然能达到90%以上。这种结果表明,机械球磨的球料比对锂的吸附提取影响不大,也说明在此条件下铝的活化效果差别不大。理论上较大的球料比在球磨时对铝颗粒能产生更大的机械冲击力,更有利于铝的活化。这主要是由于机械球磨的时间较长,且在一个较长的时间里,不同球料比条件下铝都已充分被活化。这导致球料比对活化效果的影响不明显,也就对锂的吸附效果影响不明显。
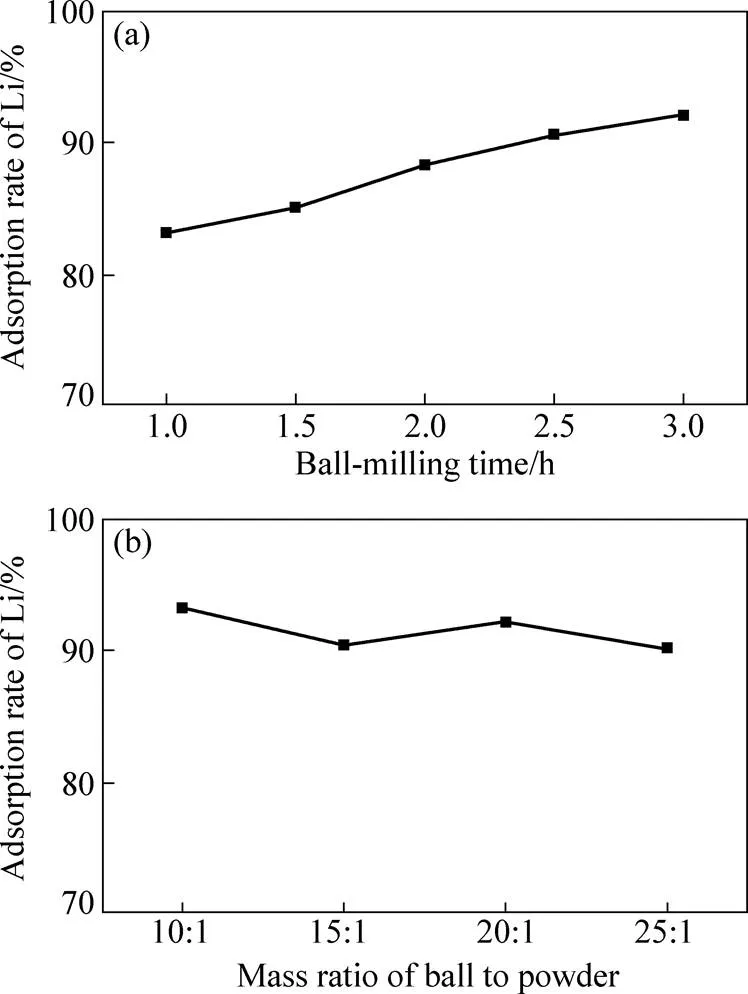
图2 机械活化对锂吸附率的影响
以上研究结果表明,采用机械球磨时,只要保证一定的球料比和足够长的球磨时间,铝就能充分被混合盐活化,其中的锂就能有效被吸附提取。
2.2.2 水浸出反应条件对锂吸附率的影响
水浸出反应条件对锂的吸附也是重要的影响因素。将按球料比为20:1机械活化3.0 h后的铝与氯化盐的混合物加入到70℃的水中,然后反应不同时间,锂的吸附率如图3(a)所示。由图3(a)可看出,与水反应1.0 h后,89%锂就被新生成的氢氧化铝吸附。随着反应时间的增加,锂的吸附率缓慢增加。当反应时间达到3.0 h时,锂的吸附率超过92%。随着反应时间的增加,活性铝水解反应进行得越彻底,产生的Al(OH)3越多,同时,Al(OH)3与溶液中锂接触时间越长,从而导致锂吸附效果越好。但同时也注意到,反应时间从1.0 h增加到3.0 h时,锂的吸附率仅增加约3%。这说明锂的吸附反应速率很快,在反应开始阶段,大部分的锂就已经被吸附。这与活性铝能快速水解形成氢氧化铝有着密切关系。图3(b)所示为水浸出温度对锂的吸附影响。将按球料比为20:1机械球磨3.0 h后得到的铝盐混合物投入到不同温度的水中反应3.0 h。在50℃的水中,锂的吸附达到96.2%。当反应温度升高到70 ℃,锂的吸附率却下降到92.1%。进一步提高温度到80 ℃,锂的吸附率继续下跌到89.8%。锂的吸附率随反应温度的增加是逐渐下降的。尽管反应温度提高有利于活性铝的水解反应,能生成更多的活性氢氧化铝。但是文献[29]中的研究表明,在较高温度条件下,在氯化锂溶液中采用氢氧化铝进行吸附时,随着时间的增加,锂的吸附率先增加然后逐渐降低。这主要是由于活化铝粉水解生成的活性氢氧化铝长时间在较高温度反应,自身将会逐渐趋于晶化而失去对锂的吸附。同时原本被吸附的锂也会被解吸,从而导致锂的吸附率有所下降。本研究采用氯化钠和氯化锂的混合盐,氢氧化铝的吸附行为与文献[29]中所描述的十分接近。在本研究中,提高反应温度锂的吸附率也会降低。因此,为了保证较高的锂的吸附率,本研究中将反应温度控制在50~60℃是合适的选择。
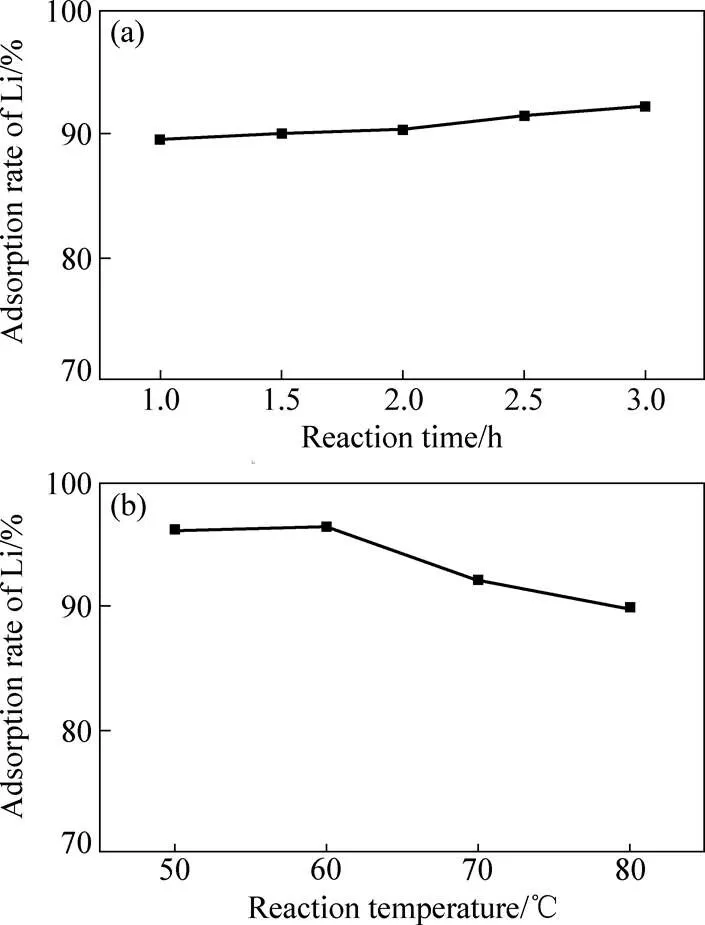
图3 水浸出反应条件对锂吸附率的影响
上述研究结果表明,通过含锂的氯化盐直接机械活化铝再通过水浸出能有效吸附混合盐中的锂。
2.3 混合盐直接活化铝进行镁锂分离
2.3.1 活化时间对镁锂分离的影响
将金属铝粉加入到镁、锂质量比为20的NaCl、LiCl和MgCl2的混合盐中(具体组成为6%Al- 67%NaCl-2%LiCl-25%MgCl2,质量分数)进行机械活化不同时间后,然后采用50℃的水浸出2.0 h,反应完成后镁锂分离的效果如图4所示。从图4中可以看出,随着机械活化时间的增加,水解产物Al(OH)3对锂的吸附率不断增加,而同时对镁的吸附率则降低缓慢,吸附产生的沉淀中镁锂质量比则逐渐降低。当机械活化时间达到60 min后,锂的吸附率达到约85%,而对锂的吸附率小于1%,只有约0.6%,吸附沉淀中镁锂质量比降低到0.12,镁锂分离效果十分理想。这主要是由于机械活化时间的延长有利于铝的活化,从而有利于铝的水解,产生更多的Al(OH)3,从而吸附锂。继续延长机械活化的时间,对铝的活化也有一定促进作用,但对锂的吸附率没有明显影响,而对镁的吸附稍微有些增加,从而导致沉淀中镁锂质量比有一点增加,但是也不超过0.9,依然具有很好的镁锂分离效果。

图4 机械活化时间对镁锂分离的影响
2.3.2 水浸出温度对镁锂分离的影响
将组成为6%Al-67%NaCl-2%LiCl-25%MgCl2(质量分数)粉末机械活化60 min后,然后采用不同温度的水浸出2.0 h。图5所示为锂和镁的吸附率以及沉淀中镁锂质量比随温度变化的曲线。从图5中可以看出,当水浸温度为40℃,由于温度相对较低,锂的吸附率只有65%,而镁的吸附率为3%左右。尽管锂的吸附率较低,但获得的沉淀中镁锂质量比不超过1。这主要是活化铝在较低水温下水解反应不够完全,从而影响到锂的吸附。当提高水浸出温度后,有利于活化铝的水解反应,使得锂的吸附率增加到85%左右,而对镁的吸附率没有很大的影响,只有轻微的下降。当水浸温度达到50℃,镁锂的分离达到最好效果。继续增加反应水温,活化铝的水解反应速度有明显提高。铝的快速水解对锂的吸附率则有一定的程度降低,但基本维持在80%左右。这与前面活性Al(OH)3只吸附锂时温度对附率的影响规律相似,主要是温度会促使活性的无定形Al(OH)3趋于晶化。从图5还可以看出,镁的吸附率则稍有增加,由此对沉淀中镁锂质量比造成一定程度的下降。基于温度对镁锂分离效果的影响规律,水解温度维持在50 ℃左右对镁锂的分离比较合适。
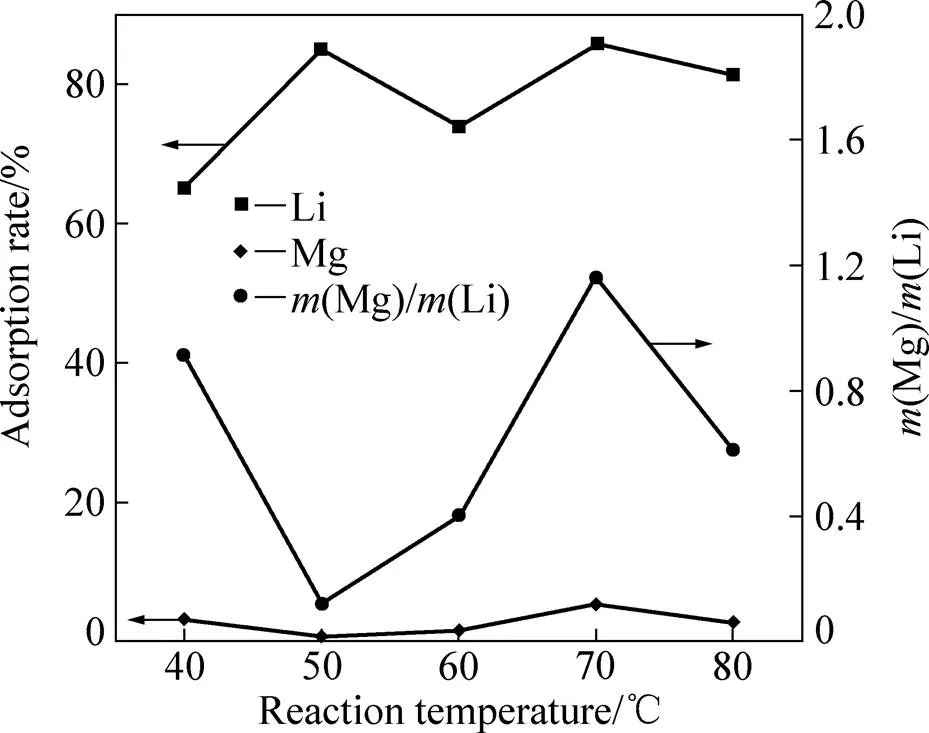
图5 水浸出反应温度对镁锂分离的影响
2.3.3 水浸出时间对镁锂分离的影响
将组成为6%Al-67%NaCl-2%LiCl-25%MgCl2(质量分数)粉末机械活化60 min后,然后与温度为50℃的水进行浸出,反应不同时间后的镁锂的吸附率以及沉淀中镁锂质量比的变化规律如图6所示。由图6可看出,随着反应时间的增加,锂的吸附率逐渐增加,于此同时对镁的吸附则轻微逐渐减低。这主要由于反应开始阶段,溶液中大量存在的镁会被吸附,随着反应时间的增加,由于生成的活性Al(OH)3对锂的选择性,之前被吸附的镁逐渐被锂取代。当反应达到2.0 h后,吸附沉淀中镁锂质量比达到最低值。但是随着反应时间的进一步增加,则出现锂的吸附率开始下降的现象。活性Al(OH)3都是呈现无定形的状态,因而具有较高的选择性。但是随着反应时间的延长,无定形的活性Al(OH)3都会趋向晶化,从而降低了对锂的吸附。但是在2.2节中,反应时间对锂的吸附没有明显影响。这可能与活性Al(OH)3所处的溶液环境不同有关系。随着反应时间进一步延长,沉淀中镁、锂质量比随之不断提高来看,因此,水浸出进行镁锂分离的时间不宜过长。另外,从试验结果来看,即便是反应时间只有1.0 h,锂的吸附率也可以达到70%,沉淀中镁、锂质量比就能从原始组成的20:1降低到只有0.8。
2.3.4 铝的加入量对镁锂分离的影响
为了考察铝的加入量对镁锂吸附分离效果的影响,将不同质量比的铝加入到混合盐中,同时控制混合盐中镁和锂的组成不变。经过机械活化60 min后,采用50℃的水进行浸出2.0 h后,镁锂的吸附率和沉淀中镁锂质量比随铝的加入量的变化规律如图7所示。由当铝的加入量为4%时,锂的吸附率只有56%。这主要是由于铝的加入量少无法满足对锂的高效率吸附。随着铝加入量的增加,锂的吸附率也随之逐渐提高。与此同时,沉淀中的镁铝质量比明显降低。当铝的加入量达到6%时,镁锂的分离效果最佳。但是随着铝的进一步增加,锂的吸附率出现明显的降低。这可能是由于更多的铝加入到混合盐中进行机械活化时,在一定时间内铝粉无法完全充分活化,由此导致铝粉水解产生活性Al(OH)3的反应进行的不彻底,最终将影响到对锂的吸附。由此可以推论,当加入更多铝粉时,可以通过强化机械活化过程来提高铝粉的活性,从提高对锂的吸附。从试验结果来看,当机械活化时间为60 min时,金属铝粉的加入量控制在6%左右比较合适。

图6 水浸出反应时间对镁锂分离的影响

图7 铝的加入量对镁锂分离的影响
3 结论
1) 采用盐湖卤水结晶产物氯化钾,氯化钠和氯化锂及其混合物均能通过机械球磨对铝进行活化。活化后的铝能快速与水反应生成氢气和活性氢氧化铝。
2) 通过NaCl和LiCl混合盐对铝进行活化,并采用水浸吸附提取其中的锂。通过控制合适的机械活化和水浸出条件,活性铝水解吸附提锂法能有效从混合盐中提取锂,锂的吸附率能达到96%。
3) 采用含有MgCl2和LiCl的混合盐活化铝并进行镁锂分离的研究。当6%的铝加入为镁锂质量比为20:1的混合盐中,机械活化时间为60 min后,采用50℃的水浸出活化后的物料2.0 h,锂的吸附率达到85%,而镁的吸附率仅为0.6%左右,所得吸附沉淀中镁铝质量比降低到0.12。
4) 采用含镁锂的混合盐直接活化铝然后水解,能有效实现镁锂分离。
[1] GROSJEANC, MIRANDA P H, PERRIN M, POGGI P. Assessment of world lithium resources and consequences of their geographic distribution on the expected development of the electric vehicle industry[J]. Renewable and Sustainable Energy Reviews, 2012, 16(3): 1735−1744.
[2] LI Z, HUANG J, LIAW B Y, METZLER V, ZHANG J B. A review of lithium deposition in lithium-ion and lithium metal secondary batteries[J]. J. Power Sources, 2014, 254: 168−182.
[3] 乜 贞, 卜令忠, 王云生, 宋彭生, 郑绵平. 盐湖卤水资源锂镁分离的工艺技术[J]. 无机盐工业, 2013, 45(5): 1−4. NIE Zhen, BU Ling-zhong, WANG Yun-sheng, SONG Peng-sheng, ZHENG Mian-ping. Industrial technology for separation of lithium from magnesium rich salt lake brines[J]. Inorganic Chemicals Industry, 2013, 45(5): 1−4.
[4] 徐 徽, 许 良, 陈白珍, 石西昌, 杨 鑫. 高镁锂比盐湖卤水镁锂分离工艺[J]. 中南大学学报(自然科学版), 2009, 40(1): 36−40. XU Hui, XU Liang, CHEN Bai-zhen, SHI Xi-chang, YANG Xin. Separating technique for magnesium and lithium from high Mg/Li ratio salt lake brine[J]. Journal of Central South University (Science and Technology), 2009, 40(1): 36−40.
[5] 吴荣学. 锂资源及Li2CO3产业的开发与利用[J]. 材料导报, 2012, 26(17): 36−39, 48.WU Rong-xue. The exploitation and utilization of lithium resources and Li2CO3industry[J]. Mater Rev, 2012, 26(17): 36−39, 48.
[6] LIU Xu-heng, CHEN Xing-yu, ZHAO Zhong-wei, LIANG Xin-xing. Effect of Na+on Li extraction from brine using LiFePO4/FePO4 electrodes[J]. Hydrometallurgy, 2014, 146: 24−28.
[7] ZHAO Z W, SI X F, LIU X H, HE L H, LIANG X X. Li extraction from high Mg/Li ratio brine with LiFePO4/FePO4as electrode materials[J]. Hydrometallurgy, 2013, 133: 75−83.
[8] 余疆江, 郑绵平, 伍 倩. 富锂盐湖提锂工艺研究进展[J]. 化工进展, 2013, 32(1): 13−21. YU Jiang-jiang, ZHEN Mian-ping, WU Qian. Research progress of lithium extraction process in lithium-containing salt lake[J]. Chemical Industry and Engineering Progress, 2013, 32(1): 13−21.
[9] 尹红军, 邓天龙, 李栋婵. 盐湖卤水资源锂镁分离提取的研究进展[J]. 无机盐工业, 2009, 41(5): 1−4. YIN Hong-jun, DENG Tian-long, LI Dong-chan. Progress on lithium and magnesium separation and recovery from the salt lake brines[J]. Inorganic Chemicals Industry, 2009, 41(5): 1−4.
[10] LIU Xu-heng, CHEN Xing-yu, HE Li-hua, ZHAO Zhong-wei. Study on extraction of lithium from salt lake brine by membrane electrolysis[J]. Desalination , 2015, 376: 35−40.
[11] ZHENG M P, LIU X F. Hydrochemistry and minerals assemblages of salt lakes in the Qinghai-Tibet Plateau, China[J]. Acta Geol Sinica, 2010, 84: 1585−1599.
[12] LI Jie, XIONG Xiao-bo. Current research status and prospect of extraction of lithium from salt lake brine with aluminium salt based sorbent[J]. Inorcanic Chemicals Industry, 2010, 42: 9−11.
[13] SOMRANI A, HAMZAOUI A H, PONTIE M. Study on lithium separation from salt lake brines by nanofiltration (NF) and low pressure reverse osmosis (LPRO)[J]. Desalination, 2013, 317: 184−192.
[14] MARYAM M, HENGAMEH H, MASOUD A, MOHAMMAD N. Hydrothermal synthesis and characterization of titanium dioxide nanotubes as novel lithium adsorbents[J]. Mater Res Bull, 2005, 61: 70−75.
[15] CHENG L S, DONG P D, JIA Y Z, YAN J. A highly efficient solvent system containing ionic liquid in tributyl phosphate for lithium ion extraction[J]. J Mol Liq, 2014, 200: 191−195.
[16] JEON W A, DONG J K, KHUYEN T T, MYONG J K, TUTI L, TAM T. Recovery of lithium from Uyuni salar brine[J]. Hydrometallurgy, 2012, 117/118: 64−70.
[17] ZHAO Zhong-wei, SI Xiu-fen, LIU Xu-heng, HE Li-hua, LIANG Xin-xing. Li extraction from high Mg/Li ratio brine with LiFePO4/FePO4as electrode materials[J]. Hydrometallurgy, 2013, 133: 75−83.
[18] SHI Xi-chang, ZHOU Ding-fang, ZHANG Zhi-bing, YU Liang-liang, XU Hui, CHEN Bai-zhen, YANG Xi-yun. Synthesis and properties of Li1.6Mn1.6O4 and its adsorption application[J]. Hydrometallurgy, 2011, 110(1/4): 99−106.
[19] 胡克鳌,刘洪章, 欧阳群, 张颖惠, 张国湘. 无定形氢氧化铝同溶液中氯化锂的相互作用[J]. 化学学报, 1976, 34(4): 253−260. HU Ke-ao, LIU Hong-zhang, OUYANG Chun, ZHANG Ying-hui, ZHANG Guo-xiang. Interreaction between amorphous aluminium hydroxide with lithium chloride in solution[J]. Acta Chimica Sinica, 1976, 34(4): 253−260.
[20] 黄师强, 崔荣旦, 张淑珍, 毕道洲, 孙邦宽, 王国莲, 杜云清, 李丽娟.一种从含锂卤水中提取无水氯化锂的方法: 中国专利, 8710343l[P]. 1987−11−04. HUANG Shi-qiang, CUI Rong-dan, ZHANG Shu-zhen, BI Dao-zhou, SUN Bang-kuan, WANG Guo-lian, DU Yun-qing, LI Li-juan. A method for extracting an hydrous LiCl from brine containing Li: China Patent, 8710343l[P]. 1987−11−04.
[21] 中国科学院青海盐湖所第五研究室. 同卤水中锂盐相作用的氢氧化铝的研究[J]. 盐湖研究, 1976(2): 33−45.Qinghai Institute of Salt Lakes 5st Research Team. Research of interreaction of aluminium hydroxide with lithium chloride in brine solution[J]. Journal of Salt Lake Research, 1976(2): 33−45.
[22] 肖小玲. 氢氧化铝沉淀法从卤水中提取锂的研究[D]. 西宁: 中国科学院青海盐湖研究所, 2005. XIAO Xiao-ling. Extracting lithium by precipitation of Al(OH)3from salt lake[D]. Xining: Qinghai Institute of Salt Lakes, Chinese Academy of Science Xining, 2005.
[23] EPSTEIN J A, FEIST E M, ZMORA J, MARCUS Y. Extraction of lithium from the dead sea[J]. Hydrometallurgy, 1981, 6: 269−275.
[24] WANG H, LEUNG D Y C, LEUNG M K H, NI M. A review on hydrogen production using aluminum and aluminum alloys[J]. Renewable and Sustainable Energy Reviews, 2009, 13(4): 845−853.
[25] FAN Mei-qiang, XU Fen, SUN Li-xia, ZHAO Jun-ning, JIANG T, LI Wei-xue. Hydrolysis of ball milling Al-Bi-hydride and Al-Bi-salt mixture for hydrogen generation[J]. Journal of Alloys and Compounds, 2008, 460(1/2): 125−129.
[26] CZECH E, TROCZYNSKI T. Hydrogen generation through massive corrosion of deformed aluminum in water[J]. Int J Hydrogen Energy, 2010, 35: 1029−1037.
[27] SAKINTUNA B, LAMARI-DARKRIM F, HIRSCHER M. Metal hydride materials for solid hydrogen storage: A review[J]. Int J Hydrogen Energy, 2007, 32(9): 1121−1140.
[28] MCCAFFERTY E. Semiconductor aspects of the passive oxide film on aluminum as modified by surface alloying[J]. Corrosion Science, 2003, 45(2): 301−308.
[29] KANG Ding-xue, SHEN Xiang-mu, WAN Xue-yuan. The adsorption of lithium onto alumina from solutions of mixed chlorides: Effects of temperature and electrolyte control[J]. J Chem Tech Biotechnol, 1981, 31: 683−687.
Activation of aluminum and separation of Mg and Li by its hydrolysis-adsorption
LI Yan-hong, JIANG Huai, LIU Chong-wu, CHEN Xing-yu, LIU Xu-heng, ZHAO Zhong-wei
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
In order to extract lithium from salt lake with high mass ratio of Mg to Li efficiently, the hydrolysis-adsorption method of activated aluminum was developed to extract Li from the crystallized product of salt lake brine with high mass ratio of Mg to Li. The mechanical activation effect of Al by adding KCl, NaCl and LiCl mixture was investigated. And the extraction of Li from the NaCl-LiCl mixed salt was also researched. The effect of mechanical activation and water leaching reaction on the Li adsorption was investigated. The mixed salt containing MgCl2and LiCl was used to activate Al and the separation of Mg and Li was also researched. The parameters effects of mechanical activation and Al hydrolysis on separation of Mg and Li were investigated. The results show that Al can be activated completely, and the activated Al can react with water to produce activated Al(OH)3rapidly. Through controlling appropriate parameter for mechanical activation and water leaching, Li can be extracted from NaCl-LiCl mixed salt by hydrolysis-adsorption of activated Al, and Li adsorption can reach 96%. When 6% Al is added into the mixed salt with Mg and Li mass ratio of 20:1 and activating time of 60min, and then the activated Al is leached at 50℃ for 2.0 h, the Li adsorption reaches 85% and Mg adsorption is only about 0.6%, and the Mg and Li mass ratio in adsorption precipitation decreases to 0.12. The above research results indicate that mixed salt containing Mg and Li can effectively activate Al and then achieve the separation of Mg and Li.
lithium; aluminum; magnesium; water leaching; adsorption; mechanical activation
Project (U1407137) supported by the National Natural Science Foundation of China; Project supported by Sheng Hua Yuying Program of Central South University, China
2018-01-26;
2018-03-30
CHEN Xing-yu; Tel: +86-731-88830476; E-mail: xychen@csu.edu.cn
1004-0609(2018)-04-0830-08
TF826.3
A
10.19476/j.ysxb.1004.0609.2018.04.22
国家自然科学基金资助项目(U1407137);中南大学升华育英计划项目
2018-01-26;
2018-03-30
陈星宇,副教授,博士;0731-88830476; E-mail:xychen@csu.edu.cn
(编辑 龙怀中)
