猪瘟疫苗微载体悬浮培养生产工艺试验
2018-06-11苏玮玮赵攀攀丁赫楠张秀华吕晓研张树成
苏玮玮,赵攀攀,丁赫楠,张秀华,么 亮,吕晓研,张树成,武 华
[华威特(江苏)生物制药有限公司,江苏 泰州 225300]
猪瘟(CSF)是由猪瘟病毒(CSFV)引起的一种高度接触性传染病。猪瘟病毒为黄病毒科瘟病毒属成员,病毒粒子呈球形,核衣壳为二十面体对称,为有囊膜的单股正链RNA病毒。急性猪瘟特征是急性败血症、实质器官出血、坏死和梗死;慢性猪瘟呈现纤维素性坏死性肠炎,后期常继发副伤寒及巴氏杆菌病。世界动物卫生组织(OIE)将其列为必须报告的动物疫病,我国将其列为一类动物疫病[1-2]。1833年美国俄亥俄州首次发现了猪瘟[3],1822年法国也有猪瘟暴发报告[4],1866年以前猪瘟在欧洲和美国广泛流行。日本首次暴发猪瘟是在1888年,随后是中国和印度。20世纪末猪瘟在全球许多地区仍然普遍流行,目前该病在美洲、欧洲、亚洲等国家和地区呈现复发趋势,一些已宣布消灭猪瘟的国家又见猪瘟复发的报道[5]。在我国虽然采取强制免疫措施,但该病仍在全国范围之内不间断的流行。
为了控制该病,接种安全和高效的疫苗十分重要。目前应用最广泛的是猪瘟弱毒活疫苗,毒株包括中国猪瘟兔化弱毒疫苗(C株)、日本GPE-疫苗和法国的 Thiverval疫苗。国内动物疫苗生产企业均采用的是猪瘟兔化弱毒疫苗(C株),生产工艺上大多还是采用传统转瓶方法,其缺点是费时费力、易污染、不稳定、抗原批间差大[6]。近年来,悬浮培养技术已在口蹄疫疫苗和禽流感疫苗中得到大规模应用,在CSFV培养中应用还不多,但采用微载体悬浮培养技术生产CSFV疫苗可以克服上述传统转瓶方法的不足。本研究应用生物反应器微载体悬浮培养BT细胞生产CSFV抗原,使用FAID50(半数荧光抗体感染剂量)方法测定病毒含量,试验结果报告如下。
1 材料与方法
1.1细胞与病毒 BT细胞(F11代),由中国兽医药品监察所保管和供应;毒种CSFV(F12代)由中国兽医药品监察所保管和供应。
1.2培养基及血清 MEM培养基,购自美国Hyclone公司;新生牛血清,购自兰州荣晔公司。
1.3抗体 抗猪瘟单克隆抗体,由华威特(江苏)生物制药有限公司提供;驴抗鼠荧光抗体,购自美国NOVEX公司。
1.4微载体 Cytodex 1,购自GE Healthcare Inc.
1.5生物反应器 BioFlo 310型生物反应器,最大工作体积分别为2 L和10 L,购自美国NBS生物工程公司。
1.6微载体预处理 取微载体(Cytodex 1),每克微载体用50 mL PBS(pH值7.2)缓冲液泡胀,更换PBS 3次后浸泡过夜,次日121℃灭菌30 min,更换无菌的新鲜培养基浸泡,备用[8]。
1.7转瓶细胞培养 将解冻的BT细胞1 000 r/min离心15 min后,除去上清加入含8%新生牛血清的MEM培养基重悬并接种至175 cm2培养瓶中,置37℃、含5%CO2细胞培养箱中培养。当细胞长成致密单层时,用0.25%胰酶/EDTA消化,传代至15 L转瓶中培养。
1.8确定BT细胞最佳接种密度 将处理好的微载体按照3 g/L比例加入到2 L含8%新生牛血清的MEM培养基中,而后无菌加入到2 L生物反应器中。 分别按1.0 ×105个/mg、1.5 ×105个/mg、2.0 ×105个/mg、2.5 ×105个/mg 细胞密度接种,设置生物反应器参数:温度37℃、pH值7.2、溶氧50%、转速45 r/min。培养24 h后取样,然后每12 h取样1次,镜下观察细胞生长情况并计数。
1.9BT细胞的微载体悬浮培养放大工艺验证采用确定的细胞培养工艺,用2 L反应器培养3批BT细胞,培养体积2 L,当细胞密度达到4.0×106个/mL以上时,用0.25%胰酶/EDTA 消化,按1∶5比例放大至10 L生物反应器进行培养。
1.10确定病毒最佳接种剂量 将处理好的微载体按照3 g/L浓度加入到2 L含8%新生牛血清的MEM培养基中,而后无菌加入到2 L生物反应器中,按1.5×105个/mg细胞密度接种。当细胞密度达到3.0×106个/mL时,更换含2% 新生牛血清的维持液,将 CSFV 分别按感染复数(MOI)0.2、0.5、0.8、1.2接种。接种后第5天开始收获培养上清液并留样10 mL用于测定病毒含量,以后每隔4 d收获并换液1次,连续收获5次。
1.11微载体悬浮培养工艺与转瓶培养工艺比较
1.11.1微载体悬浮培养工艺 采用确定的细胞培养工艺,用2 L反应器培养BT细胞,培养体积2 L,当细胞密度达到4.0×106个/mL以上时,用0.25%胰酶/EDTA消化,按1∶5比例放大至10 L生物反应器中。当细胞密度达到3.0×106个/mL时,更换含2%新生牛血清的维持液,将CSFV按MOI为0.5接种。接种后第5天开始收获培养上清液并留样10 mL用于测定病毒含量,以后每隔4 d收获并换液1次,连续收获5次。
1.11.2转瓶培养工艺 使用15 L转瓶,当细胞铺满单层时,更换含2%新生牛血清的维持液,将CSFV按MOI为 0.5接种,每瓶加入1 000 mL维持液。接种后第5天开始收获培养上清液并留样10 mL用于病毒含量测定,以后每隔4 d收获并换液1次,连续收获5次。
1.12病毒含量测定 病毒含量测定前2 d在96孔细胞培养板中繁殖BT细胞单层,当细胞单层达到板孔面积70%~80%时,用PBS洗涤细胞单层2次,将病毒样品10倍倍比稀释,将每个稀释样品加到细胞培养板的6个孔中,每孔100 μL,同时设阴性对照。细胞培养4 d后进行荧光染色FAID50,在荧光显微镜下观察细胞,有特异性荧光的孔判定为阳性,无特异性荧光的孔判定为阴性,结果用Spearman-Karber方法计算出FAID50病毒含量[8]。
2 结果
2.1BT细胞最佳接种密度 采用2 L生物反应器,分别按 1.0 × 105个/mg、1.5 × 105个/mg、2.0 ×105个/mg、2.5 ×105个/mg细胞密度接种,从图 1 细胞生长曲线可知,由于接种量不同,细胞生长密度差异明显。当起始接种密度为1.0×105个/mg时,细胞生长缓慢,培养时间长且最高细胞生长密度相对较低。当起始接种密度为2.0×105/mg和2.5×105个/mg时,细胞覆盖微载体面积相对快,但细胞死亡率高。起始接种密度为1.5×105/mg时,细胞培养72 h即可覆盖微载体面积的70% ~80%,且细胞状态良好。所以确定BT细胞最佳接种密度为1.5 ×105个/mg。
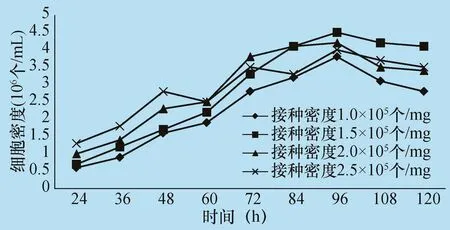
图1 BT细胞接种密度与生长细胞密度的关系
2.2BT细胞微载体悬浮培养放大工艺验证 以2 L生物反应器为种子反应器,经过4 d培养,BT细胞密度均可达到 4.0×106个/mL(第 1批:4.2×106个/mL、第2 批:4.1 ×106个/mL、第 3 批:4.5 ×106个/mL)。用胰酶消化法消化细胞,将消化的细胞作为种子细胞与灭菌的新鲜微载体吸附后继续在10 L生物反应器放大培养。经过3次重复试验,放大到10 L生物反应器培养的细胞其密度在96 h时均可达到4.0×106/mL以上(见图2)。
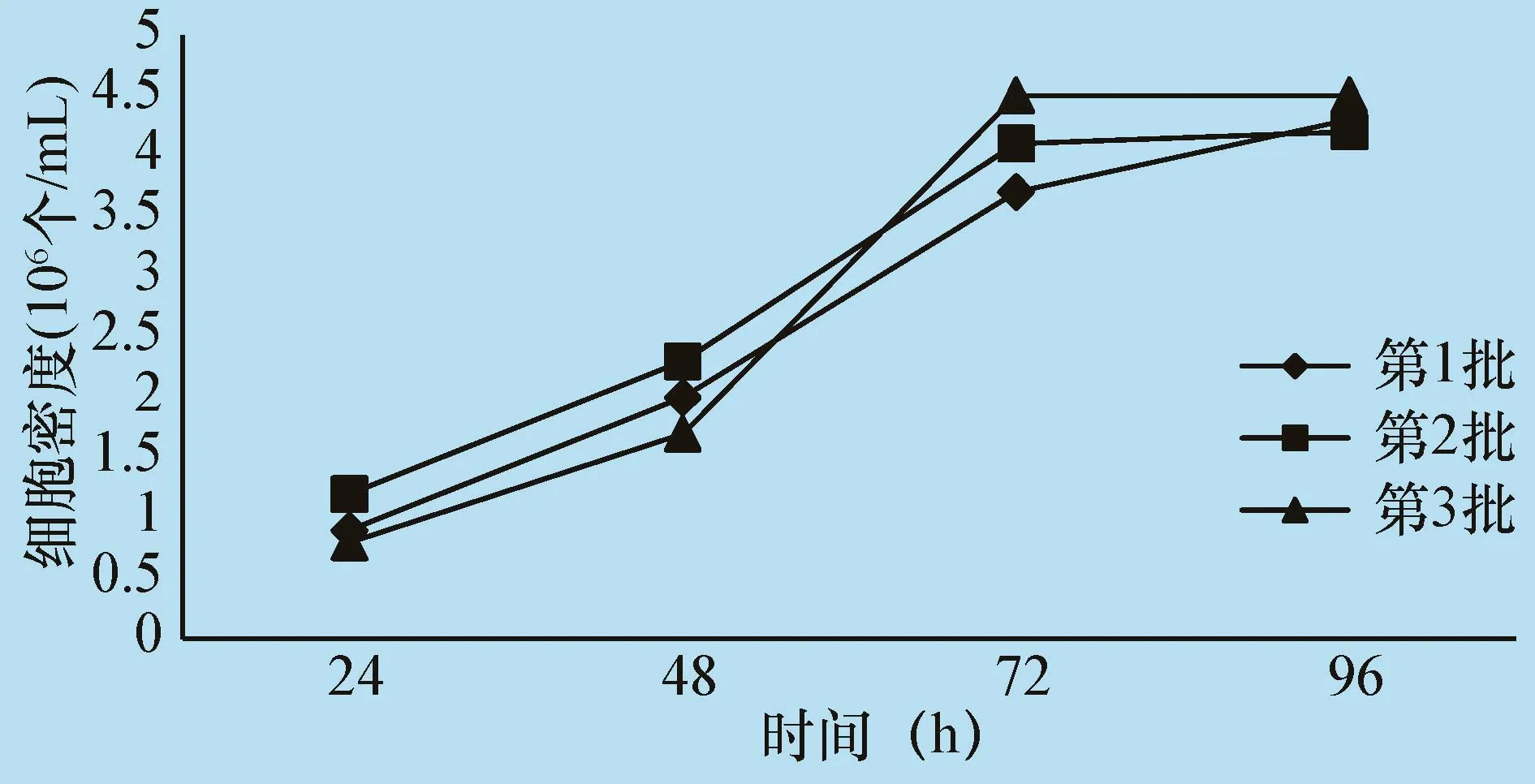
图2 3批BT细胞10 L生物反应器微载体悬浮培养结果
2.3确定病毒最佳接种剂量 当细胞密度达到3.0×106个/mL时,CSFV 感染复数(MOI)分别按0.2、0.5、0.8、1.2 接种。 由图 3 可知,当按 MOI为0.2接种时,收获的抗原病毒含量较低,说明接种的病毒量较少。 当 MOI为 0.5、0.8、1.2 时,收获的抗原病毒含量均≥106.8FAID50/mL,但相比较MOI为0.5时,抗原病毒含量最高,且初始接种量最低,所以确定最佳接种MOI为0.5。
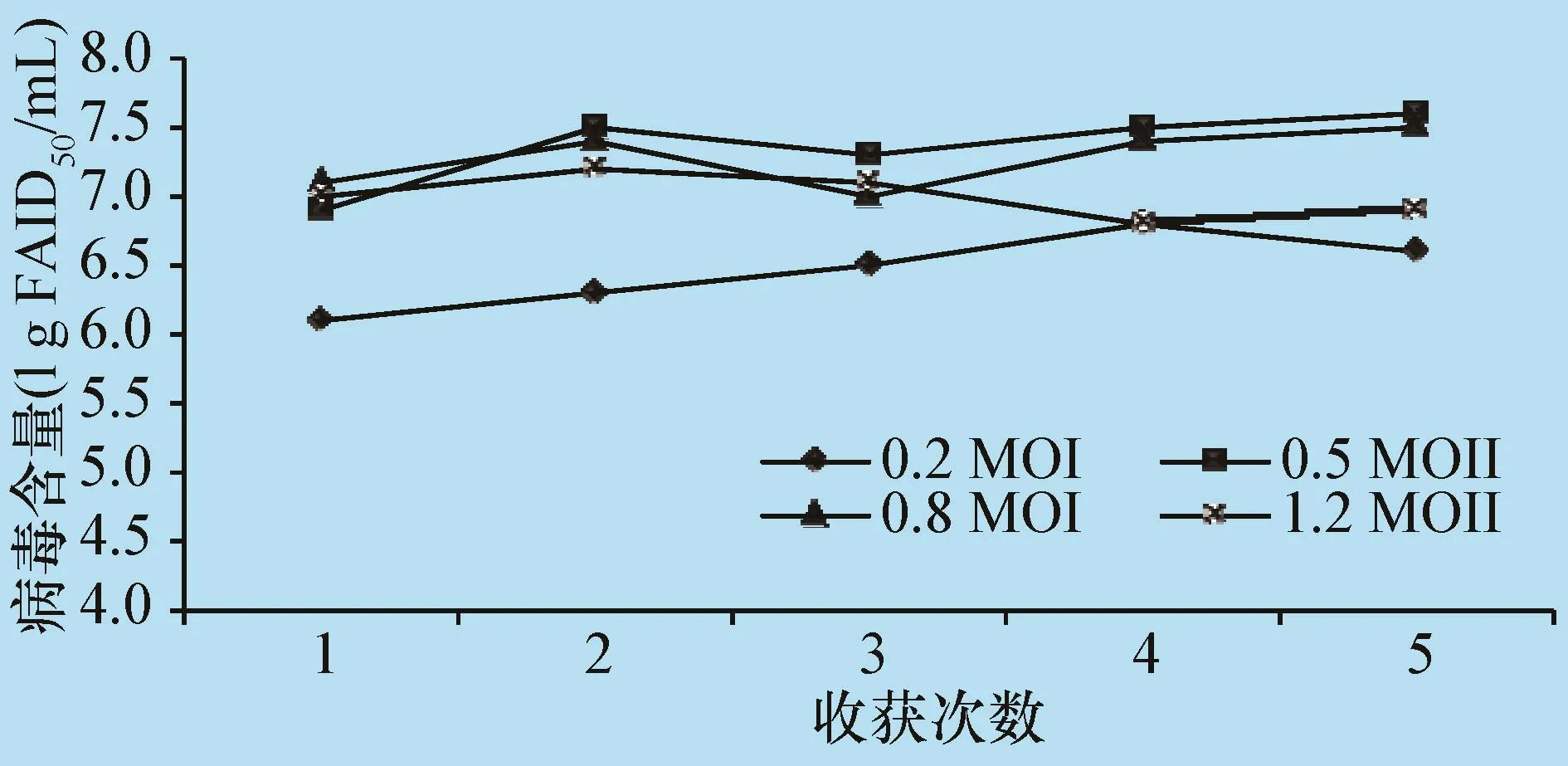
图3 CSFV生物反应器悬浮培养方式不同接种剂量与病毒含量的对比
2.4微载体悬浮培养工艺与转瓶培养工艺比较
转瓶培养和微载体悬浮培养的BT细胞,均接种病毒后第5天开始第1次收毒,此后每隔4 d进行再次收获换液,连续收获5次。对比收获的抗原病毒含量,结果表明,微载体悬浮培养的CSFV病毒含量约是转瓶生产的15倍(见图4),生物反应器收获1 L病毒液的产量相当于15个转瓶的产量。
图4 CSFV微载体悬浮培养与转瓶培养生产方式抗原病毒含量对比
3 讨论
近年来的国内调查和监测结果显示,非典型猪瘟特别常见,发病率和死亡率虽然偏低,但病程延长,多存在隐性感染和持续感染,造成CSFV在猪群内水平传播、垂直传播,同时会继发其他细菌类疾病[9]。接种疫苗仍然是预防猪瘟的最佳手段,所以提升猪瘟疫苗质量至关重要。中国的猪瘟兔化弱毒疫苗(C株)是国际上公认的安全性和免疫原性最好的疫苗株[10],国内相对应的主要产品有猪瘟活疫苗(细胞源)、猪瘟活疫苗(传代细胞源)、猪瘟活疫苗(脾淋源)、猪瘟活疫苗(兔源)。根据2016年国内猪瘟活疫苗批签发数据统计显示,年累计批签发猪瘟弱毒活疫苗约34.9亿头份,其中猪瘟活疫苗(细胞源)占48.02%;猪瘟活疫苗(传代细胞源)占24.59%;猪瘟活疫苗(脾淋源)占 20.77%;猪瘟活疫苗(兔源)占 6.62%。其中细胞源的产品占72.61%,仍是市场主导,但其质量决定因素在于抗原的有效病毒含量及抗原与成品的效力评定方法的可靠性。
本试验基于BT细胞悬浮培养工艺优化的基础上开展CSFV的病毒悬浮培养工艺优化及与转瓶培养工艺的对比。试验结果显示,在3 g/L微载体浓度下,采用1.5×105个/mg的细胞初始接种密度,细胞培养72 h可获得最佳细胞密度;MOI为0.5时CSFV抗原从第1次收获到第5次收获病毒含量均高于106.8FAID50/mL;细胞从2 L到10 L生物反应器的5倍消化放大工艺验证获得比较稳定的试验结果;悬浮培养工艺增殖的CSFV病毒含量约是转瓶培养工艺的15倍,且相比转瓶培养工艺批间稳定。以上结果说明,CSFV可实现生物反应器规模化生产,且相比转瓶培养工艺有明显优势。试验中的CSFV均采用FAID50(半数荧光抗体感染剂量)进行病毒含量测定。FAID50测定是指应用免疫荧光方法对病毒半数组织感染量进行测定的一种方法,中华人民共和国第2270号公告已在《高致病性猪繁殖与呼吸综合征、猪瘟二联活疫苗(TJM-F92株+C株)制造及检验试行规程》中确认FAID50为猪瘟疫苗效力检验方法之一,使本次试验的CFSV的病毒含量数据更加精准可靠。
目前动物细胞大规模悬浮培养已成为生物制药领域最重要的关键技术之一,是国内外生物制品企业疫苗工艺方向的首选。本次试验采用的是微载体悬浮培养工艺,相对转瓶培养的优点是表面积大、细胞产量高、质量均一、病毒效价高、污染机会少[11],并且培养一次的收获体积大于多次转瓶的生产量,其结果是提高了生产效率,确保了产品的均一性与稳定性。但微载体悬浮培养与纯悬浮培养相比,成本较高,细胞消化放大工艺难度大,目前国内还没有CSFV纯悬浮方面研究的报道。商业化猪瘟细胞苗多采用牛睾丸原代细胞、猪睾丸传代细胞(ST)转瓶工艺,CSFV微载体悬浮工艺的疫苗已有科研单位处于新兽药申报阶段,希望本次试验数据能为后续的猪瘟疫苗工艺提升奠定基础。
