神经生长因子对胫骨骨折患者内固定术后愈合及骨密度影响
2018-06-09史永涛
曹 博,史永涛,行 军
延安大学附属医院 关节外科,陕西 延安 716000
胫骨骨折一般由车祸、运动拉伤、高处坠落等高能量或暴力损伤引起,约占全身骨折的10%。胫骨表面软组织薄弱、局部软组织血供差,患者骨折后常合并严重的软组织挫伤和创面污染,且其髓内滋养动脉断裂,常导致骨折延迟愈合、不愈合、皮肤感染等并发症,严重者危及生命[1]。切开复位内固定术是目前临床治疗胫骨骨折的主要方法,但部分患者在术后常因骨折不易愈合或延迟愈合而需行二次手术,且由此引发的并发症严重影响了患者的身心健康与生活质量[2]。神经生长因子(nerve growth factor,NGF)可提高骨痂组织中的胶原蛋白含量、上调骨形态发生蛋白表达及增强骨折区生物力学性能,从而促进骨折愈合[3]。本研究探讨胫骨骨折患者内固定术后应用NGF对骨折愈合效果及骨密度的影响,旨在为临床有效促进骨折愈合,尽快消除疼痛及增加骨折区骨密度,从而促进功能恢复提供更好方案,现报道如下。
1 资料与方法
1.1 一般资料 选取自2012年1月至2016年7月延安大学附属医院关节外科收治的50例行切开复位内固定术治疗的胫骨骨折患者为研究对象,根据术后治疗方式不同分为常规组(n=25)和联合组(n=25)。纳入标准:(1)年龄18~65岁;(2)有明确的的高能量损伤或暴力损伤史;(3)符合《实用骨科学》[4]中胫骨骨折诊断标准;(4)符合胫骨开放性骨折及Gustilo 分型标准[5];(5)身体素质良好能接受内固定术治疗,依从性好并积极配合随访及术后评分工作。排除标准:(1)合并心、肾功能不全、肝功能障碍、精神疾病者;(2)合并血管损伤者;(3)有闭合复位禁忌证者;(4)合并有类风湿性及风湿性关节炎者;(5)陈旧性骨折,骨折后伴有脂肪栓塞、发生休克及颅脑损伤者;(6)对NGF过敏者;(7)哺乳期妇女或孕妇;(8)随访资料不完善者。常规组:男性16例,女性9例;年龄29~64岁,平均年龄(58.77±8.16)岁;受伤至手术时间0.5~8.0 d,平均受伤至手术时间(4.25±1.95) d;骨折原因交通事故13例,重物击伤6例,高空坠落4例,意外骨折2例;Gustilo分型Ⅰ度3例,Ⅱ度12例,Ⅲa度9例,Ⅲb度1例;合并糖尿病2例,高血压4例,心脏系统疾病2例。联合组:男性15例,女性10例;年龄33~62岁,平均年龄(55.50±5.48)岁;受伤至手术时间0.5~9.0 d,平均受伤至手术时间(4.33±2.03) d;骨折交通事故14例,重物击伤5例,高空坠落5例,意外骨折1例;Gustilo分型Ⅰ度3例,Ⅱ度10例,Ⅲa度11例,Ⅲb度1例;合并糖尿病4例,高血压4例,心脏系统疾病2例。两组性别、年龄、骨折原因、骨折分型、合并疾病等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,患者均签署知情同意书。
1.2 治疗方法 两组患者术后均常规使用抗生素48 h,并配合抬高患肢、持续被动活动(continuous passive motion,CPM)机辅助早期功能锻炼,使用甘露醇、前列地尔消肿。联合组患者在此基础上应用NGF治疗,皮肤消毒后在局麻状态下穿刺骨折断端及其周围骨膜,采用NGF生物药品制剂注射用鼠NGF[舒泰神(北京)生物制药股份有限公司生产,国药准字S20060023]30 μg溶解于90%氯化钠注射液局部注射,1次/d,4周为1疗程,治疗1~2个疗程。
1.3 疗效评价 参照Johner-Wruhs胫骨骨折疗效标准[6]评定,主要包括膝踝关节活动度、疼痛及日常活动受限程度等,分别于术后12个月按优、良、中、差进行评估。
优良率=(优+良)例数/总例数×100%
1.4 观察指标 记录并比较两组患者骨折愈合效果。骨折愈合时间:以X线提示骨折线模糊,连续观察两周骨折处无变形,无扶拐支持可连续步行3 min(≥30步)为准;疼痛消失时间:采用疼痛视觉模拟评分(visual analogue scale of pain,VAS)法评估,以VAS评分≤3分为疼痛消失;骨密度:应用XR800型双线骨密度测定仪分别于术前,术后6个月、12个月检测骨折区骨密度。
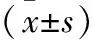
2 结果
2.1 两组患者治疗效果比较 联合组临床疗效优11例、良11例、中3例,优良率为88.0%(22/25),常规组优8例、良9例、中6例、差2例,优良率68.0%(17/25),两组优良率比较,差异无统计学意义(P>0.05)。
2.2 两组患者骨折愈合效果比较 与常规组比较,联合组骨折愈合时间、疼痛消失时间显著缩短,差异均有统计学意义(P<0.05)。见表1。

表1 两组患者骨折愈合效果比较时间/d)
2.3 两组患者术前、术后骨折区骨密度变化比较 两组患者术前骨折区骨密度比较,差异无统计学意义(P>0.05);两组患者术后6个月骨密度均显著升高,与术前比较,差异均有统计学意义(P<0.05);联合组术后12个月骨密度较术后6个月显著升高(P<0.05),而常规组术后12个月骨密度较术后6个月升高不明显(P>0.05);且联合组术后6个月、12个月骨折区骨密度均显著高于常规组(P<0.05)。见表2。

表2 两组患者术前、术后骨折区骨密度变化比较
注:与本组术前比较,①P<0.05;与术后6个月比较,②P<0.05
3 讨论
骨折愈合是骨折术后重点关注的问题之一,受多种复杂因素影响。因切开复位内固定术具有复位效果好、对骨折块与周围组织损伤小的优点而被广泛采用,但患者术后可能存在骨折愈合问题,而骨折愈合情况判定对指导临床康复治疗有重要意义[7]。冯阳阳等[8]指出,成人胫骨骨折愈合效果主要体现在术后骨折愈合时间及骨折区疼痛显著缓解时间。同时,骨密度作为骨质量的重要衡量指标,对胫骨骨折患者术后运动功能恢复起到重要作用。
NGF作为神经系统中一类重要的活性因子,是一种具有促进神经生长作用的生物活性复合蛋白,故临床上经常被用作神经保护剂、神经营养剂、神经再生剂[9]。NGF不仅有促进中枢、外围神经元生长和神经损伤修复的效果,而且在非神经组织中也起着重要的作用,如促进新生骨形成,加速骨折愈合过程等[10]。有研究报道,在正常骨组织与骨折骨痂中均存在NGF及其受体表达,局部增加NGF浓度可明显促进骨痂生长[11]。刘宇涛等[12]指出,NGF具有较强的促进骨折愈合作用,在骨折早、中、晚期均可以有效缩短骨折愈合时间和提高愈合质量。近年来,有研究表明,NGF对骨折的修复作用机制体现在诸多方面:(1)纤维长入骨组织以增加骨折部的神经支配,刺激血管生成和局部血供增加;(2)刺激骨细胞增殖分化和多种神经肽的生成,通过旁分泌或内分泌因子直接或间接促进骨母细胞分化,从而促进骨愈合、再生;(3)调节维生素的摄取过程,增强成骨细胞的成骨作用;(4)提高局部骨密度,促使成骨细胞发生磷酸化过程,增强成骨细胞活性[13-14]。
本研究治疗后,联合组内固定术后应用NGF骨折愈合时间、疼痛消失时间显著短于常规组,NGF可明显促进患者骨折尽快愈合并消除疼痛。两组术后6个月骨密度均显著升高,与术前相比,联合组术后12个月骨密度较术后6个月显著升高,而常规组12个月骨密度较术后6个月升高不明显,且联合组术后6个月、12个月骨折区骨密度均显著高于常规组。NGF对提高患者骨折区骨密度有重要作用。临床疗效方面,联合组的优良率为88.0%,高于常规组的68.0%,但差异不显著,可能与两组患者数量较少及个体化差异有关,但仍可认为NGF治疗可提高胫骨骨折的临床疗效,与赵重熙等[15]观点相符。同时,NGF具有特异高效安全、无抗体产生、极少不良反应的特点,且经皮局部注射操作简单、创伤轻微,临床价格相对低廉、患者依从性较好[16]。
综上所述,在胫骨骨折切开复位内固定术后应用NGF
治疗,可促进患者骨折愈,增加骨折区骨密度,从而改善临床疗效并提高患者生活质量。
参考文献:
[1] 肖 容.不同筋膜皮瓣在胫骨骨折伴软组织缺损修复中的应用[J].医学临床研究,2016,33(1):54-56.
[2] 王兴山,唐杞衡,杜 辉,等.人工全膝关节置换术治疗胫骨平台骨折内固定术后创伤性关节炎回顾性研究[J].临床军医杂志,2016,44(4):353-356.
[3] 刘建军,黄 亮,韩庆斌,等.神经生长因子对大鼠胫骨骨折愈合的影响及其机制[J].山东医药,2016,56(32):27-29.
[4] 胥少汀,葛宝丰,徐印坎.实用骨科学[M].北京:人民军医出版社,2012:1011.
[5] 蒋继亮,王 飞,周 强,等.外固支定架在Gustilo Ⅲ型胫腓骨开放性骨折分期治疗中的应用[J].中华创伤骨科杂志,2013,15(4):367-368.
[6] 陈 劲,钟 华,马肃霜,等.微创钢板接骨技术下锁定加压接骨板与动力加压钢板内固定治疗胫骨远端骨折的疗效比较[J].广东医学院学报,2015,33(3):304-306.
[7] 龚 龙.手术切开双钢板夹持内固定对C型胫骨平台骨折患者膝关节功能和术后并发症的影响[J].临床军医杂志,2015,43(9):98-100.
[8] 冯阳阳,刘向栋,武 政,等.微创钢板接骨术联合高压氧治疗成人胫骨骨折疗效观察[J].海南医学,2016,27(13):2201-2203.
[9] Grills BL,Schuijers JA.Immunohistochemical localization of nerve growth factor in fractured and unfractured rat bone[J].Acta Orthop Scand,1998,69(4):415-419.
[10] 何 畔,常 磊,王愉思.糖尿病兔骨折愈合过程中神经生长因子及血小板衍生生长因子-A的表达[J].广东医学,2014,35(19):2999-3001.
[11] 赵书英,张万强,耿选朝,等.实验性胫骨骨折愈合过程中的X线表现与骨密度、骨灰重及钙磷元素、病理学变化的相关性分析[J].中国临床医学影像杂志,2015,26(10):736-739.
[12] 刘宇涛,黄潮桐,陈隆福,等.鼠神经生长因子治疗胫骨骨不连效果的实验研究[J].中国临床解剖学杂志,2016,34(3):326-330.
[13] 刘宇鹏,赵德伟,王卫明,等.神经生长因子对骨折愈合中骨形态发生蛋白表达的影响[J].中华医学杂志,2014,94(23):1825-1828.
[14] Rapp AE,Kroner J,Baur S,et al.Analgesia via blockade of NGF/TrkA signaling does not influence fracture healing in mice[J].J Orthop Res,2015,33(8):1235.
[15] 赵重熙,马 军,何 宁,等.局部应用神经生长因子对周围神经损伤后骨折早期愈合的影响[J].中国组织工程研究,2015,19(15):2320-2324.
[16] 张宏亮,黄振光,温 燕,等.鼠神经生长因子对骨折愈合影响的循证评价[J].中国生化药物杂志,2015,35(5):72-76.
(收稿日期:2017-11-08)
