细胞凋亡因子表达与神经系统变性疾病相关性研究
2018-06-09胡瑾
胡 瑾
河北北方学院附属第一医院 神经内三科,河北 张家口 075000
神经系统变性疾病(neurodegenerative diseases,NDD)是以一组原因不明的以神经元变性为基础的慢性进展性神经系统疾病,包括帕金森病(Parkinson′s disease,PD)、肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)、亨廷顿舞蹈病(Huntington′s disease,HD)和阿尔茨海默病(Alzheimer′s disease,AD)等,严重威胁着人们的身体健康[1]。目前,NDD发病机制尚未完全明确,探讨发病机制对疾病防治有重要意义[2]。Trim27不仅可参与炎性反应、细胞周期、肿瘤细胞迁移,还可促进细胞凋亡[3];P38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、c-jun氨基末端激酶(c-jun N-terminal kinase,JNK)是MAPK家族的重要成员,可通过调节和阻断关键的信号调节细胞凋亡[4-5]。目前,Trim27、P38MAPK、JNK与NDD发生关系的研究报道尚少。本研究通过比较NDD患者和健康人群Trim27、P38MAPK、JNK的变化,探讨Trim27、P38MAPK、JNK与NDD发生的关系,以期为临床治疗NDD提供新的有效治疗靶点。现报道如下。
1 资料与方法
1.1 一般资料 选取2017年1—12月在河北北方学院附属第一医院神经内三科住院的NDD患者100例设为NDD组,AD的诊断参照美国国立老化研究所与阿尔茨海默病协会诊断指南协作组推荐的AD诊断标准[6],PD的诊断参照中国帕金森病的诊断标准(2016版)[7]提出的诊断标准。其中,男性38例,女性62例;年龄60~82岁,平均(69.71±3.18)岁;AD患者59例,临床痴呆量表(clinical dementia rating,CDR)评分≤2分, PD患者41例。选取年龄、性别相匹配的同期健康体检者100例作为健康组,其中,男性42例,女性58例,平均年龄(67.98±3.51)岁。两组患者性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。排除标准:(1)严重心、肝、肾及其他全身性系统性疾病;(2)近期有重大手术、外伤史;(3)遗传病史;(4)恶性肿瘤;(5)精神系统疾病;(6)病例资料不完整。
1.2 研究方法
1.2.1 外周血采集 所有研究对象均行空腹静脉采血,用EDTA-K2抗凝管(2 ml)收集,离心10 min,分离血浆,-70℃保存。
1.2.2 Western blot检测方法 采用Western blot技术检测Trim27、P38MAPK、JNK在PBMC中的表达:(1)分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。血样标本去血浆后形成浓缩血液,等体积1 640培养液稀释,先于50 ml离心试管内倒入15 ml淋巴细胞分离液,再加入稀释后血液,使其保持分层状态,2 500 r/min离心30 min,吸除上清液使液面至白细胞团上2 cm处,剩余换至新的离心试管中,加入1 640培养液至45 ml。1 600 r/min离心5 min,吸除上清液,加1 640培养液使重悬细胞后,再加入1 640培养液至45 ml,1 600 r/min离心5 min,吸除上清液,获得PMBC。(2)PBMC蛋白提取。取PBMC细胞5×106个/ml,加入裂解缓冲液(RIPA缓冲液)5 ml,搅拌均匀,加入100 μl的蛋白上样裂解液,处理样品后,用SDS-聚丙烯酰胺凝胶电泳。采用湿转法转膜,取出胶后放入盛有转膜缓冲液的培养液中,剪裁与胶大小一致的聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,将其在甲醇中浸泡3~5 min,激活活性成分,再与滤纸一起泡入转膜液,按照三层“滤纸-胶-膜-三层滤纸”顺序转膜。转膜成功后用膜用TBST缓冲液漂洗,浸泡于含5%脱脂牛奶的TBST缓冲液中,室温下轻摇孵育1 h。加入一抗,分别加入兔来源Trim27、P38MAPK、JNK、P-P38MAPK、P-JNK单克隆一抗(美国Cell signaling公司),Trim27、P38MAPK、JN的稀释比例为1∶1 000,P-P38MAPK、P-JNK稀释比例为1∶500,GAPDH稀释比例为1∶10 000。一抗孵育结束后,TBST漂洗膜3次,每次5~10 min。分别加入二抗:羊抗兔稀释比例1∶5 000,室温下轻摇孵育1h,二抗孵育结束后TTBS漂洗膜3次,每次5~10 min。使用辣根过氧化物酶HRP-ECL发光法,将底物A、B液等比例稀释混合后,加入用保鲜膜封好的PVDF膜中,暗房显影,观察Trim27、P38MAPK、JNK蛋白总的表达量及P38MAPK、JNK磷酸化形式(P-P38MAPK、P-JNK)表达量(用灰度值比值表示)。Trim27灰度值比值=Trim27灰度值/GAPDH灰度值。
P-P38MAPK灰度值比值=P-P38MAPK灰度值/P38MAPK灰度值
P-JNK灰度值比值=P-JNK灰度值/JNK灰度值
2 结果
2.1 NDD组与健康组Trim27、P38MAPK、JNK表达水平比较 NDD组和健康组患者P38MAPK、JNK表达水平比较,差异无统计学意义(P>0.05),而NDD组患者Trim27表达水平高于健康组,差异有统计学意义(P<0.05)。见表1。
表1 NDD组与健康组Trim27、P38MAPK、JNK表达水平比较
2.2 NDD组与健康组P-P38MAPK、P-JNK表达水平比较 NDD组患者P-P38MAPK、P-JNK表达均明显高于健康组,差异均有统计学意义(P<0.05,表2)。
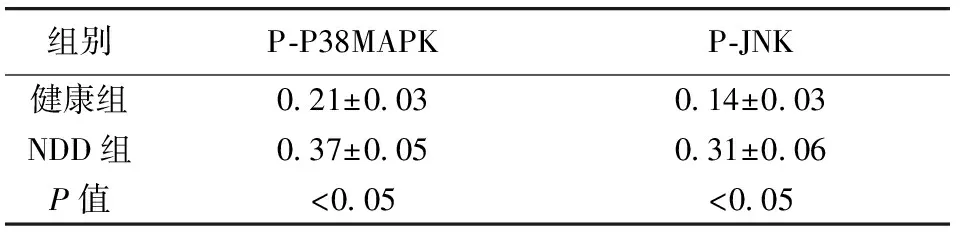
表2 NDD组与健康组P-P38MAPK、P-JNK表达水平
3 讨论
NDD是一组以原发性神经元变性为基础的慢性进行性神经系统疾病,可能为神经组织在演化、发育、成熟等过程中出现的分子生物障碍,常见的疾病类型包括AD、PD等,具有病程长、致残率高的特点,严重影响患者的生活能力[8]。目前,NDD的发病机制尚未完全明确,也缺乏有效的预防、根治手段。因此,探讨NDD发病机制,一直是国内外热点研究问题。
研究发现,细胞凋亡可能参与NDD发生[9-10]。Trim27最初是作为RET基因(编码细胞膜受体酪氨酸激酶的基因)的融合伴侣而被确认,其属于Trim家族的一员,既往关于Trim27的研究多集中在肿瘤方面,但其调控炎性反应、细胞凋亡的作用也不容忽视[11-12]。研究发现,AD患者脑中存在炎症反应,且炎性反应是NDD细胞凋亡的机制之一[13],Trim27对炎症信号通路起负性调节作用,可能参与NDD发生。Trim27不仅可直接调控细胞凋亡,还可通过提高P53稳定性及促进PKB的蛋白酶体降解增强电离辐射等途径诱导细胞凋亡[14]。本研究结果显示,NDD患者Trim27表达水平明显高于健康组,这一结果说明Trim27可能参与NDD患者细胞凋亡。
MAPK在哺乳动物细胞内广泛表达,MAPK信号通路可在多种受体信号传导途径中发挥关键作用,参与基因表达调控、细胞生长等一系列病理生理过程。JNK通路、P38MAPK通路是MAPK诸多通路中参与调节细胞凋亡的重要通路[15-16]。MAPK通常由细胞因子、生理应激反应、渗透压变化等激活,激活途径可能为细胞受刺激后,首先MAPKKK被磷酸化,继而由磷酸化激活MAPKK(对P38有较高的特异性),激活的磷酸化MAPKK再通过苏氨酸、酪氨酸双位点的磷酸化激活JNK、P38MAPK[17]。目前,关于被激活的JNK、P38MAPK调控细胞凋亡机制尚未完全明确,其中,JNK介导细胞凋亡的机制可能为活化转录因子Elkl、参与线粒体介导的细胞凋亡通路,P38MAPK可能通过作用于下游的Caspase诱导细胞凋亡[18]。本研究结果显示,NDD患者P38MAPK、JNK表达水平与健康组比较无显著差异(P>0.05),但其活化形式P-P38MAPK、P-JNK水平较健康组显著升高,这一结果说明,P38MAPK、JNK活化形式高表达可能参与NDD发生、发展过程。Jha 等[19]指出,P38MAPK通路、JNK通路异常可能引起PD患者大脑促凋亡和抗凋亡失衡。本研究中,AD和PD患者Trim27、P-P38MAPK、P-JNK表达水平无明显差异(P>0.05),考虑细胞凋亡可能是AD和PD重要发病机制,Trim27、P-P38MAPK、P-JNK表达异常并非由某一种疾病导致,可能存在于多种NDD中。
综上所述,与健康人群比较,NDD患者外周血Trim27、P-P38MAPK、P-JNK表达水平均显著增高,其调控的细胞凋亡可能参与NDD发生、发展过程。
参考文献:
[1] Pellacani C,Costa LG.Role of autophagy in environmental neurotoxicity[J].Environ Pollut,2018,235:791-805.
[2] Gao Z,Shan J,Wang B,et al.DRAM is involved in regulating nucleoside analog-induced neuronal autophagy in a p53-independent manner[J].Mol Neurobiol,2018,55(3):1988-1997.
[3] 孟易禹,王 雪,黄栋栋,等.沉默TRIM27基因对鼻咽癌5-8F细胞增殖、侵袭与迁移的影响[J].中国病理生理杂志,2017,33(1):53-59.
[4] Utaipan T,Athipornchai A,Suksamrarn A,et al.Isomahanine induces endoplasmic reticulum stress and simultaneously triggers p38 MAPK-mediated apoptosis and autophagy in multidrug-resistant human oral squamous cell carcinoma cells[J].Oncol Rep,2017,37(2):1243-1252.
[5] 王而强,何 凡,吕 彦,等.海湾战争综合征模型大鼠海马VGF、BDNF及MAPK表达研究[J].临床军医杂志,2017,45(3):234-240.
[6] Jack CR Jr,Albert MS,Knopman DS,等.美国国立老化研究所与阿尔茨海默病协会诊断指南写作组:对阿尔茨海默病诊断指南的推荐和介绍[J].中华神经科杂志,2012,45(5):332-335.
[7] 中华医学会神经病学分会帕金森病及运动障碍学组.中国帕金森病的诊断标准(2016版)[J].中华神经科杂志,2016,49(4):268-271.
[8] Molasy M,Walczak A,Szaflik J,et al.MicroRNAs in glaucoma and neurodegenerative diseases[J].J Hum Genet,2017,62(1):105-112.
[9] 时 婧,左瑞菊,韩永杰,等.丁苯酞软胶囊联合依达拉奉注射液治疗脑梗死疗效及对血清神经营养因子与炎症反应影响[J].临床军医杂志,2017,45(12):1297-1299.
[10] 李燕新,王全全,吕占云,等.酪氨酸激酶结合蛋白在阿尔茨海默病中的作用研究[J].中国临床实用医学,2017,8(6):99-101.
[11] 孟易禹,王 雪,黄栋栋,等.沉默TRIM27基因对鼻咽癌5-8F细胞增殖、侵袭与迁移的影响[J].中国病理生理杂志,2017,33(1):53-59.
[12] 薛 栋,王 妮,徐怀勇,等.TRIM59、Twist及E-cadherin在肝癌中的表达及临床意义[J].实用医学杂志,2017,33(9):1453-1456.
[13] 庄文欣,刘宗昱,王雪净,等.血管活性肠肽对帕金森病大鼠黑质胶质细胞活化及相关炎性因子释放的影响[J].解剖学报,2016,47(2):178-184.
[14] Ma Y,Wei Z,Bast RC Jr,et al.Downregulation of TRIM27 expression inhibits the proliferation of ovarian cancer cells in vitro and in vivo[J].Lab Invest,2016,96(1):37-48.
[15] Checker R,Gambhir L,Sharma D,et al.Plumbagin induces apoptosis in lymphoma cells via oxidative stress mediated glutathionylation and inhibition of mitogen-activated protein kinase phosphatases (MKP1/2)[J].Cancer Lett,2015,357(1):265-278.
[16] Agrawal M,Bhaskar AS,Lakshmana Rao PV.Involvement of mitogen-activated protein kinase pathway in T-2 toxin-induced cell cycle alteration and apoptosis in human neuroblastoma cells[J].Mol Neurobiol,2015,51(3):1379-1394.
[17] Kim ME, Na JY, Lee JS.Anti-inflammatory effects of trans-cinnamaldehyde on lipopolysaccharide-stimulated macrophage activation via MAPKs pathway regulation[J].Immunopharmacol Immunotoxicol,2018,40(3):219-224.
[18] 卢根林,吴爱兵,王宏宾.H2S通过MAPK信号通路影响缺血再灌注损伤大鼠回肠上皮细胞凋亡[J].中国病理生理杂志,2016,32(4):691-695.
[19] Jha SK,Jha NK,Kar R,et al.p38 MAPK and PI3K/AKT signalling cascades in Parkinson′s disease[J].Int J Mol Cell Med,2015,4(2):67-86.
(收稿日期:2018-03-20)
