乳酸克鲁维酵母常温常压等离子体诱变选育及其突变株整细胞催化特性
2018-06-08郭金玲吕育财余华顺龚大春
曹 纲,刘 云,郭金玲,吕育财,余华顺,龚大春*
(1.三峡大学 生物催化重点实验室,湖北 宜昌 443002;2.安琪酵母股份有限公司 酶制剂事业部,湖北 宜昌 443002)
手性苯乙醇是合成β2受体激动剂R-沙丁胺醇(R-salbuamol)、R,R-福莫特罗(R,R-formoterol)和R-沙美特罗(R-salmeterol),β2受体激动剂R-异丙肾上腺类和R-地诺帕明R-denopamine)等手性药物的关键中间体[1]。这些手性药物是临床中治疗哮喘、心律失常和心力衰竭等疾病的有效药物,但过去主要采用化学拆分[2]和化学不对称方法[3]制得,存在生产条件苛刻、收率低、对应选择性不高等问题,而生物催化具有绿色、高效的突出优势,采用整细胞或酶来制取该类化合物成为一种趋势[4-7]。手性苯乙醇目前主要是采用假丝酵母[8]、解脂耶氏酵母[9]和面包酵母[10]催化制备,但存在细胞生长慢、底物容量小(12 g/L以下)、制备效率偏低(转化率在70%以下)等问题[11]。
本研究采用常压常温等离子体诱变仪(atomspheric oom temperature plasma,ARTP)对乳酸克鲁维酵母进行诱变,以耐20 g/L的苯乙酮毒性和酮基还原酶酶活作为筛选标记,旨在获得高产酮基还原酶、转化能力强的菌株,为乳酸克鲁维酵母细胞催化苯乙酮制备手性苯乙醇的应用奠定基础。
1 材料与方法
1.1 材料与试剂
乳酸克鲁维酵母(Kluyveromyces lactis)2.1494:中国普通微生物菌种保藏管理中心;由本实验室保藏于4℃冰箱中。
苯乙酮(分析纯):天津科密欧化学试剂有限公司;醋酸乙酯(分析纯):国药集团化学试剂有限公司;正己烷、异丙醇(均为色谱纯):美国Avantor Performance Materials公司;烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)(生化试剂):上海前尘生物科技有限公司;三(羟甲基)氨基甲烷盐酸盐(Tris(hydroxymethyl)aminomethane-HCl,Tris-HCl):美国Sigma-Aldrich公司。
1.2 仪器与设备
ARTP-M常压常温等离子体诱变仪(ARTP)诱变仪:无锡源清天木生物科技有限公司;LC5090高效液相色谱仪(highperformanceliquidchromatography,HPLC):浙江福立分析仪器股份有限公司;RE-52A旋转蒸发器:上海亚荣生化仪器厂;CHIRALCEL OB-H手性柱:日本Daicel公司。
1.3 方法
1.3.1 斜面和平板培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:葡萄糖10g/L,蛋白胨10g/L,酵母浸粉5g/L,琼脂粉20 g/L,灭菌20 min。
标准培养基:葡萄糖10 g/L,蛋白胨10 g/L,酵母浸粉5 g/L,灭菌20 min。
初筛培养基:酵母浸粉10 g/L,蔗糖23.8 g/L,磷酸二氢钾2 g/L,七水合硫酸镁1.5 g/L,苯乙酮20 g/L,灭菌20 min。
1.3.2 种子培养及发酵方法
菌种活化:利用YEPD培养基制备好平板或斜面培养基接种,28℃恒温培养36 h以复苏菌种。
种子培养:挑取适量活化好的平板或斜面菌种的单菌落,接种到装有100mL发酵液的锥形瓶中,放入摇床,30℃、200 r/min培养36 h。
发酵培养及整细胞转化:将培养好的种子液按4%接种到发酵培养基中,28℃、200 r/min培养24 h或48 h。
1.3.3 ARTP的诱变方法
将出发菌株培养到一定浓度,从波长600 nm处的光密度(optical density,OD)OD600nm=1的菌液中取10 μL稀释至10-6,采用ARTP诱变育种系统,辐射功率120 W,改变不同的诱变时间,分别照射0、15 s、30 s、45 s、60 s、90 s、120 s、150 s和180 s,将载片放于装有1 mL生理盐水的离心管中,振荡均匀后稀释至10-1、10-2、10-33个梯度,每个梯度涂布2个平板后放入28℃恒温培养36 h后,计算菌体数量和致死率,绘制致死率曲线,确定适宜照射时间。在适宜照射时间下,建立产乳酸克鲁维酵母的等离子体诱变突变库,挑取存活单菌落制作甘油管,于超低温冷冻保存,备初筛、复筛用。
1.3.4 酮基还原酶的酶活定义及测定方法
酮基还原酶活定义:每1 min催化还原1 mol底物苯乙酮的酶活力为1个酶活单位(U)。
酮基还原酶提取:收集发酵菌液,10 000 r/min离心10 min,收集湿菌体;按1∶10的湿菌体(g)/Tris-盐酸缓冲液(mL)的比例混合,用超声波破壁仪(400 W,每破碎10 s间歇20 s)冰浴破碎0.5 h,离心取上清,备用。
酮基还原酶测定方法[12]:将0.02 mol/L的NADH的溶液(100 μL)、0.03 mol/L的苯乙酮(100 μL)和pH=8的缓冲液Tris-HCl(700μL)加至1mL比色皿中,于30℃放置2min;加入酮基还原酶的粗酶液(100μL),然后每隔20s观察记录OD340nm值,观察记录2min,计算斜率EW,测定转化底物苯乙酮的酶活。酶活计算公式为EW×V×103/(6220×l),其中V为反应液的体积1mL,EW为1min内波长340nm处吸光度值的变化斜率(取绝对值),6220是摩尔消光系数[L·(mol·cm)-1],l为光程距离(cm)。
1.3.5 高产突变株筛选方法
初筛:根据前期出发菌株的整细胞催化研究[13],确定筛选所用底物苯乙酮浓度为20 g/L。将保存的单菌落接种到含有20 g/L苯乙酮的发酵培养基中,12 h后检测菌浓。记录菌浓OD600nm值单菌落甘油管,并编号,然后进行转接、发酵培养,取湿菌超声破碎,测定酮基还原酶酶活,对酶活增加或减少10%、20%、30%、40%、50%、60%的菌株进行编号保藏。
复筛:将初筛的酶活增加60%以上的突变菌株接种到转化含有苯乙酮20 g/L的培养基中培养24 h,对完成整细胞催化的溶液用醋酸乙酯(100 mL×3)萃取3次,合并有机相,用无水硫酸钠干燥,过滤,减压蒸馏,得到反应液,用正己烷定容,采用HPLC检测出苯乙酮残余量,计算苯乙酮的转化率。根据转化率大小确定优势菌株。
1.3.6 色谱条件及各指标测定方法[14]
色谱条件:CHIRALCELOB-H手性柱(4.6mm×250mm,5 μm);流动相正己烷:异丙醇(90∶10,V/V);检测波长220 nm;流速0.5 mL/min;柱温30℃。
菌株致死率(是指菌株经过诱变后发生死亡的百分率)、突变标准(是为了获得高产酮基还原酶的突变株所规定的一个增加比率)、正负突变率、苯乙酮转化率计算公式如下:

1.3.7 筛选得到的优势突变株的生长特性
利用复筛得到的优势突变株进行生长曲线测定,考察该菌株和出发菌株的生长特性变化;根据课题组文献[12]前期试验,按照等摩尔碳使用量原则,设计表1研究方案,200 r/min,培养温度为30 ℃,发酵24 h后,通过OD600nm值测定菌体浓度,并用干质量法测定实际菌体质量,考察最优突变株对葡萄糖、蔗糖等不同碳源的利用能力,为整细胞催化特性研究奠定基础。

表1 不同碳源对乳酸克鲁维酵母及其突变株生长的影响Table 1 Effects of different carbon sources on the growth ofK.lactisand its mutant straing/L

表2 不同氮源对乳酸克鲁维酵母及其突变株生长的影响Table 2 Effect of different nitrogen sources on the growth ofK.lactisand its mutant straing/L
选择酵母浸膏、牛肉膏等六种氮源,设计表2方案进行试验,200 r/min、30 ℃条件下发酵24 h后,通过OD600nm值测定菌体浓度,并用干质量法测定实际菌体质量,考察乳酸克鲁维酵母突变株对氮源的利用情况。
1.3.8 不同因素对突变株整细胞催化特性的影响
选取E1-E4四种不同补料催化方式对最佳碳源、最佳氮源、磷酸二氢钾及七水合硫酸镁用量5个因素4个水平进行16次正交试验,因素与水平见表3,以底物苯乙酮转化率为评价指标,在28℃、200 r/min振荡培养48 h,考察不同因素水平对最优突变株KL5整细胞催化特性的影响。

表3 突变株KL5整细胞催化条件优化正交试验因素与水平Table 3 Factors and levels of orthogonal experiments for catalysis conditions optimization of the whole cell of mutant strain KL5
2 结果与分析
2.1 ARTP处理时间的选择
ARTP等离子体诱变技术是我国清华大学邢新会团队发明的一种新型的菌种快速诱变方法。等离子体诱变过程中会生产超氧自由基、羟基自由基等20多种活性物质[15]。这些活性物质与微生物的DNA作用位点结合,诱导DNA断裂。由于不同的活性物质作用于DNA的位点不同,造成的氧化损伤、基因突变的偏好性也会有所差异[16]。按照1.3.3所叙述的方法试验,在不同诱变时间下得到诱变菌株,制备相应平板,结果见图1。由图1可知,等离子体诱变仪释放出来的等离子体对乳酸克鲁维酵母损伤特别大,20s有70.0%左右的菌株死亡,而30 s即可达到98.6%的致死率,考虑到乳酸克鲁维酵母的生长繁殖快的特点,适当延长处理时间,有利于提高突变体质量,因此本试验选取ARTP处理120 s、致死率在98.0%~99.5%期间的单菌落进行筛选试验。
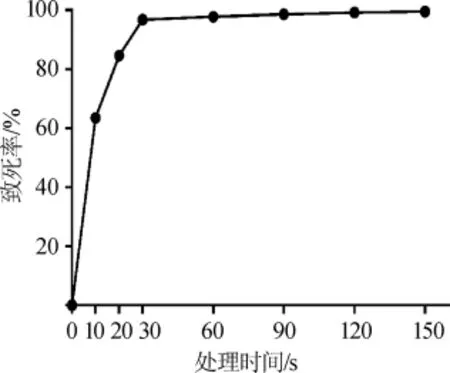
图1 乳酸克鲁维酵母致死率曲线Fig.1 Lethality curve ofK.lactis
2.2 ARTP诱变高产突变株选育
2.2.1 突变株性能的初步筛选
针对文献报道酵母整细胞催化耐底物能力不强、转化率不高等问题,采用在培养基添加底物苯乙酮,通过12 h获得生物量高低和突变体菌株的酮基还原酶酶活变化作为筛选标记,采用1.3.3和1.3.4的方法进行培养和酶活测定,对等离子体诱变的乳酸克鲁维酵母突变体库进行初筛。根据与出发菌株相比所增加10%~60%的酮基还原酶作为突变标准,对所得到的系列突变体库的菌株进行分类整理,结果见表4。
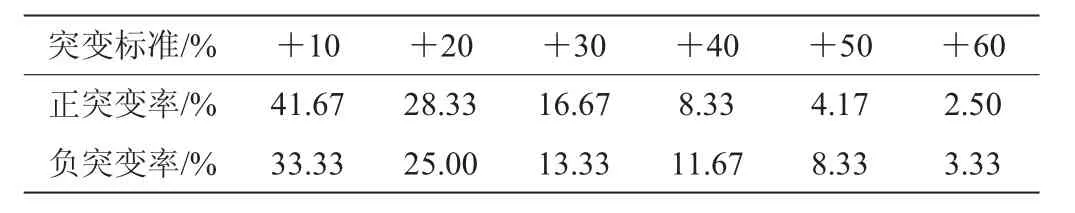
表4 不同突变标准下正负突变率变化情况Table 4 Changes of positive and negative mutation rate under different mutation standards
由表4可知,菌种突变是随机的,以酮基还原酶酶活高低为依据,随着突变标准的提高,在获得的200株突变体库中正突变概率逐渐低于负突变概率,与文献[17]观察一致。所以利用ARTP诱变仪对出发菌株诱变,突变标准越高越难得到突变菌株。通过系列挑选,得到突变标准>30%的5株菌株(编号分别为KL1、KL2、KL3、KL4、KL5)。将其和出发菌株一起在28℃、200 r/min进行苯乙酮转化发酵培养24 h,分别考察其苯乙酮转化率及酮基还原酶酶活,结果见表5。

表5 乳酸克鲁维酵母产酮基还原酶较优突变株的初筛结果Table 5 Preliminary screening results of superior ketoreductaseproducing mutant strains fromK.lactis
由表5可知,发酵24 h后苯乙酮的转化率,与菌株的酮基还原酶酶活成正相关性,酮基还原酶酶活和苯乙酮转化率的变化趋势具有一致性,与出发菌株KL相比,突变菌株KL1~KL5酮基还原酶分别提高36%、47%、91%、115%和132%,苯乙酮转化率分别提高32%、34%、87%、123%和148%。结果表明通过诱变后,有效提高乳酸克鲁维酵母产酮基还原酶的能力。
2.2.2 较优突变株的复筛实验
为了验证突变株的发酵实验结果,对初筛中酮基还原酶较高的5株突变株KL1、KL2、KL3、KL4、KL5和出发菌株连续进行2次生物催化实验,结果见表6。由表6可知,这5株菌生物催化特性稳定和平行性较好,其生物转化趋势基本一致。复筛后,菌株KL4和KL5对苯乙酮转化率分别提高123%和150%。

表6 较优突变株的复筛结果Table 6 Rescreening results of superior mutant strains
2.2.3 突变株遗传稳定性实验
分别将筛选得到的KL1-KL5五株菌在28℃、200 r/min进行苯乙酮转化发酵培养24 h,结果见表7。由表7可知,通过初筛和复筛筛选出的5株突变菌株较出发菌株整细胞催化苯乙酮转化率可提高30%~160%,并通过传代4~6次稳定性试验的结果表明菌株KL4对苯乙酮转化率稳定在35%~36%之间,而菌株KL5对苯乙酮转化率稳定在39%~41%之间。等离子诱变的乳酸克鲁维酵母突变菌株都有着良好的遗传稳定性。

表7 较优突变株遗传稳定性实验结果Table 7 Genetic stability experiments results of superior mutant strains
2.3 突变株KL5生长特性及整细胞催化特性
2.3.1 突变株KL5与出发菌株生长特性比较
以复筛最好的乳酸克鲁维酵母KL5进行实验,考察其菌株生长特性,结果见图2。由图2可知,突变菌株和出发菌株的生长规律基本相同,但是突变菌株KL5在对数生长期10~20 h之间生长得更快,OD600nm值从3增加到16左右,而原始菌株在相关培养时间内,OD600nm值只有突变菌株的一半[12]。乳酸克鲁维细胞里的酮基还原酶为胞内酶,本研究通过测定酮基还原酶酶活,表明其酶活与菌体生物量呈正相关,说明等离子体物理诱变可能是改变了菌体生长的控制基因,从而提高酮基还原酶酶活。因此经ARTP诱变仪诱变后筛选得到的诱变菌株在生长特性上比出发菌株将更适合生物转化苯乙酮。

图2 出发菌和突变菌KL5的生长曲线Fig.2 Growth curves of the starting strain and mutant strain KL5
2.3.2 突变株KL5对不同碳源、氮源的利用特性
选择葡萄糖、乳糖等5种主要碳源,其他培养基不变,按照表1设计在30℃、200 r/min进行培养发酵24 h后测得不同培养基菌体的干质量,结果见图3。由图3可知,突变株KL5和出发菌株一样,添加蔗糖培养的菌体干质量可达到0.18g,而乳糖培养得到的菌体干质量仅为0.04 g。对5种主要碳源利用效果最好的是蔗糖,葡萄糖次之,对乳糖利用效果最差,因此选用蔗糖为最佳碳源。
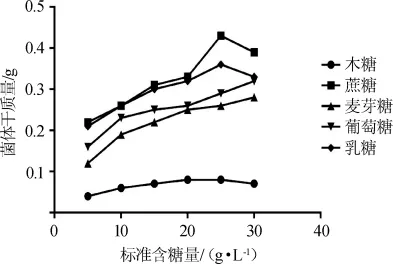
图3 突变菌株KL5在不同种类碳源条件下菌体干质量Fig.3 Dry mass of the mutant strain KL5 under the different carbon sources conditions
选用蔗糖为碳源,其他培养条件不变,选择酵母浸膏、牛肉膏等六种氮源进行试验,结果见图4。由图4可知,酵母浸粉和酵母膏都很适合乳酸克鲁维酵母的生长,培养温度为30℃、200r/min培养24h后测得菌体干质量可以达到0.6g左右,而利用硫酸铵,培养诱变菌株,24h所得菌体不到0.1g。考虑到酵母膏含水量太高导致相同质量营养性能比酵母浸粉略差,因此选用酵母浸粉作为乳酸克鲁维酵母突变株KL5的最佳氮源。

图4 突变菌株KL5在不同种类氮源条件下菌体干质量Fig.4 Dry mass of the mutant strain KL5 under the different nitrogen sources conditions
2.3.3 突变株KL5整细胞催化特性正交试验优化
在单因素试验基础上,对突变株KL5主要影响因素蔗糖、酵母浸膏、磷酸二氢钾、硫酸镁等用量和底物苯乙酮补料方式按照正交试验方法考察整细胞催化特性。正交试验结果与分析见表8。
由表8可知,突变株KL5整细胞催化受底物苯乙酮的补料方式影响最大,其次是碳源、七水合硫酸镁、磷酸二氢钾,影响最小的是氮源,其中前4个因素均对试验具有显著性的影响,F比均>F临界值(a=0.05)。试验发现一次补料底物的转化率比分次添加还高,这说明通过诱变,突变株的耐毒性得到提高。在底物苯乙酮的质量浓度为20 g/L条件下,最优催化条件组合为A1B2C2D1,即蔗糖22.0 g/L,酵母浸粉10.0 g/L,磷酸二氢钾3.0 g/L,七水合硫酸镁1 g/L,补料方式为一次添加。以此最优催化条件利用突变株KL5进行4次验证催化验证试验,苯乙酮转化率平均达到91.8%,与预测一致比优化前出发菌株转化率提高2.5倍。
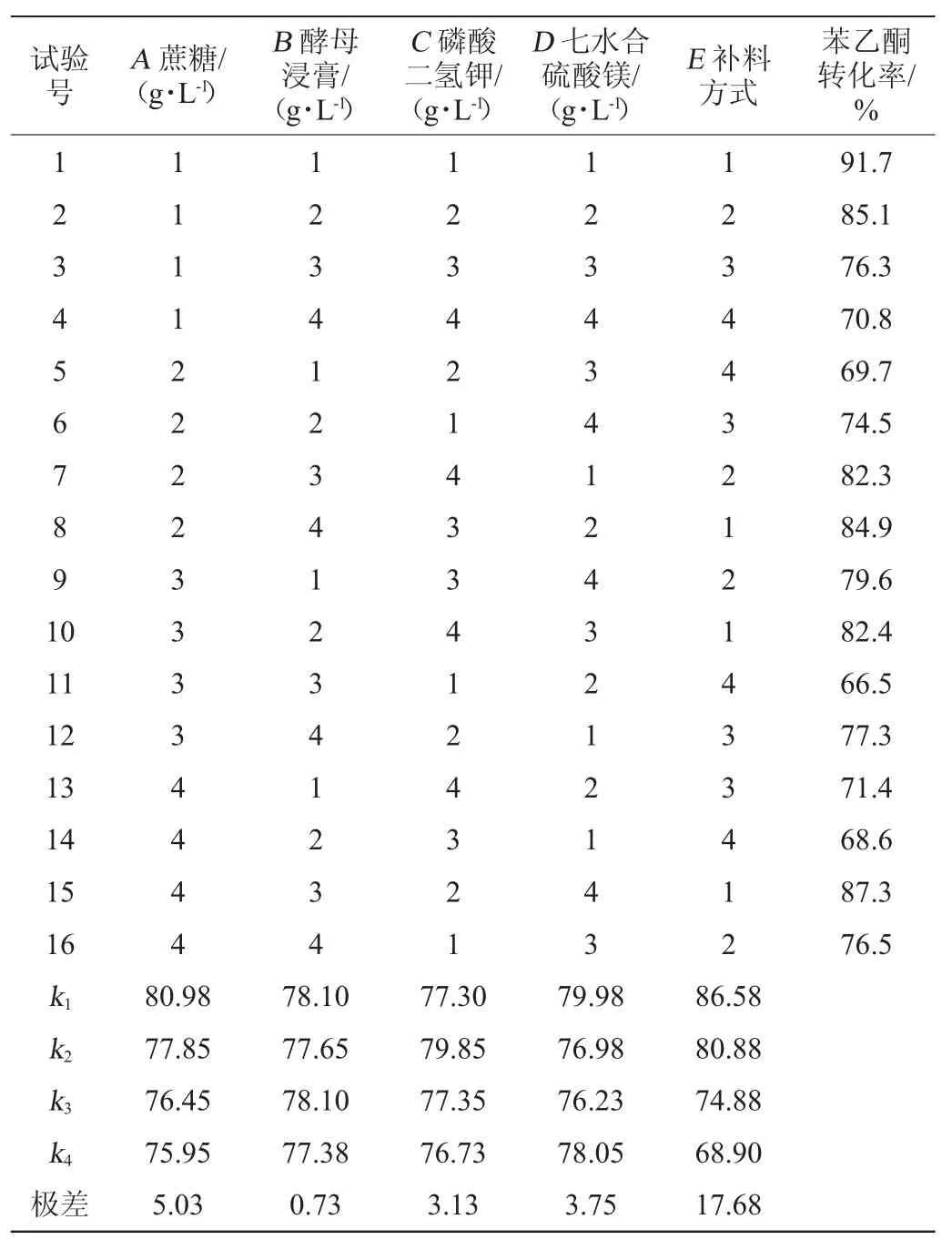
表8 突变株KL5整细胞催化条件优化正交试验结果与分析Table 8 Results and analysis of orthogonal experiments for the whole cell catalysis conditions optimization of the mutant strain KL5
3 结论
采用常温常压等离子体(ARTP)诱变方法,以耐20 g/L的苯乙酮毒性和酮基还原酶酶活作为筛选标记,对乳酸克鲁维酵母进行选育得到高产酮基还原酶的突变菌株KL5,研究了该菌株的生长特性及对底物苯乙酮转化能力,在底物苯乙酮的质量浓度达到20 g/L,蔗糖22.0 g/L,酵母浸粉10.0 g/L,磷酸二氢钾3.0 g/L,七水合硫酸镁1 g/L,补料方式为一次添加的条件下28℃、200 r/min转化48 h,可以实现苯乙酮转化率91.8%,比出发菌株提高2.5倍。该菌株具有广阔的生物催化应用前景,后期将对其突变的内在机理开展分子生物学研究,为酮基还原酶的蛋白质工程改造提供指导。
[1]赵圣印.手性2-氨基-1-苯乙醇类化合物的不对称合成研究进展[J].2007,27(11):1309-1317.
[2]李冬桂,马 丽,刘雄民,等.生物法拆分α-苯乙醇[J].应用化工,2011,40(2):239-242
[3]许晓宁.不对称称转移反应合成手性α-苯乙醇[D].上海:华东理工大学,2016.
[4]胡明明.苯乙酮不对称催化还原制备手性α-苯乙醇的研究[D].北京:北京化工大学,2012.
[5]LI Z,WU Q Q,ZHU D M,et al.Highly enantioselective double reduction of phenylglyoxal to(R)-1-phenyl-1,2-ethanediol by one NADPH-dependent yeast carbonyl reductase with a broad substrate profile[J].Tetrahedron,2013,69:3561-3564.
[6]CHEN X,LIU Z Q,LIN C P,et al.Chemoenzymatic synthesis of(S)-duloxetine using carbonyl reductase fromRhodosporidium toruloides[J].Bioorg Chem,2016,65(2):82-89.
[7]陈 敏,王亚军,柳志强,等.重组短链脱氢酶LcSDR催化(R)-1-苯基乙醇不对称合成的工艺开发[J].化学反应工程与工艺,2016,32(4):320-326.
[8]王丹,曾顺泽,彭果,等.(R)-苯乙醇高产菌株的筛选及分子生物学鉴定[J].四川师范大学学报:自然科学版,2014,37(2):248-252.
[9]许 芹,王 丹,徐 晴,等.解脂耶氏酵母不对称还原苯乙酮合成(R)-苯乙醇[J].化工进展,2016,35(2):528-533.
[10]杨忠华,曾 嵘,吴高明,等.水-有机溶剂两相体系中面包酵母不对称还原苯乙酮合成手性苯乙醇的研究[J].高校化学工程学报,2009,23(3):450-454.
[11]LIU Z Q,DONG S C,YIN H H,et al.Enzymatic synthesis of an ezetimibe intermediate using carbonyl reductase coupled with glucose dehydrogenase in an aqueous-organic solvent system[J].Bioresource Technol,2017,229:26-32.
[12]ZHANG R Z,WANG L,XU Y,et al.In situ expression of(R)-carbonylreductase rebalancing an asymmetric pathway improves stereoconversion efficiency of racemicmixture to(S)-phenyl-1,2-ethanediol inCandida parapsilosisCCTCC M203011[J].Microbial Cell Factor,2016,15:143-153.
[13]曹 纲,郑美娟,郭金玲,等.乳酸克鲁维酵母Kluyveromyces lactics整细胞催化苯乙酮制备(R)-1-苯乙醇工艺研究[J].三峡大学学报:自然科学版,2018,40(2):180-184.
[14]LUO X,WANG Y J,ZHENG Y G,et al.Activity improvement of aKluyveromyces lactisaldo-keto reductase KlAKR via rational design[J].J Biotechnol,2016,224(4):20-26.
[15]吴亦楠,邢新会,张 翀,等.ARTP生物育种技术与装备研发及其产业化发展[J].生物产业技术,2017(1):36-44.
[16]张 雪,张晓菲,王立言,等.常压室温等离子体生物诱变育种及其应用研究进展[J].化工学报,2016,65(7):2676-2685.
[17]王方方,孙沛勇,银会娟,等.常压室温等离子体快速诱变酒精酵母及其突变株的特性研究[J].中国酿造,2013,32(10):117-120.

