可高效降解甜高粱秸秆产糖的纤维素酶研究
2018-06-08许富强王曙阳董妙音姜伯玲李荞荞陈积红李文建
许富强,王曙阳*,董妙音,姜伯玲,李荞荞,陈积红,3,李文建,3
(1.中国科学院近代物理研究所,甘肃 兰州 730000;2.中国科学院大学 生命科学学院,北京 100049;3.甘肃省辐照诱变育种工程实验室,甘肃 武威 733001)
近年来,随着化石能源的过度开采和利用,传统能源日益紧缺并将枯竭,能源问题已成为全社会所面临的首要难题。到2050年,全球每年的石油供应量将由目前的25亿桶降至不足5亿桶,严重威胁人类社会的生存和发展,因此越来越多的科学家致力于探究新的能量来源以缓解能源危机[1]。全世界每年光合作用产生的植物体干物质达1 500亿t,其中作为自然界中十分丰富的资源,纤维素及半纤维素的含量占了50%以上[2],如常见的作物秸秆、饲草、甘蔗渣中都富含纤维素[3],若能利用纤维素酶将这些纤维素转化成可以被直接或间接利用的糖类[4-5],再借助生物发酵生产乙醇[6-7]等能源物质,将实现对纤维素的有效利用,缓解能源短缺问题[8]。纤维素酶广泛应用于饲料、食品工业以及纺织业、造纸业和洗涤业领域,技术已经比较成熟[9],但在燃料酒精生产方面存在诸多挑战,如高效的酶水解体系的建立[10]、高产纤维素酶菌株的构建及高酶活纤维素酶液的制备[11-12]。
本研究通过测定5组实验室自制的纤维素酶液的滤纸酶活(filter paper activity,FPA)、其分解微晶纤维素(microcrystalline cellulose,MCC)后产生的还原糖含量以及对甜高粱秸秆纤维素的转化率,与商品纤维素酶作比较,从而优选出一种可高效降解甜高粱秸秆的纤维素酶,以期为后续纤维素酶分解甜高粱秸秆产生葡萄糖,进而为发酵生产生物乙醇提供论依据。
1 材料与方法
1.1 材料与试剂
甜高粱秸秆:以种植于中国科学院近代物理研究所武威现代产业园的甜高粱秸秆为供试材料,待其成熟,用五点取样法采样,样品于105℃烘箱中烘干至恒质量,冷却至室温后用粉碎机粉碎,过20目筛备用。
纤维素酶液:实验所用的纤维素酶Ⅰ、纤维素酶Ⅱ、纤维素酶Ⅲ、纤维素酶Ⅳ、纤维素酶Ⅴ均由中国科学院近代物理研究所微生物实验室用重离子辐照诱变处理过的绿色木霉(Trichoderma viride)和黑曲霉(Aspergillus niger)突变体采取5种不同的发酵工艺进行中试发酵生产,产物先经6层纱布过滤后,于4℃、4000r/min条件下离心10 min,上清液即为纤维素酶液[13];商品纤维素酶:山东隆科特酶制剂有限公司。
微晶纤维素:香港BBI Life Sciences有限公司;3,5-二硝基水杨酸(dinitrosalicylicacid,DNS):上海中秦化学试剂有限公司;十六烷三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB):美国SPECTRUM公司;浓H2SO(4纯度为98%)、酒石酸钾钠、氢氧化钠:天津北辰方正试剂厂;葡萄糖:天津市大茂化学试剂厂。以上试剂均为分析纯。
1.2 仪器与设备
GUJS-10-100AUTOBIO2000机械搅拌发酵罐:镇江东方生物工程设备技术有限公司;Bioteck酶标仪:时代联想生物科技有限公司;5417R高速台式冷冻离心机:德国Kendro公司;Milli-Q Direct8纯水/超纯水一体化系统:默克化工技术有限公司;06粗纤维测定仪:济南仪器盛泰有限公司;MB-102振荡型恒温金属浴:杭州博日科技有限公司。
1.3 方法
1.3.1 葡萄糖标准曲线的绘制
DNS试剂与还原糖共热后被还原成棕红色的氨基化合物,在一定范围内还原糖的量和光吸收值成比例关系,用酶标仪测出反应后的吸光度值可得还原糖含量[14]。具体操作如下:准确配制1 mg/mL、2 mg/mL、3 mg/mL、4 mg/mL、5 mg/mL、6 mg/mL的葡萄糖标准液,分别取不同质量浓度的葡萄标准溶液20μL于1.5mL的离心管中,依次加入40μL蒸馏水和140μLDNS试剂,使体系总体积为200μL,在95℃、300 r/min的金属浴上孵化5 min,立即冷却后取出40 μL加入到含有160 μL蒸馏水的酶标板中,在波长520 nm处用酶标仪测其值。以吸光度值OD520nm(y)为纵坐标,葡萄糖标准溶液质量浓度(x)为横纵标,得到葡萄糖标准回归方程为:y=4.122x-0.378 1,相关系数R2=0.999 5。根据葡萄糖标准曲线回归方程计算水解体系中还原糖含量。
1.3.2 纤维素酶滤纸酶活的测定
滤纸的聚合度和结晶度相较于其他纤维材料来说处于“中等”程度,实验中经常以其为原料经纤维素酶水解生成还原糖的量来衡量纤维素酶总的糖化能力,它反映了纤维素酶中内切-β-1,4-葡聚糖酶、外切-β-1,4-葡聚糖酶以及β-葡萄糖苷酶三个酶组分的协同作用能力,统称滤纸酶活[15-16]。具体操作:在1.5 mL的离心管中加入3 mm×4 mm的滤纸块,再加入40 μL pH=4.6的柠檬酸钠缓冲液和20 μL纤维素酶液,在50℃金属浴上300 r/min孵育60 min后加入140 μL DNS试剂,在95 ℃金属浴上300 r/min孵化5 min,冷却后取出40 μL加入含有160 μL蒸馏水的酶标板中,在波长520 nm处用酶标仪测其OD520nm值,然后根据标准曲线回归线方程计算还原糖含量,根据纤维素酶酶活定义得FPA酶活[17]。
纤维素酶酶活定义:以每毫升酶液在1 min内水解反应体系中底物生成每微克葡萄糖所需的酶量定义为1个酶活单位(U)。
1.3.3 纤维素酶分解微晶纤维素实验
微晶纤维素(MCC)在结构上是以β-1,4-葡萄糖苷键结合的直链形式多糖,它由天然纤维素经水解至极限聚合度得到的,故与纤维素在化学反应特性上具有相类似的特点[18],因此在一定反应时间内,可以用纤维素酶分解微晶纤维素产生葡萄糖的量来衡量纤维素酶分解纤维素的能力。MCC的分解实验参照BOMMARIUS A S等[19]研究方法,取100 mg/mL的微晶纤维素溶液5 mL,pH 5.0的柠檬酸钠缓冲液2 mL,酶液1 mL,在50℃、200 r/min的摇床上反应8 h。反应毕,测定微晶纤维素分解实验中的还原糖含量。具体操作为:反应液经4 000 r/min离心10 min后,取60 μL上清液,加入140μLDNS溶液,在95℃金属浴上加热5min,冷却至室温后,取40 μL加入含有160 μL蒸馏水的酶标板中,在波长520 nm处进行酶标仪检测。
1.3.4 纤维素酶分解甜高粱秸秆的实验
甜高粱秸秆中纤维素的含量的测定:纤维素的含量通过酸性洗涤纤维(acid detergent fiber,ADF)减去酸性洗涤木质素(acid detergent lignin,ADL)可得[20-23]。
甜高粱秸秆由占80%左右的细胞壁和细胞内容物组成,秸秆的细胞内容物基本上能够被完全消化,而含有较多纤维素的细胞壁则很难被降解。由于纤维素极难溶于水,因而纤维素酶和纤维素的作用属于固-液双相反应。在酶解反应时,作为液相的纤维素酶分子先吸附到固相的纤维素表面上,然后酶和底物形成不稳定的复合物,并在固相表面上进行酶水解反应从而产生还原糖[24]。具体操作:准确称取1 g过20目筛的甜高粱置于培养皿中,按70%的含水量加蒸馏水0.7 mL,分别按30%的酶量,加入纤维素酶Ⅰ、纤维素酶Ⅱ、纤维素酶Ⅲ、纤维素酶Ⅳ、纤维素酶Ⅴ、商品纤维素酶,每组设置3个平行,然后于50℃恒温培养箱中培养,于0、24 h、48 h、72 h时参考国标GB 5009.7—2016《食品安全国家标准食品中还原糖的测定》[25]用斐林试剂热滴定法测其还原糖含量[25]。纤维素转化率的计算公式如下所示:

1.3.5 数据处理
实验数据用SPSS21.0进行分析,并用Origin8.0进行图表处理,每组设3个平行,结果用平均值±标准误表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 纤维素酶滤纸酶活性的测定结果
5组实验室自制的纤维素酶和商品纤维素酶的滤纸酶活(FPA)性测定结果如图1所示。
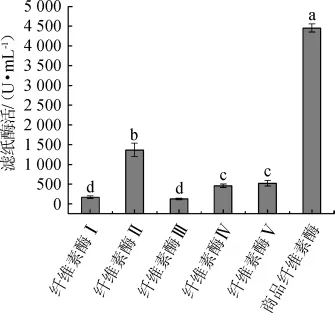
图1 纤维素酶的滤纸酶活测定结果Fig.1 Determination results of filter paper activity of cellulase
由图1可知,5组自制纤维素酶的FPA极显著低于商品纤维素酶的FPA(P<0.01)。纤维素酶Ⅱ的FPA明显高于其他4组自制的纤维素酶(P<0.05),分别是纤维素酶Ⅰ、纤维素酶Ⅲ、纤维素酶Ⅳ、纤维素酶ⅤFPA的8.05、11.57、2.96、2.63倍。其次,纤维素酶Ⅴ显著高于纤维素酶Ⅰ、纤维素酶Ⅲ(P<0.05),略高于纤维素酶Ⅳ,但不显著(P>0.05)。
2.2 纤维素酶对微晶纤维素分解效果
考察5组实验室自制的纤维素酶和商品纤维素酶对微晶纤维素(MCC)的分解效果,结果如图2所示。
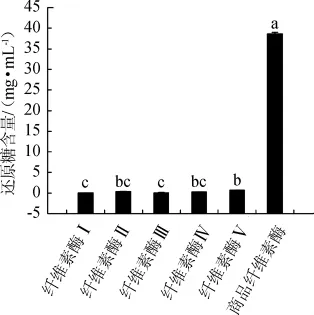
图2 纤维素酶的微晶纤维素的分解结果Fig.2 Decomposition results of microcrystalline cellulose withcellulase
由图2可知,商品纤维素酶对MCC的分解能力最强,极显著强于其他自制的纤维素酶(P<0.01),纤维素酶Ⅴ次之,显著强于纤维素酶Ⅰ、纤维素酶Ⅲ(P<0.05),且比纤维素酶Ⅱ、纤维素酶Ⅳ分解MCC的能力略强,但未达到差异显著性水平(P>0.05)。纤维素酶Ⅴ分解MCC的能力分别比纤维素酶Ⅰ、纤维素酶Ⅱ、纤维素酶Ⅲ、纤维素酶Ⅳ的分解MCC能力强14.31倍、0.94倍、6.35倍、1.43倍。这可能是由于不同的纤维素酶液中内切-β-1,4-葡聚糖酶、外切-β-1,4-葡聚糖酶以及β-葡萄糖苷酶的比例不同,导致其在分解不同结晶度和聚合度的纤维素时存在差异。
2.3 纤维素酶对甜高粱秸秆纤维素的分解效果
酸性洗涤纤维(ADF)包括几乎全部的纤维素、木质素以及少量的酸不溶灰分,酸性洗涤木质素(ADL)常用72%的浓硫酸水解ADF后所得的不容物测得,主要由木质素和酸不溶灰分组成,实验中用ADF含量减去ADL含量表示秸秆中的纤维素的含量,甜高粱秸秆中ADF与ADL含量测定结果如表1所示。

表1 甜高粱秸秆中酸性洗涤纤维和酸性洗涤木质素含量的测定结果Table 1 Determination results of ADF and ADL contents in sweet sorghum straw
由表1可知,甜高粱秸秆的酸性洗涤纤维(ADF)含量为44.58g/100 g,酸性洗涤木质素(ADL)含量为6.43 g/100 g,通过本实验中ADF含量减去ADL含量可测得文中所用的实验材料甜高粱秸秆的初始纤维素含量为38.16 g/100 g。
用斐林热滴定法测定0、24 h、48 h、72 h时反应体系中还原糖含量,根据公式(1)得到纤维素酶对甜高粱秸秆纤维素的转化率,结果如图3所示。
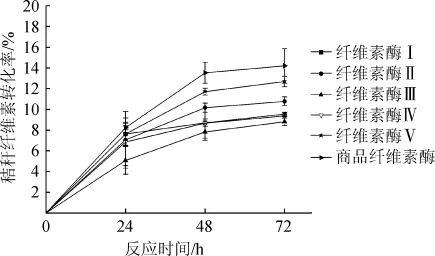
图3 纤维素酶降解甜高粱秸秆的纤维素转化率Fig.3 Cellulose conversion ratio of sweet sorghum straw with cellulase
由图3可知,加入纤维素酶后,随着反应时间的延长甜高粱秸秆转化率呈现升高趋势,表明5组自制的纤维素酶和商品纤维素酶均能将甜高粱秸秆中的纤维素分解生成还原糖。在0~72h的反应时间内,商品纤维素酶对甜高粱秸秆中纤维素的转化率一直高于5组自制的纤维素酶,在48h时,商品纤维素酶对甜高粱秸秆中纤维素的转化率达到13.52%,之后基本维持不变(P>0.05)。除了纤维素酶Ⅰ在24 h时转化率已达到最高外,其余5组纤维素酶均在48 h之后基本不再降解转化生成葡萄糖,可能的原因有两点:一是由于反应时间过长,纤维素酶失活导致酶的活性降低[26];二是产物葡萄糖抑制了纤维素酶的活性[27]。在自制的5组纤维素酶中,0~48 h内纤维素酶Ⅴ对甜高粱秸秆中纤维素的降解能力最强,在48 h时秸秆中纤维素的转化率达到了最高,为11.69%,48h以后转化率基本不变(P>0.05)。由此可知纤维素酶Ⅴ对甜高粱秸秆纤维素具有较高的亲和力,能高效降解甜高粱秸秆中的纤维素,这在后续的实验研究意义重大。
目前报道的纤维素酶对天然纤维素的降解转化率最高水平是20%[28],而本实验室自制的纤维素酶Ⅴ对甜高粱秸秆纤维素表现出了比较强的降解能力,可见纤维素酶Ⅴ中内切-β-1,4-葡聚糖酶、外切-β-1,4-葡聚糖酶以及β-葡萄糖苷酶组分比例平衡,特别是纤维素酶Ⅴ在高效分解甜高粱秸秆纤维素产糖方面表现的巨大潜力,可作为生物质能源催化生产的商业纤维素酶进一步推广生产。
3 结论
本研究通过测定重离子诱变技术选育的绿色木霉和黑曲霉所发酵生产的5组自制纤维素酶液和商品纤维素酶的滤纸酶活(FPA),及其对微晶纤维素(MCC)和甜高粱秸秆纤维素的降解效果评价。研究发现,在5组自制的纤维素酶液中,滤纸酶活(FPA)最高的是纤维素酶Ⅱ(1364.84U/mL),可制备高滤纸酶活的商品纤维素酶制剂;纤维素酶Ⅴ的滤纸酶活次之(519.83 U/mL),但其对微晶纤维素和甜高粱秸秆的降解效果均强于纤维素酶Ⅱ,尤其是纤维素酶Ⅴ在50℃、48h时对甜高粱秸秆中纤维素降解能力较强,纤维素转化率达到了11.69%,这对以甜高粱秸秆为底物酶解产生可发酵的糖进而生产生物乙醇以及高附加值的化工产品意义重大。
[1]CAMBELL C,LAHERRÈRE J.The end of cheap oil:Global production of conventional oil will begin to decline sooner than most people think,probably within 10 years[J].Sci Am,1998,3:78-83.
[2]THRAN D,SEIDENBERGER T.Global biomass potentials-resources,drivers and scenario results[J].Energ Sust Dev,2010(10):200-205.
[3]DEUTSCHMANN R,DEKKER R F.From plant biomass to bio-based chemicals:latest developments in xylan research[J].Biotechnol Adv,2012,30(6):1627-1640.
[4]SINNOTT M L.Catalytic mechanism of enzymic glycosyl transfer[J].Chem Rev,1990,90(7):1171-1202.
[5]JUTURU V,WU J C.Microbial cellulases:Engineering,production and applications[J].Renew Sust Ener Rev,2014,33(5):188-203.
[6]KUMAR R,SINGH S,SINGH O V.Bioconversion of lignocellulosic biomass:biochemical and molecular perspectives[J].J Ind Microbiol Biotechnol,2008,35(5):377-391.
[7]彭良才.论中国生物能源发展的根本出路[J].华中农业大学学报,2011,92(2):1-6.
[8]BHAT M K.Cellulases and related enzymes in biotechnology[J].Biotechnol Adv,2000,18(5):355-383
[9]GUPTA R,MEHTA G,DESWAL D,et al.Cellulases and their biotechnological applications[J].Biotechnol Environ Manage Res Recov,2013,12:89-106.
[10]BANSAL P,HALL M,REALFF M J,et al.Modeling cellulase kinetics on lignocellulosic substrates[J].Biotechnol Adv,2009,27(6):833-848.
[11]KUHAD C,GUPTA R,SINGH A.Microbial cellulases and their industrial applications[J].Enzyme Res,2011(2):1-9.
[12]姜伯玲.重离子辐照诱变选育纤维素酶高产菌株及其发酵工艺研究[D].北京:中国科学院大学,2016.
[13]姜伯玲,王曙阳,李文建,等.绿色木霉与黑曲霉混合发酵产纤维素酶的研究[J].中国酿造,2015,34(7):28-31.
[14]ZHAO K,XUE P J,GU G Y.Study on determination of reducing sugar content using 3,5-dinitrosalicylic acid method[J].Food Sci,2008,29(8):534-536.
[15]王义甫,何艳玲,孔令娜.饲用纤维素酶测定方法的探讨[J].饲料与畜牧,2008,67(1):35-38.
[16]张全国,张志萍,赵民善,等.秸秆制氢过程中纤维素酶酶活测定方法研究[J].热科学与技术,2011,10(1):128-132.
[17]DECKERSR,ADNEYW S,JENNINGS E,et al.Automated filter paper assayfor determination of cellulose activity[J].Biotechnol Fuels Chem,2003,107(1):687-703.
[18]陆红佳,郑龙辉,刘 雄.微晶纤维素在食品工业中的应用研究进展[J].食品与发酵工业,2011,37(3):141-144.
[19]BOMMARIUS A S,KATONA A,CHEBEN S E,et al.Cellulase kinetics as a function of cellulose pretreatment[J].Metab Eng,2008,10(6):370-381.
[20]杨 胜.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,1999:16-17.
[21]全国饲料工业标准化技术委员会.NY/T 1459—2007饲料中酸性洗涤纤维的测定[S].西安:农业部饲料质量监督检查测试中心,2007.
[22]全国饲料工业标准化技术委员会.GB/T 20805—2006饲料中酸性洗涤木质素(ADL)的测定[S].北京:中国标准出版社,2006.
[23]许富强,董妙音,王曙阳,等.甜高粱最佳青贮时期及延期对其营养成分的影响研究[J].饲料研究,2017(4):20-24.
[24]麻星星.天然纤维素酶法水解条件的研究[D].北京:北京化工大学,2010.
[25]中华人民共和国卫生部、中国国家标准化管理委员会.GB/T 5009.7—2008食品中还原糖的测定[S].北京:中国标准出版社,2008.
[26]WILSON D B,IRWIN D C.Genetics and properties of cellulases[M].New York:Springer Nature,1999,1-21.
[27]YE S,CHENG J.Hydrolysis of lignocellulosic materials for ethanol production:A review[J].Bioresource Technol,2003,34(1):1-11.
[28]MOOD S H,GOLFESHAN A H,TABATABAEI M,et al.Lignocellulosic biomass to bioethanol,a comprehensive review with a focus on pretreatment[J].Renew Sust Energ Rev,2013,27:77-93.
