GIS1基因对酿酒酵母耐受性的研究
2018-06-08付肖蒙肖冬光郝爱丽董胜胜
付肖蒙,肖冬光,郝爱丽,董胜胜,李 潇,董 健*
(天津科技大学 生物工程学院 工业发酵微生物教育部重点实验室,天津 300457)
化石能源的日益枯竭以及人们环保意识的增强,燃料乙醇生产越来越受到人们的重视。目前,生物发酵法被应用于全球各地的各个行业的乙醇生产中。燃料乙醇的生产仍然主要通过酿酒酵母发酵淀粉或糖质原料来实现。它们均为农副产品,如糖蜜、谷类作物(玉米、小麦、大米等),并以此为主要的发酵原料,经过蒸煮、糖化,使其中的多糖或者淀粉等大分子水解成为葡萄糖、果糖等单糖小分子。再将这些单糖小分子通过酵母本身的生物代谢发酵,从而使这些小分子转化生成目的产物,这是一种传统并可长期有效利用可再生资源的生产方法[1]。生物发酵法生产乙醇不会产生工业行业中的“三废”,具有长期可持续性,符合国家所倡导的走可持续发展道路的发展观[2]。随着浓醪发酵工艺的广泛应用,给酿酒酵母的耐受性提出了较高的要求,如高渗透压耐受性、高乙醇耐受性[3-4]、高温耐受性[5]及高乙酸耐受性[6]等。因此,对胁迫环境有抗性的酵母菌株的开发和应用具有很重要的意义。同时,对具有较强耐受性酿酒酵母的分离筛选越来越受到关注,逐渐成为研究重点。SANCHEZY等[7]过量表达基因HSP104,提高了酵母细胞的高温耐受性。VERSELE M等[8]将酵母的HSP104基因导入到hsp101基因缺陷型热敏感的刀豆中,使刀豆细胞获得了正常的温度耐受性。WOLFGANGR等[9]研究发现,Msn4p在细胞处于高浓度乙醇胁迫环境中起着调节作用。SWAN T M等[10-11]对酵母细胞在加盐培养基中的生长情况分别进行了研究,发现海藻糖含量与细胞对外界不利环境的耐受性有着密切关系。目前,研究酵母细胞的耐受性问题主要从热休克蛋白[12]、糖蛋白[13]、海藻糖含量[14]、细胞能量代谢相关基因[15]、细胞膜成分的合成基因[16]、细胞内氨基酸的合成和转运[8]等方面。除了能够修复高温损伤的蛋白质,热休克蛋白还能修复其他原因损伤的蛋白质。海藻糖的含量不仅与乙醇胁迫有关,还与渗透压胁迫、氧化胁迫有关。NAKAGAWA Y等[17]获得一株对乙醇、盐、有机溶剂、高温、高糖、H2O2等都具有一定耐受能力的突变株MLT1-1。在以葡萄糖为碳源的培养基上培养的酵母细胞,酿酒酵母的时序寿命与其压力抗性,尤其是热激抗性正相关,而与Ras/cAMP/PKA信号通路的活性负相关,即蛋白激酶A的活性可影响细胞的生长和耐热性能,活性高的细胞生长性能好,而活性低的细胞对热胁迫耐受性好。Gis1转录因子是一种锌指蛋白,是应答损伤的、编码光解酶的PHR1基因的抑制子,能够作为抑制rim15Δ突变株在营养缺乏条件下对SSA3转录抑制缺陷的抑制子被发现的[18]。Gis1在Rim15的下游,它通过作用于基因启动子里的PDS(post-diauxicshift)元件激活基因转录,如SSA3基因。缺失Gis1会使突变体细胞缺陷性响应影响限制诱导的激活[19]。过量表达Gis1则会抑制细胞生长,Gis1水平的降低能减弱对蛋白激酶A(proteinkinase A,PKA)的依赖性,从而增加细胞的耐受性,这表明Gis1激活一个或多个抑制细胞增殖的基因的表达。PDS的核心与逆境应答元件STRE(stress-responsiveelement)的共有序列十分相似,因此推测Gis1和Msn2/4根据启动子的特征可能有部分重叠功能,所以在Msn2/4不存在时,Gis1可能作用于STRE位点[20]。工业应用中对酵母的耐受性有很高的要求,人们期望得到耐高温、耐高渗透压、耐高浓度酒精、耐高乙酸等高耐受性的菌株。但是在发酵过程中,胁迫环境如高温、高渗透压、营养饥饿、高浓度酒精毒性等不可避免,故而提高酵母菌种的耐受性,可以提高菌种的发酵性能,降低发酵过程中能量消耗,从而提高工厂生产效益和经济效益。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与材料
酿酒酵母(Saccharomyces cerevisiae)AY12、AY 12a以及AY12aΔU:天津科技大学天津市工业微生物重点实验室;玉米粉:天津市滨海新区人人乐购物超市。
1.1.2 化学试剂
高保真PrimeStar DNA 聚合酶(5 U/μL)、高保真LA DNA聚合酶(5 U/μL),rTaqDNA 聚合酶(5 U/μL):大连TaKaRa公司;无氨基酵母氮源(yeast nitrogen base,YNB)、脱氧核糖核酸(deoxyribonucleic acid,DNA)基因组提取试剂盒、DNA片段纯化回收试剂盒:北京Solarbio科技有限公司;5-氟乳清酸(5-fluoroorotic acid,5-FOA):上海源叶生物科技有限公司;Ura Dropout powder:北京泛基诺科技有限公司;尿嘧啶:上海生物工程有限公司;α-淀粉酶(30U/g)、糖化酶(180 U/g):诺维信(中国)投资有限公司。
1.1.3 培养基
酿酒酵母(S.cerevisiae)单倍体和二倍体菌株AY12aΔU、AY12a和AY12均采用酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:葡萄糖2%,蛋白胨2%,酵母浸粉1%,pH自然,115℃灭菌20 min。固体培养基需再添加2%的琼脂粉;转化子用URA3基因营养缺陷型(synthetic dropout,SD)培养基:葡萄糖2%,YNB 0.67%,Ura Dropout powder 0.13%,100 mg/L尿嘧啶,115℃灭菌20 min。固体培养基需再添加2%的琼脂粉。
1.1.4 引物
本实验所有用到的引物序列如表1所示。

表1 本实验所用引物Table 1 Primers used in the study
1.2 仪器与设备
APCR-E3112聚合酶链反应(polymerasechainreaction,PCR)仪:德国Biometra公司;7890型气相色谱仪:安捷伦科技有限公司;Kodak Gel Logic 212全自动凝胶成像仪:美国Syn Gene公司;IS-RDS3型恒温摇床:上海智城仪器制品有限公司;AB204-S型分析天平:梅特勒-托利多仪器(上海)公司;LDZM-60KCS高压蒸汽灭菌锅:上海申安医疗器械厂;HS-1300-V型超净工作台:苏州安泰空气技术有限公司;G560E旋涡振荡仪:美国Scientific Industries公司。
1.3 方法
1.3.1 脱氧核糖核酸(DNA)提取和纯化
使用酵母DNA基因组提取试剂盒,参照产品说明书进行酵母基因组的提取,0.8%琼脂糖凝胶电泳检测,使用DNA片段纯化回收试剂盒,参照产品说明书进行DNA片段的纯化回收[21]。
1.3.2 聚合酶链反应扩增
PCR反应条件为:95 ℃、5 min;94 ℃、45 s;54 ℃、2 min;72℃、2min;30个循环;72℃保温10min。PCR扩增产物4℃保存。取PCR扩增产物2μL,0.8%琼脂糖凝胶电泳鉴定PCR产物。
1.3.3 酵母高效醋酸锂转化法
(1)挑取酿酒酵母菌泥接于5mLYEPD液体培养基中,30℃、180 r/min振荡培养。
(2)取2.5×108个细胞于50 mL YEPD液体培养基中(约5×106个细胞/mL),30 ℃、180 r/min振荡培养至2×107个/mL,约培养4~6 h。
(3)大离心管收集菌体,将离心管置于冰袋中,4℃条件下5 000 r/min离心5 min。
(4)25 mL无菌去离子水洗涤两次,每次将菌体摇匀后离心,弃上清液,收集菌体。
(5)将菌体悬浮于1 mL 0.1 mol/L的醋酸锂中,混匀后转移到1.5mL离心管中,在4℃条件下5000r/min离心5min,去上清。
(6)将细胞重新悬浮于0.5 mL 0.1 mol/L的醋酸锂中,50 μL/管进行分装。取50 μL悬浮液,离心,去上清。
(7)1mL鲑鱼精单链DNA(singlestrandedDNA,ssDNA)10 mg/mL)样品煮沸5 min,冰浴2 min。
(8)转化体系(360 μL):将上述离心后的50 μL菌体中依次加入240 μL体积分数为50%聚乙二醇(polyethylene glycol,PEG),36 μL的1 mol/L醋酸锂,50 μL 的2 mg/mL的ssDNA以及34 μL的转化片段。
(9)将上述混合物用旋涡振荡仪轻柔振荡,混匀30 s,放入30℃恒温培养箱中静置30 min。
(10)上述悬液于42℃水浴锅中热击40 min。
(11)5000r/min离心2min,弃上清液,加入1mL新鲜的液体YEPD重悬菌体,并将重悬后的菌体放入30℃、100r/min摇床回复培养4 h,12 000 r/min离心1 min,适量dd H2O重悬菌体,取100 μL重悬菌液涂布于SD筛选平板上于30℃放置2 d。
1.3.4 玉米原料高温浓醪发酵工艺
(1)玉米水解液的制备
称取1 500 g的玉米粉,加入4 500 mL 65~70℃的自来水,静置放置20 min,使玉米颗粒充分吸水膨胀。加入液化酶(α-淀粉酶)0.9 mL,于85~90℃条件下水浴液化1.5 h,前30 min不断搅拌,使得玉米粉充分溶解。转入60℃水浴锅中,并加入3 mL糖化酶,在55~60℃下糖化20 h。糖化完成后,四层滤布过滤糖化液,将得到的澄清滤液经高压蒸汽灭菌(105℃灭菌20 min),即为玉米水解液,pH自然。
(2)种子培养基的配制
一级种子培养基:8°Bx的玉米水解液,添加0.5%的酵母浸粉,每支试管分装5 mL,105℃灭菌20 min,待液体冷却,接种酵母单菌落,30℃恒温静置培养24 h。
二级种子培养基:12°Bx的玉米水解液,添加0.5%的酵母浸粉,每个锥形瓶分装45 mL,105℃灭菌20 min,将一级种子液全部倒入100 mL锥形瓶,30℃恒温静置培养16 h。
(3)同步糖化高温浓醪发酵工艺
称取100g玉米粉洗净、干燥且称质量的500 mL三角瓶中,加入200 g 60~70℃的自来水和30 μL 30 U/g原料的淀粉酶,调节pH至5.5~5.8,搅拌均匀,沸水浴液化,料液温度达到90℃开始计时液化90min,液化过程中不断搅拌,液化结果以碘试无蓝色且呈红棕色为准。液化完成后冷却至38℃左右,调节pH至4.2~4.4,加入90 μL 180 U/g原料的糖化酶,0.36 g尿素,15 mL二级种子液,搅拌均匀,并用35℃左右的自来水补足液化过程中损失的水,普通封口膜,聚乙烯(polyethylene,PE)手套将发酵瓶瓶口密封,30℃、160 r/min条件下培养12 h,后转入38℃、160 r/min条件下进行摇床发酵。在此过程中,每隔12 h称质量一次,两次差值小于1 g即可蒸酒。待发酵48 h,测48 h细胞存活率,且此时将发酵温度改为30℃。
1.3.5 酿酒酵母细胞生长曲线的测定
酵母正常生长温度为30℃,在乙醇的发酵过程中,当发酵醪液的温度>38℃时,就必须使用冷却水进行降温,否则就会对酿酒酵母的活性产生抑制,影响乙醇的产率以及还原糖的利用率,因此分别测定出发菌和改造菌在30℃和40℃条件下的生长曲线能够更清楚的看出改造菌下发酵过程中的生长性能从而看出其耐高温能力[22]。
本实验采用全自动生长曲线测定仪测定吸光度值(OD600nm值),操作步骤如下:
(1)菌种活化:挑取斜面上一环菌泥接至5 mL YEPD液体培养基中,30℃、180 r/min培养12 h。
(2)生长曲线的测定:吸取上述培养液40μL接入360μL液体YEPD培养基的100孔板中,将100孔板置于设定的温度下培养,以未接种的YEPD液体培养基为空白对照,每隔0.5 h于波长600 nm处测定吸光度值,以培养时间(h)为横坐标,OD600nm值为纵坐标,绘制菌株生长曲线图。
1.3.6 酿酒酵母细胞耐受性的测定
热激耐受性测定:从斜面挑取酿酒酵母AY12a和AY12agis1单菌落,于5 mL YEPD液体培养基中,30℃、180 r/min过夜培养。测OD600nm值,取适量菌液转接入5 mL新鲜YEPD液体培养基中,使其初始OD600nm值为0.15。将上述细胞培养4~6 h至生长对数期。测量OD600nm值,调整所有细胞OD600nm值为1,以保证所有细胞初始菌体浓度一致。分别移取100μL的菌液于1.5 mL离心管中,实验组作55℃水浴4 min热击处理,对照组不做任何处理。
将实验组和对照组分别用无菌水稀释相同的浓度梯度,按照浓度递减的顺序,每个稀释度取2 μL的菌液整齐的滴于YEPD固体培养基平板上,超净工作台晾干后,封口膜封好倒置于30℃恒温培养箱中培养1~3 d,观察菌体的生长,比较酿酒酵母AY12和AY12a-gis1的55℃热激4 min条件下的耐热激情况。
NaCl、乙醇和乙酸耐受性测定:每个稀释度分别移取2 μL对照组和实验组菌液整齐的滴于分别含有6%NaCl、15%(V/V)的乙醇及5%(V/V)的乙酸的YEPD培养基平板上[23],超净台晾干后,封口膜封好倒置于30℃恒温培养箱中培养1~3 d,观察菌体生长,比较不同菌株对NaCl、乙醇及乙酸的耐受性情况。
1.3.7 高温浓醪发酵的参数测定
利用酒精比重计对酒精度进行测定;使用斐林试剂法进行还原糖含量测定;采用血球计数仪进行活细胞数的测定,细胞存活率计算公式如下:
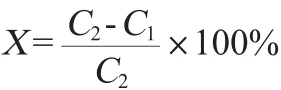
式中:X为酿酒酵母发酵48 h后细胞存活率,%;C1为血球计数板中经过次甲基蓝染色剂染色后着色的细胞数,个;C2为血球计数板中全部的细胞数,个。
2 结果与分析
2.1 构建AY12a-gis1酵母突变株
以野生型酿酒酵母工业菌株AY12a为亲本菌株,基因URA3为筛选标记,在GIS1基因的N端加入强启动子PGK1p,以实现GIS1基因的过表达。同时设计四对引物,用于PCR扩增获得带有同源臂的四个片段GIS1p、URA3、PGK1p和GIS1。将四个扩增片段进行PCR纯化回收,利用醋酸锂转化法将纯化后的片段导入到受体菌株AY12a△U完成同源序列之间的同源重组,转化产物涂布于尿嘧啶缺乏的SD培养基上,生长2~3 d后得阳性转化子,单菌落进行纯化,精提基因组并以此为模板进行PCR测定。由于受体菌株AY12a△U含有突变的URA3基因,经醋酸锂化转后同源重组正确的转化子在SD培养基上可以生长,以此筛选正确转化子。AY12a-gis1突变株的构建过程如图1所示。
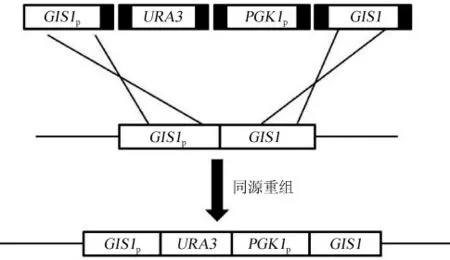
图1 过表达GISI基因的流程图Fig.1 Flow chart of geneGISIoverexpression
2.2 目的片段的扩增
按照方法1.3.1精提酵母基因组,以亲本菌株AY12a为模板,利用引物对GIS1上同源臂U和GIS1上同源臂D、GIS1-URA3U和GIS1-URA3D、GIS1-PGK1pU和GIS1-PGK1pD、GIS1下同源臂U和GIS1下同源臂D进行PCR扩增带有部分同源的四个基因片段,其片段长度大小见图2。由图2可知,四个基因片段分别为811 bp、864 bp、1 524 bp及1 709 bp,与预期片段大小一致。
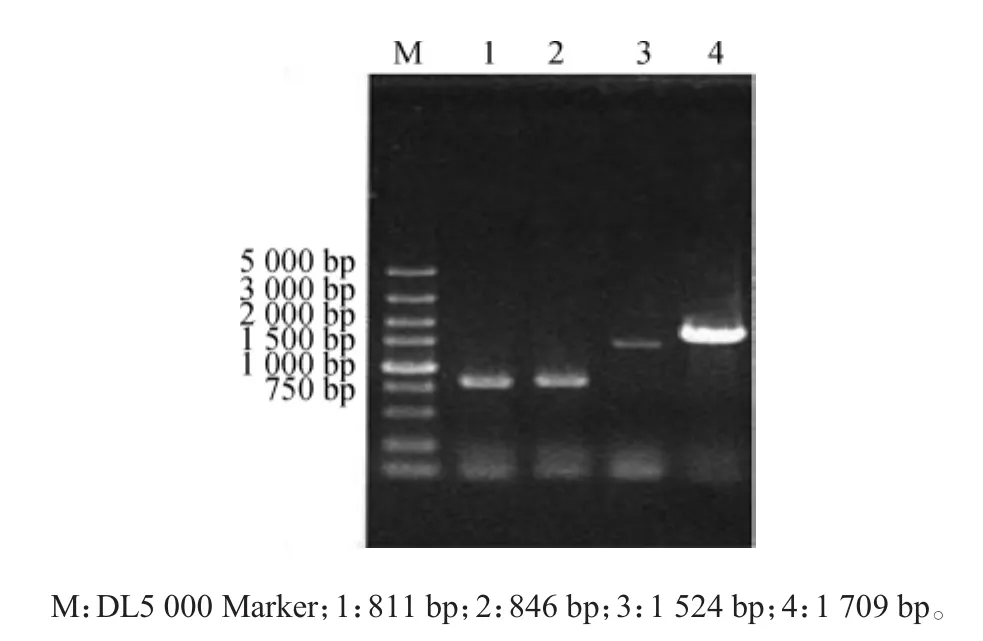
图2 带有同源臂的GIS1片段扩增验证Fig.2 Verification ofGIS1fragment amplification with homologous arm
2.3 突变株的获得
按照方法1.3.1精提阴性对照AY12a基因组及粗提基因组验证正确的菌株基因组,分别利用引物进行验证。利用引物对验证GIS1上同源臂-URA3U和验证GIS1上同源臂-URA3D、验证PGK1p-GIS1U和验证PGK1P-GIS1D、验证URA3-PGK1PU-GIS1和验证URA3-PGK1pD-GIS1进行过表达GIS1基因菌株进行定点验证,可以扩增出大小为1 241 bp、2 312 bp和1 433 bp的特异性片段。与预期大小一致,且阴性对照PCR后无此条带,结果如图3所示。由图3可知,AY12a-gis1突变株已成功构建。
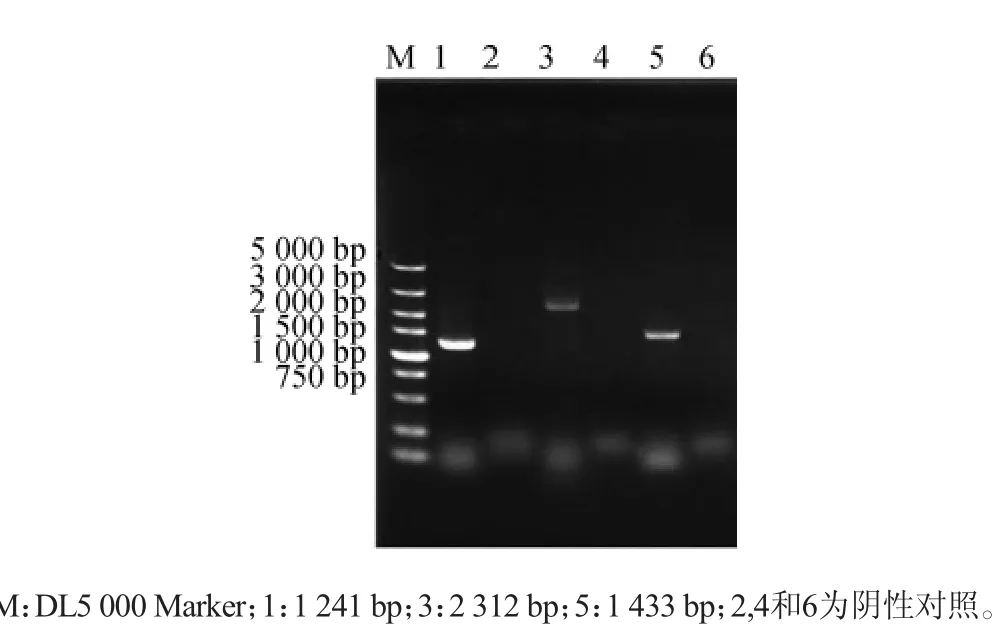
图3 定点PCR验证GIS1电泳图谱Fig.3 Electrophoretogram ofGIS1verification using specific PCR
2.4 酵母基因突变株与亲本菌株生长性能的比较
利用生长曲线测定仪对亲本菌株AY12a和AY12a-gis1突变菌株在进行生长曲线的测定。挑取一环AY12a和AY12a-gis1菌泥接种于5 mL YPED液体培养基中,过夜培养后,按照方法1.3.5对亲本菌株和突变株在30℃和40℃条件下进行生长曲线的测定,结果见图4。
由图4可知,亲本菌株和各个突变株的生长趋势。根据各个菌株的生长速度和最终菌体浓度可以看出,在30℃的培养条件下菌株AY12a-gis1与亲本菌株AY12a的生长速度相比,生长性能基本相一致;当生长温度改为40℃时,AY12a-gis1突变株的菌体浓度较亲本菌株AY12a有所提高,且对数期与亲本相一致。
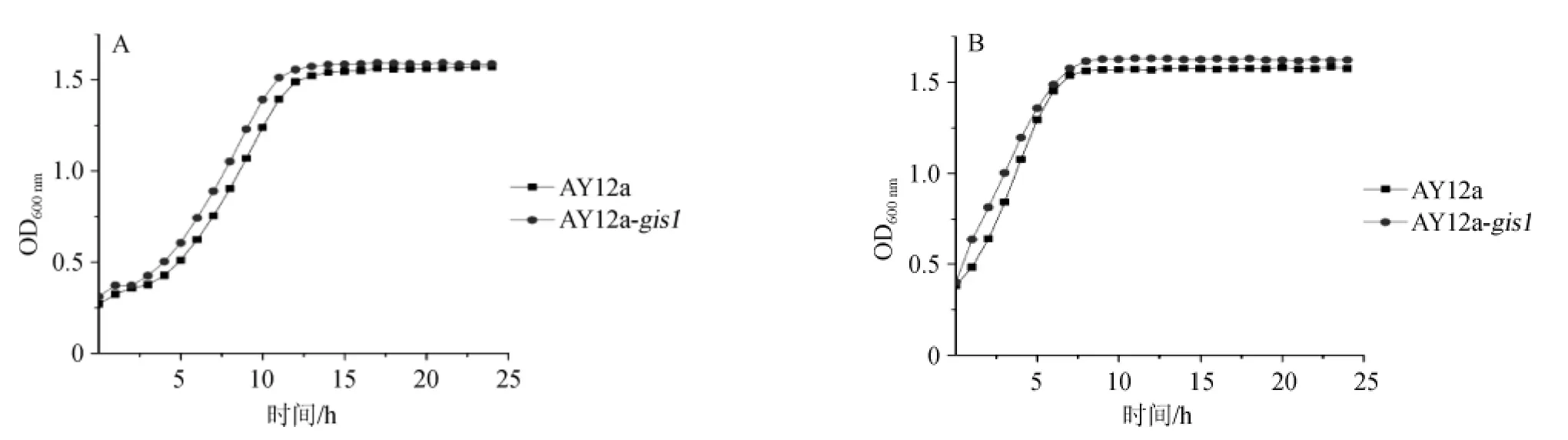
图4 菌株在30℃(A)和40℃(B)条件下的生长曲线Fig.4 Growth curves of strains under the conditions of 30℃(A)and 40℃(B)
2.5 酿酒酵母基因突变株与亲本菌株耐受性的比较
按照材料与方法中1.3.6中所描述的方法测定出发菌株AY12a以及突变菌株AY12a-gis1在55℃热击4 min、15%V/V)的乙醇、6%NaCl及5%(V/V)乙酸的胁迫环境下进行耐受性分析,结果如图5所示。
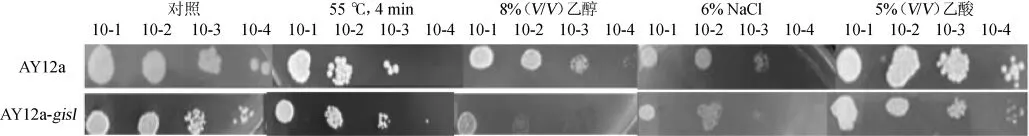
图5 菌株的耐受性Fig.5 Tolerance of strains
由图5可知,在没有生长压力的YEPD平板上,出发菌株AY12a和突变株AY12a-gis1的生长情况基本上是一致的,可见出发菌株以及突变菌株的初始菌体浓度基本上保持是一致的。在55℃热击4 min处理造成的环境压力下,出发菌株和突变菌株的生长都受到了很大程度的抑制。但相比出发菌株,在相同的稀释倍数下,菌株AY12a-gis1菌落数较多,说明其热击抗性优于出发菌株AY12a,在15%(V/V)的乙醇和6%的NaCl条件下,相同的稀释倍数下,AY12agis1突变株的菌落数均低于原菌,说明菌株AY12a-gis1的耐乙醇和耐盐能力并无提高;在5%(V/V)乙酸造成的环境压力下,相比出发菌株AY12a,突变菌株AY12a-gis1在相同的稀释倍数下,菌落个数与原菌AY12a没有差别,说明5%的乙酸对这些突变株的生长没有受胁迫因素的影响。
2.6 酿酒酵母基因突变株与亲本菌株的玉米原料高温浓醪酒精发酵
按照方法1.3.4将改造后的突变株AY12a-gis1和出发菌株AY12a进行玉米高温浓醪发酵。待发酵进行48 h,将发酵液摇匀,取样液,用3层纱布滤去玉米渣,用无菌水稀释至合适倍数,按照方法1.3.7检测48 h细胞存活率,待发酵完成后测定发酵液中乙醇含量和发酵液中残糖的含量。测定结果见表2。

表2 突变菌株的发酵性能和细胞存活率Table 2 Fermentation performance and cell survival rate of mutant strains
由表2可知,在38℃浓醪发酵中,突变株AY12a-gis1与出发菌株AY12a相比,菌株AY12a-gis1的酒度提高了3.79%,残糖略有下降,且发酵时间与亲本菌株相一致。说明菌株AY12a-gis1耐高温性能使乙醇产率明显提高,这与细胞生长曲线的测定结果是一致的,且与耐受性实验也大致相符。酵母细胞发酵时间的延长,常伴随着细胞耐受性的增加,比如高乙醇、高温、高渗透压等。
3 结论
本研究通过PCR扩增出GIS1上同源臂U和GIS1上同源臂D、GIS1-URA3U和GIS1-URA3D、GIS1-PGK1pU和GIS1-PGK1pD、GIS1下同源臂U和GIS1下同源臂D片段。同时以URA3缺陷型菌株AY12aΔU为出发菌株,以正常URA3作为筛选标记,采用醋酸锂转化法通过在GIS1基因的N端加入强启动子PGK1p,以实现GIS1基因的过表达进而对酵母细胞的生长和耐受性进行调节,从而构建出一株耐高温的酿酒酵母菌株。结果表明,相同的稀释倍数下可以看出55℃热击4 min之后菌株AY12a-gis1的生长能力明显优于出发菌株,在含有5%(V/V)乙酸的平板上改造菌和出发菌耐受性相差不大,同时通过38℃浓醪发酵实验发现菌株AY12a-gis1的酒精度提高了3.79%,残糖略有下降,且发酵时间与亲本菌株相一致。因此菌株AY12a-gis1可以很好的用于发酵工业,同时对于工业发酵生产也有重要的应用价值。
[1]温晓瑜,王 靖,王金玲,等.酵母利用木糖发酵发酵生产乙醇的研究进展[J].中国酿造,2011,30(12):12-16.
[2]郭孝孝,罗 虎,邓立康.全球燃料乙醇行业进展[J].当代化工,2016,45(9):2244-2248.
[3]KUMAR A,CAMERON J B,FLYNN P C.Pipeline transport and simultaneous saccharification of corn stover[J].Bioresource Technol,2005,96(7):819-829.
[4]BELLI G,GARI E,ALDEA M,et al.Osmotic stress causes a G1 cell cycle delay and down regulation of Cln3/Cdc28 activity inSaccharomyces cerevisiae[J].Mol Microbiol,2001,39(4):1022-1035.
[5]ROLLINI M,CASIRAGHI E,PAGANI M A,et al.Technological performances of commercial yeast strains in different complex dough formulations[J].Eur Food Res Technol,2007,22(6):19-24.
[6]BAI F W,ANDERSON W A,MOOYOUNG M.Ethanol fermentation technologies from sugar and starch feedstocks[J].Biotechnol Adv,2008,26(1):89-105.
[7]SANCHE Y,LINDQUIST S L.HSP104 required for induced thermotolerance[J].Science,1990,248(4959):2-5.
[8]VERSELE M,THEVELEIN J M,VAN DIJCK P.The high general stress resistance of theSaccharomyces cerevisiaefill adenylate cyclase mutant(Cyr1lys1682)is only partially dependent on trehalose,Hsp104 and overexpression of Msn2/4-regulated genes[J].Yeast,2004,21(1):75-86.
[9]WOLFGANG R,EVA K,VEERLE D W,et al.Yeast protein phosphatase 2A-Cdc55 regulates the transcriptional response to hyperosmolarity stress by regulating Msn2 and Msn4 chromatin recruitment[J].Mol Cellul Biol,2013,33(5):1057-1072.
[10]SWAN T M,WATSON K.Stress tolerance in a yeast lipid mutant:membrane lipids influence tolerance to heat and ethanol independently of heat shock proteins and trehalose[J].Can J Microbiol,1999,45(6):472-479.
[11]BROSNAN M P,DONNELLY D,JAMES T C,et al.The stress response is repressed during fermentation in brewery strains of yeast[J].J Gen Appl Microbiol,2000,88(5):746-755.
[12]IWAHASHI H,OBUCHI K,FUJII S,et al.Effects of temperature on the role of Hsp 104 and trehalose in barotolerance ofSaccharomyces cerevisiae[J].Febs Lett,1997,416(1):1-5.
[13]HAHN J S,HU Z Z,THIELE D J,et al.Genome-wide analysis of the biology of stress responses through heat shock transcription factor[J].Mol Cell Biol,2004,24(12):5249-5256.
[14]YAMAMOTO N,MAEDA Y,IKEDA A,et al.Regulation of thermo tolerance by stress-induced transcription factors inSaccharomyces cerevisiae[J].Eukaryotic Cell,2008,7(5):783-790.
[15]KALGHATGI S,KELLY C M,CERCHAR E,et al.Effects of non-thermal plasma on mammalian cells[J].PLoS One,2011,6(1):1-11.
[16]LACKMANN J W,SCHNEIDER S,EDENGEISER E,et al.Photons and particles emitted from cold atmospheric-pressure plasma inactivate bacteria and biomoleculesindependentlyand synergistically[J].J R Soc,2013,10(89):13-45.
[17]NAKAGAWA Y,SEITA J,KOMIYAMA S.A new simple method for isolating multistress-tolerant semidominant mutants ofSaccharomyces cerevisiaeby one-step selection under lethal hydrogen peroxide stress condition[J].Biosci Biotechnol Biochem,2013,77(2):224-228.
[18]PEDRUZZI I,BÜRCKERT N,EGGER P,et al.Saccharomyces cerevisiaeRas/cAMP pathway controls post-diauxic shift element-dependent transcription through the zinc finger protein Gis1[J].Embo J,2000,19(11):2569-2579.
[19]ZHANG N,WU J,OLIVER S G.Gis1 is required for transcriptional reprogramming of carbon metabolism and the stress response during transition into stationary phase in yeast[J].Microbiology,2009,155(5):1690-1698.
[20]BOY-MARCOTTE E,PERROT M,BUSSEREAU F,et al.Msn2p and Msn4p control a large number of genes induced at the diauxic transition which are repressed by cyclic AMP inSaccharomyces cerevisiae[J].J Bacteriol,1998,1809(5):1044-1052.
[21]SUUTARI M,LIUKONEN K S.Temperature adaptation in yeast:the role of fatty acids[J].J Gen Microbiol,1990,136(8):1469-1474.
[22]HONG K Q,HOU X Y,HAO A L,et al.Truncation of CYR1 promoter in industrial ethanol yeasts for improved ethanol yield in high temperature condition[J].Process Biochem,2018,68:37-45.
[23]付肖蒙,王鹏飞,郝爱丽,等.高耐性酿酒酵母的筛选及其耐受性研究[J].中国酿造,2017,36(10):23-26.
