两种发酵食品对糖尿病模型小鼠血糖及血脂的影响*
2018-06-08晏永球戴关海江石平童应鹏
晏永球,戴关海,江石平,陆 雨,童应鹏,王 平△
(1.浙江工业大学长三角绿色制药协同创新中心,杭州310014;2.浙江省中医药研究院,杭州310007)
诺丽(noni),即海巴戟(Morinda citrifolia L.),茜草科巴戟天属植物,生长于热带及亚热带地区。诺丽含有丰富的化学成分,具有多种药用价值及保健功能。现已从诺丽中分离鉴定了近300种化合物,主要为蒽醌类、木脂素类、黄酮类、萜类和糖苷类等[1]。波利尼西亚土著将诺丽作为民间药物使用已有2000多年历史。由于诺丽果实成熟后有种独特的怪味,不利于食用,故将其发酵后过滤,得到诺丽果汁(诺丽果浆),用于日常饮用及治疗疾病。2010年,我国卫生部正式批准将诺丽果汁列入新资源食品名单。人们普遍认为,它对糖尿病、关节炎、高血压、心脏病等慢性病以及由刀、枪伤伤口感染、疼痛有很好的疗效[2]。现代药理学研究表明,诺丽果汁具有抗氧化、抗菌消炎、镇痛、抗肿瘤、保护肝脏、保护心血管及免疫调节等作用[3-5]。
纳豆(natto),又称“酱豆”,是将蒸煮好的大豆接种纳豆芽孢杆菌(Bacillu Subtilis Natto)后发酵而成的一种风味独特的食品,起源于中国,作为大豆发酵食品已有上千年历史。后传入日本,结合日本的风土人情而演变为“纳豆”[6]。作为一种功能性食品,纳豆在日本深受欢迎,其富含多种易被人体吸收的营养成分,同时还含有纳豆激酶、超氧化物歧化酶、异黄酮等多种生理活性物质[7]。纳豆激酶是纳豆的主要保健成分,具有较强的纤维蛋白溶解特性,因而对血栓及由血栓引起的疾病,诸如冠心病、心绞痛、脑中风等有一定预防及治疗作用。此外,纳豆还具有抗氧化、抗肿瘤、抗菌、降血压、增强免疫等功能[8]。
本实验采用四氧嘧啶建立糖尿病小鼠模型,观察诺丽果汁和纳豆两种发酵食品对糖尿病模型小鼠血糖、血脂等指标的影响,以期为二者的进一步开发及临床应用提供新的线索。
1 材料与方法
1.1 主要试剂与仪器
诺丽果汁(批号:WZ160417),海南万之堂生物科技有限公司提供;纳豆(冻干粉),贵州秀生堂医药生物有限公司提供;四氧嘧啶(批号:37H1381),购自Sigma公司;血糖测定试纸,购自上海荣盛生物有限公司;糖化血清蛋白测定试剂盒、血清胰岛素测定试剂盒、总胆固醇测定试剂盒、甘油三酯测定试剂盒、高密度脂蛋白及低密度脂蛋白测定试剂盒均购自南京建成生物科技有限公司。721型分光光度计(上海精密科学仪器有限公司);GS-6R离心机(Beckman公司);BS210S电子天平(北京Sartorius公司)。
1.2 实验动物
ICR(Institute of Cancer Research)雌性小鼠,体重(22±2)g,由浙江省实验动物中心提供,合格证号:1607040016,实验动物使用许可证号:SCXK(浙)2014-0001,饲养于浙江省中医药研究院的屏障系统动物实验室内(SYXK(浙)2014-0003)。
1.3 糖尿病小鼠模型的建立与处理
ICR雌性小鼠适应性饲养1周。禁食12 h后,一次性尾静脉注射四氧嘧啶(55 mg/kg)。72 h后,将空腹血糖值≥12.00mmol/L、尿糖呈强阳性(+++)者视为糖尿病小鼠模型[9]。将糖尿病模型小鼠随机分为3组(n=10):模型(diabeticalmodel,DM)组、诺丽果汁(noni juice,NJ)组和纳豆(natto,NT)组;另取10只正常ICR雌性小鼠作为正常对照(normal control,NC)组。各组小鼠均每日灌胃给药一次:NC组与 DM组给予纯净水(25.0 ml/kg)灌胃,NJ组给予诺丽果汁(25.0 ml/kg,根据人每天推荐用量80.0 ml折算,实验时每 24.0 ml药液加 1.0 ml纯净水灌胃,NT组给予纳豆(0.6 g/kg,根据人每天推荐用量为 2.0 g折算,用纯净水配成 24.0mg/ml浓度)灌胃,连续30 d。常温饲养,自由进食进水。
1.4 测定指标与方法
实验时按笼记录小鼠的饮水量、进食量。实验第31天,各组动物禁食15 h,末次给药后1.5 h,用血糖试纸测定血糖(blood glucose,BG)。接着各组小鼠分别经口灌胃葡萄糖 2.0 g/kg,测定其后 0、0.5、2 h的血糖值,以观察小鼠的葡萄糖耐量。以股动脉采血法取血,常温下4 000 r/min离心10 min分离血清,分别采用相应试剂盒测定糖化血清蛋白(glycated serum protein,GSP),血清胰岛素(insulin,Ins)及血总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)等指标。
1.5 统计学处理
所有数据以均数±标准差()表示,采用SPSS 22软件进行统计学分析,各组间比较用 t检验。
2 结果
2.1 两种发酵食品对糖尿病模型小鼠饮水量和进食量的影响
与NC组比较,DM组小鼠的饮水量和进食量显著升高(P<0.01,表1);NT组小鼠的饮水量和进食量较DM组降低,且存在统计学差异(P<0.01,P<0.05,表1),而NJ组与DM组比较无显著差异。
Tab.1 Changes in the amount of water drinking and food-intake in induced diabeticmice(,n=10)

Tab.1 Changes in the amount of water drinking and food-intake in induced diabeticmice(,n=10)
NC:Normal controlgroup;DM:Diabeticalmodelgroup;NJ:Noni juice group;NT:Natto group**P<0.01 vs NC;#P<0.05,##P<0.01 vs DM
Group Amount ofwater drinking(ml/100 g BW)Amountof food-intake(g/100 g BW)NC 24.3±6.81 16.3±2.48 DM 139.0±20.63** 31.7±2.21**NJ 143.6±14.74 31.9±1.38 NT 111.7±9.44## 29.5±1.19#
2.2 两种发酵食品对糖尿病模型小鼠糖耐量的影响
在灌胃葡萄糖后 0、0.5、2 h,与 NC组比较,DM组小鼠血糖值及葡萄糖耐量曲线下面积均显著升高(P<0.01),提示 DM组小鼠葡萄糖耐量降低;与DM组比较,NJ组和NT组在灌胃葡萄糖后0.5、2 h血糖值及曲线下面积均下降(P<0.05,表 2),提示诺丽果汁和纳豆可使糖尿病模型小鼠葡萄糖耐量升高。
Tab.2 Changes in glucose tolerance in induced diabeticmice(,n=10)

Tab.2 Changes in glucose tolerance in induced diabeticmice(,n=10)
NC:Normal control group;DM:Diabeticalmodel group;NJ:Noni juice group;NT:Natto group**P<0.01 vs NC;#P<0.05 vs DM
Group Blood glucose level(mmol/L)Area under the curve NC 5.10±0.70 12.40±1.88 9.00±1.09 20.50±2.51 DM 18.80±6.20** 40.10±4.52** 33.5±5.20** 69.90±9.62**NJ 16.90±5.76 34.50±5.22# 28.50±6.91# 60.10±11.32#NT 17.70±5.54 34.60±3.93# 28.50±5.25# 60.40±8.69 0 h 0.5 h 2 h#
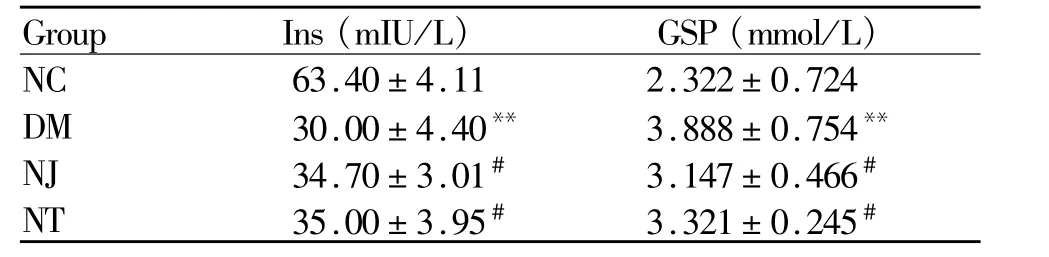
2.3 两种发酵食品对糖尿病模型小鼠血清胰岛素和糖化血清蛋白的影响
与NC组比较,DM组小鼠血清Ins水平显著降低(P<0.01),而其 GSP水平明显升高(P<0.01);与DM组比较,NJ组和NT组小鼠血清Ins水平明显升高(P<0.05),而 GSP水平明显下降(P<0.05,表3)。
Tab.3 Changes in Ins and GSP in induced diabeticmice(,n=10)
Tab.3 Changes in Ins and GSP in induced diabeticmice(,n=10)
NC:Normal controlgroup;DM:Diabeticalmodelgroup;NJ:Noni juice group;NT:Natto group;Ins:Insulin;GSP:Glycated serum protein**P<0.01 vs NC;#P<0.05 vs DM
Group Ins(m IU/L) GSP(mmol/L)NC 63.40±4.11 2.322±0.724 DM 30.00±4.40** 3.888±0.754**NJ 34.70±3.01# 3.147±0.466#NT 35.00±3.95# 3.321±0.245#
2.4 两种发酵食品对糖尿病模型小鼠血脂的影响
与NC组比较,DM组小鼠的 TC、TG、LDL均显著升高(P<0.01),HDL则明显下降(P<0.01);与DM组比较,NT组小鼠的TC、TG、LDL明显下降(P<0.05),HDL则明显上升(P<0.05),而 NJ组小鼠的 TG、LDL明显下降(P<0.01,P<0.05),HDL明显上升(P<0.05,表 4)。NJ组 TC呈下降趋势,但与DM组无显著差异。
3 讨论
糖尿病是一种由于胰岛素分泌缺陷或胰岛素作用障碍所致的以高血糖为特征的代谢综合征,持续高血糖和长期代谢紊乱可引起全身多组织器官损害,甚至功能衰竭,尤易造成肾脏、眼、神经、心脑血管等慢性进行性病变[10]。国际糖尿病联盟2013年统计数据显示,全球糖尿病患者3.82亿,预计2035年将达5.92亿,糖尿病已成为除心脑血管疾病、恶性肿瘤以外的第三大疾病。目前治疗糖尿病的药物以人胰岛素及其类似物占主导地位,其次为DPP-IV抑制剂,GLP-1激动剂及双胍类、磺脲类、α-葡糖苷酶抑制剂、格列酮类等,这些药物均有不同程度的毒副作用。因此,从天然食物中寻找低毒、高效的降糖药是个理想的方向。
诺丽果汁和纳豆均经发酵制成。发酵是一种古老而传统的食物存储与加工方法,在微生物作用下完成的。传统发酵食品历史悠久、品种繁多,如谷物发酵制成的酒、酱油、醋,鲜奶发酵制成的酸奶等。发酵延长食品的保存期,改善食物的质地和风味,深受人们喜爱。许多微生物在代谢过程中,可将一些大分子降解成小分子,不仅易为人体消化吸收,还能产生多种有益的生物活性物质,赋予发酵食品新的保健功能和药用价值。我国很多古典医学著作中记载发酵食品的药用价值,如《本草纲目》中就记载淡豆豉“具开胃增食、消食化滞、发汗解表、除烦平喘”等疗效;《药性论》中收载的神曲具有“健脾和胃、消食调中”的功效。现代药理学研究表明,很多发酵食品具有调血脂、提高免疫力、抑制肿瘤、延缓衰老等作用[11],这也为中药研究提供新的思路与方法。
Tab.4 Changes in blood lipid in induced diabeticmice(mmol/L,珋,n=10)

Tab.4 Changes in blood lipid in induced diabeticmice(mmol/L,珋,n=10)
NC:Normal control group;DM:Diabeticalmodel group;NJ:Noni juice group;NT:Natto group;TC:Total cholesterol;TG:Triglyceride;HDL:High density lipoprotein;LDL:Low density lipoprotein**P<0.01 vs NC;#P<0.05,##P<0.01 vs DM
Group TC TG HDL LDL NC 2.75±0.43 0.70±0.32 1.914±0.468 0.270±0.053 DM 3.38±0.39** 1.14±0.14** 1.321±0.300** 0.340±0.051**NJ 3.03±0.64 0.79±0.41## 1.887±0.712# 0.240±0.057#NT 2.93±0.44# 0.85±0.34# 1.716±0.267# 0.290±0.006#
本实验采用小鼠尾静脉注射四氧嘧啶造模,在无其他外界干预情况下,小鼠病情进行性恶化,空腹血糖明显上升,提示造模成功,同时还伴有饮水量、进食量及尿量增多,毛发枯涩、活动力减弱等症状。模型组小鼠的饮水量、进食量、GSP以及血脂中的TC、TG、LDL等指标均显著升高,葡萄糖耐量、Ins、HDL均显著降低,说明模型小鼠体内糖代谢异常,高血糖使机体产生糖毒性和脂毒性,并破坏机体的部分组织与器官。
结果表明,诺丽果汁和纳豆均能明显降低糖尿病模型小鼠的GSP、TG及LDL,升高葡萄糖耐量、Ins和HDL,进而改善糖尿病小鼠糖、脂代谢紊乱,对糖尿病有一定的防治作用。实验造模使用的四氧嘧啶是一种自由基激活剂,其进入机体后可产生超氧阴离子等自由基,可选择性地破坏胰岛β细胞的膜结构、损伤其DNA,大量β细胞受损与坏死导致胰岛素原合成障碍,胰岛素水平降低,继而引发糖尿病[12]。诺丽果汁与纳豆均具有良好的抗氧化活性和自由基清除能力[1,8],推测二者的降糖机理可能是提高机体的抗氧化能力和免疫力,抑制自由基损伤胰岛β细胞并促进其修复和再生,进而提高糖尿病模型小鼠代谢糖的能力,而糖尿病模型小鼠糖代谢紊乱可导致其脂代谢紊乱,纠正糖代谢障碍有助于纠正脂代谢障碍;其调节血脂的机理可能是通过其抗氧化作用、调节细胞内钙离子的平衡及抑制细胞凋亡等途径,同时增加载脂蛋白A含量,促进HDL的代谢,降低载脂蛋白B含量进而降低LDL水平,以改善糖尿病模型小鼠的血脂情况[5,8]。有关诺丽果汁及纳豆降血糖、调血脂作用的具体机制,尚待进一步深入研究。
[1] Pawlus AD,Kinghorn DA.Review of the ethnobotany,chemistry,biological activity and safety of the botanical dietary supplementMorinda citrifolia L.(noni)[J].JPharm Pharmacol,2007,59(12):1587-1609.
[2] Deng SX,West BJ,Jensen CJ.A quantitative comparison of phytochemical components in global noni fruitsand their commercial products[J].Food Chem,2010,122(1):267-270.
[3] Huang HL,Liu CT,Chou MC,etal.Noni(Morinda citrifolia L.)fruitextracts improve colonmicroflora and exert antiinflammatory activities in Caco-2 Cells[J].JMed Food,2015,18(6):663-676.
[4] Nerurkar PV,Hwang PW,Saksa E.Anti-diabetic potential of Noni:The Yin and the Yang[J].Molecules,2015,20(10):17684-17719.
[5] Lin YL,Chang YY,Yang DJ,et al.Beneficial effects of noni(Morinda citrifolia L.)juice on livers of high-fat dietary hamsters[J].Food Chem,2013,140(1-2):31-38.
[6] 王丽荣,陈 雷,林显华,等.纳豆及纳豆激酶的研究进展[J].广东饲料,2013,22(9):27-29.
[7] 高瑞萍,刘 辉,刘 嘉,等.纳豆的研究进展[J].食品与发酵科技,2011,47(1):23-26.
[8] Tamang JP.Health benefits of fermented foods and beverages[M].New York:CRC press,2015:433-453.
[9] 宋丽君.南瓜多糖对糖尿病大鼠血糖、血脂及氧化应激能力的影响[J].中国应用生理学杂志,2015,31(1):65-66,71.
[10]Hu HL,He L,Li LF,etal.Apelin/APJsystem as a therapeutic target in diabetes and its complications[J].Mol Genet Metab,2016,119(1-2):20-27.
[11]成 黎.传统发酵食品营养保健功能与质量安全评价[J].食品科学,2012,33(1):280-284.
[12]钟 灵,王振富,李玉山.板党多糖对小鼠实验性糖尿病的改善作用[J].中国应用生理学杂志,2014,30(3):241-242,246.
