COX-2与VEGF在皮肤鳞状细胞癌(SCC)及基底细胞癌(BCC)中的表达分析
2018-06-07王霞
王霞
(井冈山大学医学部病理教研室,江西 吉安 343000)
皮肤鳞状细胞癌(squamous cell carcinoma of the skin,SCC)及基底细胞癌(basal cell carcinoma,BCC)为临床最常见的皮肤肿瘤疾病,分别发生于表皮或者附属角质细胞以及基底细胞或者皮肤附件,其发病早期无特异性症状表现,易被医师或患者忽视,导致其失去最佳治疗时机[1]。探寻疾病早期诊断的有效方法对提升治疗效果、改善患者预后具有重要意义。有关研究指出,与其他类型肿瘤相似,皮肤肿瘤亦涉及血管生成、肿瘤细胞恶性增殖、细胞黏附与侵袭、转移等一系列复杂过程[2]。而VEGF为重要的血管生成促进因子之一,可加速血管生成,提高血管通透性,促进肿瘤细胞恶性增殖与转移;COX-2为环氧化酶(COX)主要亚型之一,其不仅可经由各种信号途径对肿瘤细胞增殖及凋亡产生影响,且可加速肿瘤血管生成,促进肿瘤发生、发展[3]。本研究选取因其他疾病手术切除附带正常皮肤切除者36例及SCC、BCC患者各48例为研究对象,旨在进一步分析COX-2、VEGF在SCC、BCC中的表达及其临床意义,现报道如下。
1 资料与方法
1.1 临床资料 选取2013年8月~2017年9月本院SCC与BCC患者分为SCC与BCC组,各48例。另选择36例同期因其他疾病手术切除附带正常皮肤切除者为对照组。SCC组男29例,女19例,年龄27~82岁,平均(63.80±7.25)岁;Broders病理分级:Ⅲ级7例,Ⅱ级9例,Ⅰ级32例。BCC组男27例,女21例,年龄29~81岁,平均(63.21±7.96)岁。对照组男20例,女16例,年龄26~79岁,平均(62.74±8.02)岁。3组性别、年龄等临床资料比较差异无统计学意义,具有可比性,且本研究经医院伦理协会批准。
1.2 入选标准 ①纳入标准:SCC与BCC患者均经手术病理检查证实,入组前未进行光动力治疗、放疗及其他特殊治疗;对照组均为因其他疾病手术切除附带正常皮肤切除者,无恶性肿瘤疾病;3组均知晓本研究并签订知情同意书。②排除标准:合并严重感染、心脑血管疾病以及肝肾功能严重障碍者;依从性差,无法配合研究者。
1.3 方法 以免疫组织化学染色法检测皮肤组织内COX-2、VEGF表达,具体操作为:取皮肤组织以甲醛溶液(浓度:10%)固定,石蜡包埋,切片,进行抗原修复,而后于室温下冷却,以磷酸盐缓冲液进行冲洗,一抗于室温下孵育,以磷酸盐缓冲液洗涤,二抗于37℃环境下孵育,再以磷酸盐缓冲液洗涤,采用二氨基联苯胺溶液显色后进行冲洗、复染、分化、脱水、透明、封片;应用磷酸盐缓冲液替代一抗为阴性对照。
1.4 结果判定 当COX-2、VEGF的染色结果显示细胞质(浆)中出现棕黄色或者棕褐色颗粒则判定为阳性,以半定量计分法进行判定,于高倍镜下选取10个左右视野,分别观察500个细胞,若切片内阳性细胞≥61%为3分,处于31%~60%为2分,处于5%~30%为1分,不足5%为0分;染色强度:棕黄色或者棕褐色为3分,棕色为2分,淡黄色为1分,几乎无染色为0分,免疫反应总得分是阳性细胞百分比和免疫染色强度得分的乘积[4]。
1.5 观察指标 ①3组皮肤组织标本内COX-2、VEGF阳性表达率;②SCC组与BCC组皮肤组织中COX-2、VEGF表达的相关性。
1.6 统计学方法 通过SPSS 19.0分析,计数资料以[n(%)]表示、卡方检验,应用Spearman相关分析探究SCC组与BCC组皮肤组织中COX-2、VEGF的表达的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 3组皮肤组织标本内COX-2、VEGF阳性表达率 SCC与BCC组皮肤组织中COX-2、VEGF阳性表达率均高于对照组,且SCC组皮肤组织中上述指标阳性表达率高于BCC组,差异有统计学意义(P<0.05),见表1。
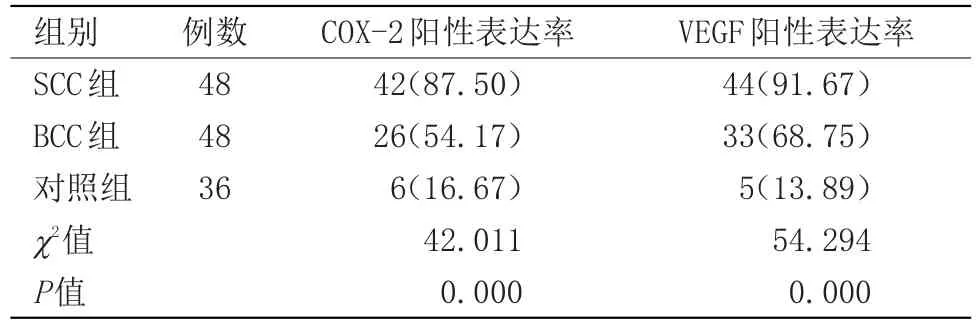
表1 3组皮肤组织标本内COX-2、VEGF阳性表达率比较[n(%)]
2.2 SCC组与BCC组皮肤组织中COX-2、VEGF表达的相关性SCC组与BCC组皮肤组织中COX-2、VEGF的表达呈明显正相关(r=0.442,P=0.021),见表2。
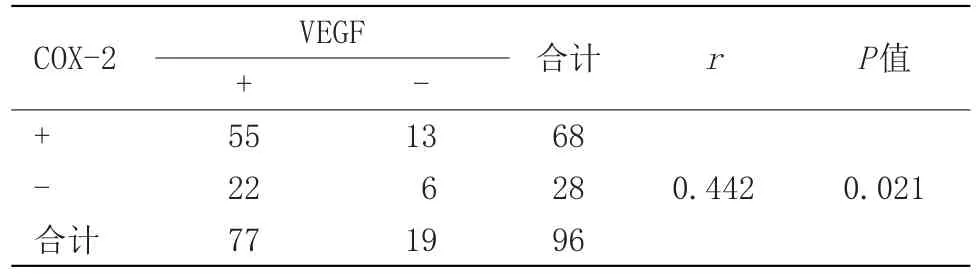
表2 SCC组与BCC组皮肤组织中COX-2、VEGF表达的相关性
3 讨论
SCC与BCC均为皮肤科常见疾病,其中SCC常由黏膜白斑、角化病与其他癌前病变转化形成,生长较为迅速,BCC病因与多个基因突变损伤密切相关,病程较缓慢,由于两者发病早期症状不典型,待疾病确诊时患者病情已产生恶化,治疗难度增加,预后差[5]。故探究SCC与BCC有效的早期诊断方法成为临床研究热点。
有关研究指出,肿瘤新生血管生成为肿瘤生长与转移的基础,而VEGF为一种血管生成促进因子,具有加速血管生成及提高血管通透性的作用,在判定肿瘤新生血管生成状况中具有较高特异性[6-7]。贾志凌等[8]研究指出,VEGF于食管癌、胃癌、肺癌、乳腺癌等多种肿瘤疾病中均呈高表达状态,且表达水平和肿瘤生物学行为具有密切关系。本研究结果显示,SCC与BCC组皮肤组织中VEGF阳性表达率高于对照组。亦说明VEGF表达水平与SCC、BCC发生进展密切相关。且本研究结果中,SCC组皮肤组织中VEGF阳性表达率高于BCC组。分析其原因与SCC、BCC的生物学行为及产生新生血管的能力存在差异,BCC中形成新生血管数量低于SCC,致使其肿瘤细胞所获营养物质不足,恶性增殖少等有关。
环氧化酶(COX)为诱导型前列腺素内源性过氧化物酶之一,主要存在于哺乳动物的细胞微粒体内,包括COX-2、COX-1两种亚型,其中COX-1属结构性酶,多存在于正常组织中,病理状态下水平几乎不变;COX-2属诱导型酶,正常生理状态下表达极低,而当受到癌基因产物、炎性因子等刺激后,其可于细胞中被快速诱导产生[9]。有关研究指出,COX-2不仅为炎症反应启动的关键酶,且在多种肿瘤中均有不同程度表达,同时可经由加速肿瘤新生血管生成、促进肿瘤细胞增殖并阻止其凋亡等机制参与肿瘤发生、进展中[10]。本研究结果显示,SCC与BCC组皮肤组织中COX-2阳性表达率均高于对照组,且SCC组皮肤组织中COX-2阳性表达率高于BCC组。说明COX-2表达水平与SCC、BCC发生进展具有密切关系,且其表达水平可用于鉴别SCC、BCC。另由本研究结果可知,SCC组与BCC组皮肤组织中COX-2、VEGF的表达呈明显正相关。提示在SCC与BCC中COX-2、VEGF的表达可相互促进,一同加速肿瘤发生及进展。
综上所述,SCC与BCC患者中COX-2、VEGF均呈异常表达状态,且两者有相互促进作用,对其表达水平进行检测有助于为疾病早期诊断提供可靠依据。
[1] 焦亚宁,葛新红,董灵娣,等.宁夏地区皮肤基底细胞癌、鳞状细胞癌及黑素瘤1792例回顾性分析[J].临床皮肤科杂志,2014,43(2):77-79.
[2] 胡雪英,吴秀娟,普雄明.血管内皮生长因子在皮肤肿瘤发病机制中的研究进展[J].医学综述,2016,22(19):3791-3794.
[3] 曹清,程波,聂静,等.COX-2介导肿瘤相关成纤维细胞在乳腺癌进展中的作用研究[J].当代医学,2017,23(6):15-17.
[4] 孙祺琳,陈军.皮肤鳞状细胞癌及基底细胞癌中环氧化酶-2与血管内皮生长因子的表达[J].中国老年学杂志,2017,37(2):403-405.
[5] 李东霞,蒋苏,杨丽敏.埃兹蛋白在皮肤鳞癌、基底细胞癌中的表达及相关研究[J].中国中西医结合皮肤性病学杂志,2014,13(6):345-348.
[6] 闫铁夫,何晓楠,孙健,等.皮肤基底细胞癌及鳞状细胞癌组织中分化抑制因子-1、血管内皮生长因子、凝血酶敏感蛋白-1、微血管密度表达状况及意义[J].中国老年学杂志,2016,36(20):5051-5053.
[7] 张泳,王建华,李迎春.PTTG和VEGF在肺癌组织中的表达及其意义[J].当代医学,2014,20(24):4-5.
[8] 贾志凌,杨永昌,张淑艳,等.血管内皮生长因子诊断多种恶性肿瘤临床价值[J].中华实用诊断与治疗杂志,2015,29(7):701-702.
[9] 刘明明,朱玉洁,王鑫,等.环氧合酶-2表达与皮肤癌发生相关性的Meta分析[J].哈尔滨医科大学学报,2016,50(1):85-89.
[10]张红,邬时国,干亚丹.COX-2和HIF-1α在皮肤癌中的表达及与血管生成的关系[J].中国现代医生,2013,51(10):35-37.
