胃复安联合昂丹司琼治疗预防无效的术后恶心呕吐的临床观察
2018-06-07徐晓燕
徐晓燕,张 成
(四川省成都市妇女儿童中心医院麻醉科 610091)
术后恶心呕吐(postoperative nausea and vomiting,PONV)发生率为30%~50%,而女性、PONV史及围术期应用阿片类药物的患者其PONV发生率可达70%~80%[1]。大量研究表明,预防性使用止吐药,可以有效降低PONV发生率[2-3]。然而,预防性应用止吐药物后,预防无效的PONV发生率仍约25%,具有PONV风险因素患者则高达30%~50%[4-6]。并且,预防无效的PONV对止吐药治疗反应率较低[4,7]。优化预防无效的PONV补救治疗效果是围术期PONV防治的重要内容,而目前国内外相关研究较为缺乏。本研究在伴有PONV风险因素的妇科腔镜手术患者中,观察胃复安联合昂丹司琼对预防无效的PONV的补救治疗效果及安全性。
1 资料与方法
1.1一般资料 本研究采用前瞻性、随机、对照试验设计。受试者纳入标准:因非恶性肿瘤疾病(子宫肌瘤、卵巢囊肿等)拟行全身麻醉下气腹腹腔镜手术,年龄18~60岁,美国标准协会(ASA)分级Ⅰ/Ⅱ级,预计手术麻醉时间大于1 h,自愿加入本研究并签署知情同意书。本研究方案获得本院伦理委员会批准执行。排除标准:对5-HT3受体阻滞剂及胃复安过敏或存在禁忌的患者;妊娠或计划妊娠及哺乳期患者;术前24 h内应用其他具有止吐作用药物的患者;存在肠梗阻、术前接受放、化疗或其他致吐因素的患者;术前存在严重高血压、糖尿病、心律失常等疾病的患者;术前存在内分泌功能异常的患者;认知功能或情感障碍无法配合研究的患者。手术麻醉时间小于1 h或大于3 h的患者,或术中发生心搏骤停、严重失血等不良事件者退出本研究。
1.2方法 所有患者均采用咪达唑仑(0.03 mg/kg)丙泊酚(1.5~2.5 mg/kg)、舒芬太尼(0.4~0.5 μg/kg)静脉注射行麻醉诱导,待患者意识消失后,给予罗库溴铵(0.6 mg/kg)静脉注射,行气管插管。术中采用丙泊酚及七氟烷维持麻醉,瑞芬太尼0.2 μg·kg-1·min-1持续泵注,调整药物剂量维持患者麻醉深度于40~60分。术中间断注射舒芬太尼及罗库溴铵维持镇痛和肌松作用。术中所有腹腔镜手术及麻醉均有同一组外科医生或麻醉医生执行。所有受试者术后均行舒芬太尼为基础的患者静脉自控镇痛(PCIA),至术后48 h。研究于2014年2月至2016年3月共纳入合格受试患者460例。所有患者均于麻醉诱导后静脉注射地塞米松5 mg,术毕前静脉注射托烷司琼2 mg,行PONV预防。术后48 h内发生PONV的患者126例。采用研究方案预先制订的计算机随机数字表将此126例预防无效的PONV患者随机分为对照组(n=62)、研究组(n=64)。对照组患者给予昂丹司琼4 mg静脉注射行补救治疗;研究组患者静脉输注昂丹司琼4 mg+静脉滴注胃复安0.2 mg/kg行补救治疗。
1.3观察指标及评估方法 观察并记录两组患者年龄、身高、体质量、ASA分级、吸烟史、PONV史、麻醉时间(麻醉诱导至气管导管拔出)等患者及手术一般资料;给予补救性止吐药物即刻、给药后1、2、4、24、48 h,采用数字评分量表(NRS)评估患者恶心严重程度;评价给药后两组患者给药后PONV的完全反应率(complete remission,CR),即未发生干呕或呕吐,或未采用其他补救性止吐药物治疗患者比例[3];给药后24、48 h采用Osoba恶心呕吐量组块评估PONV对患者食欲、睡眠、机体活动、社交活动、享受生活等的影响(1分=无影响,2分=轻度影响;3分=中度影响;4分=重度影响,观察两组中生活质量未受PONV影响患者的比例)[8]。观察围术期止吐药相关的头昏、皮疹、心律失常等不良反应的发生率。

2 结 果
2.1一般资料 术后24 h发生者79例,占62.7%,术后24~48 h内发生者47例,占37.3%。研究组与对照组患者年龄、体质量、ASA分级、麻醉时间及PONV相关危险因素构成比等一般资料差异无统计学意义(P>0.05)。见表1。

表1 患者一般资料及围术期相关指标组间比较
2.2患者PONV给药后CR 给药后24 h内、24~48 h及48 h内研究组CR为64.0%~75.0%,对照组患者CR为43.5%~53.2%,差异有统计学意义(P<0.05),见表2。
2.3患者恶心NRS评分 给药即刻两组患者恶心NRS评分组组间差异无统计学意义(P>0.05);给药后1、2、4 h时研究组恶心NRS评分均低于对照组,差异有统计学意义(P<0.05);给药后24、48 h时两组恶心NRS评分差异无统计学意义(P>0.05)。见表3。
2.4PONV对患者生活质量的影响 Osoba恶心呕吐组块评估给药后24 h研究组患者中生活质量,包括食欲、机体活动、享受生活方面未受影响的比例高于对照组,差异有统计学意义(P<0.05);研究组中未影响睡眠和社交活动的患者比例高于对照组,但差异无统计学意义(P>0.05);给药后48 h两组间未受影响患者比例差异无统计学意义(P>0.05),见表4。
2.5药物相关不良反应发生率 研究组7例患者(10.9%)发生药物相关不良反应,其中头昏3例,失眠2例,腹泻1例,便秘1例;对照组6例患者(9.7%)发生药物相关不良反应,其中头昏2例、头痛1例,便秘2例,心动过缓1例,两组间不良反应发生率差异无统计学意义(P>0.05)。未见患者出现心律失常。所有不良反应均自行缓解或处理后缓解。
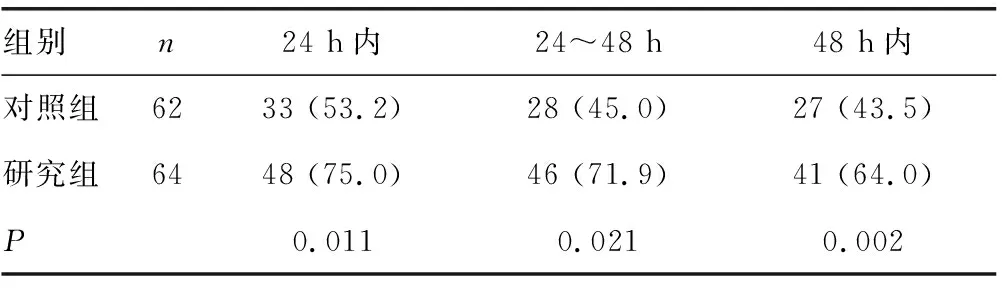
表2 两组患者给药后不同时段CR[n(%)]
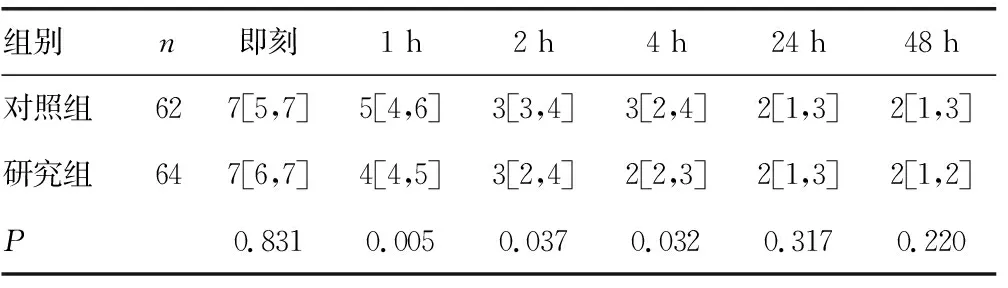
表3 两组患者给药后不同时点恶心NRS评分 (M[QR])
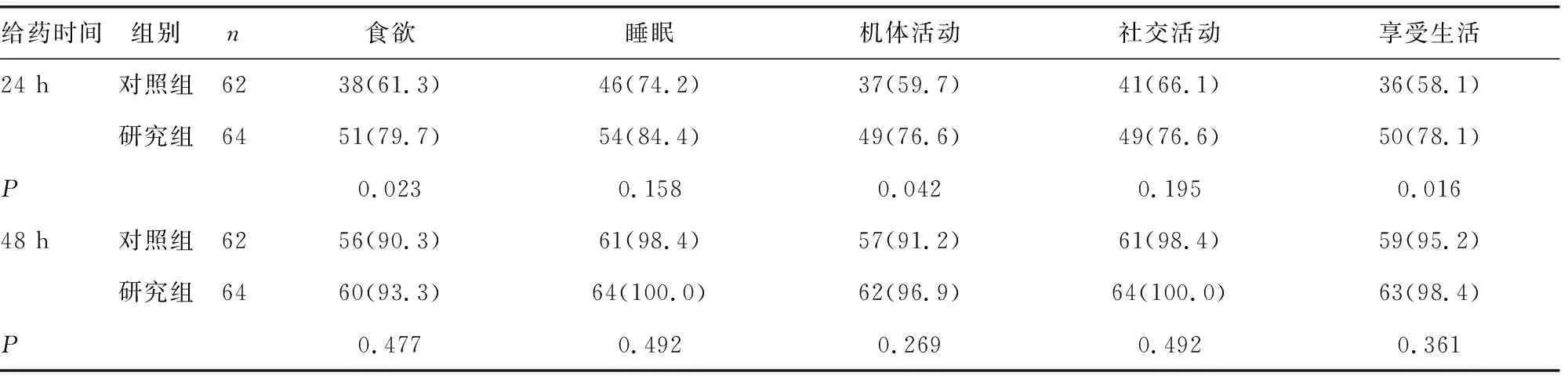
表4 Osoba组块评估两组生活质量未受影响的患者比例[n(%)]
3 讨 论
本研究结果显示,预防失败的PONV患者补救性使用昂丹司琼后24 h的CR 50%左右,胃复安复合昂丹司琼24 h CR率可提高至75.0%,显著降低患者恶心严重程度及减轻PONV对患者术后生活质量的影响;并且联合用药未增加药物相关不良反应,具有较好的安全性。
女性、非吸烟者、PONV史、术后使用阿片类药物是PONV的危险因素[9]。对于PONV风险患者,目前研究推荐采用不同作用机制药物行多模式防治[1,10]。本研究中纳入的患者均为PONV中、高危患者,术前采用不同作用机制的地塞米松和托烷司琼行PONV预防。结果显示,460例接受预防的患者中,仍有27.4%(126例)的患者预防无效,于术后48 h内发生了PONV。尽管这一发生率较前期文献报道的70%~80%明显降低,但提示预防无效的PONV发生率仍然较高,其补救治疗亦是围术期管理的重要问题。
对于预防无效的PONV患者的补救治疗,目前临床推荐采用与预防用药作用机制不同的药物。KOVAC等[11]研究发现,对于昂丹司琼预防无效的PONV患者,再次使用昂丹司琼进行治疗有效率与安慰剂无显著差异。KRANKE等[4]新近研究发现,NK-1受体阻滞剂维替匹坦治疗昂丹司琼预防无效的PONV,减少恶心及干呕方面较昂丹司琼更有效(CR:65%vs. 42%)。
本研究中,PONV预防采用地塞米松和托烷司琼,补救治疗采用胃复安和昂丹司琼,预防与治疗药物作用机制存在差异,也存在一定交叉。这主要是受药物可选择种类所限,目前国内NK-1受体阻滞剂主要用于化疗诱发的恶心呕吐治疗,而未用于PONV的预防治疗。基于安全性及有效性等多方面考虑,补救镇痛药选择了同属5-HT3受体阻滞剂的不同种药物。结果显示单用昂丹司琼行补救治疗的有效率53.2%,高于KRANKE[10]研究结果。胃复安联合昂丹司琼治疗可提高20%的CR,并且显著降低患者恶心严重程度及PONV对患者生活质量的影响。出于伦理学考虑,本研究未设置安慰剂组或空白对照组。
本研究选择中、高危的妇科腔镜手术患者进行围术期PONV预防与治疗干预研究,研究人群具有一定局限性。KRANKE等[12]研究纳入的受试者亦为存在危险因素的外科手术患者。目前尚少有研究报道PONV治疗存在性别及人群等方面的差异,然而存在不同危险因素的患者对PONV治疗的反应性是否存在差异尚需进一步探索。关于PONV补救治疗相关研究较少的原因之一在于研究需要筛选大量患者才能获得足够的入组患者[12-13]。本研究纳入患者数量相对较少,是本研究的局限之处。
综上所述,对于PONV预防无效的妇科腔镜手术患者,与单用昂丹司琼治疗相比,胃复安联合昂丹司琼可提高PONV治疗有效率,降低PONV对患者生活质量的影响,且具有较好的安全性。
[1]GAN T J,DIEMUNSCH P,HABIB A S,et al.Consensus guidelines for the management of postoperative nausea and vomiting[J].Anesth Analg,2014,118(1):85-113.
[2]吴新民,罗爱伦,田玉科,等.术后恶心呕吐防治专家意见(2012)[J].临床麻醉学杂志,2012,28(4):413-416.
[3]许楠,袁维秀,田鸣,等.以安慰剂为对照评价国产盐酸帕洛诺司琼注射液预防术后恶心呕吐的有效性和安全性[J].临床麻醉学杂志,2014,30(7):651-655.
[4]KRANKE P,THOMPSON J P,DALBY P L,et al.Comparison of vestipitant with ondansetron for the treatment of breakthrough postoperative nausea and vomiting after failed prophylaxis with ondansetron[J].Br J Anaesth,2015,114(3):423-429.
[5]HAHM T S,HWANG J W,KIM W H,et al.A prospective,randomized,double-blind,multicenter trial to evaluate the therapeutic efficacy and safety of palonosetron in the treatment of postoperative nausea and vomiting over a 72-h period[J].J Anesth,2015,29(1):21-28.
[6]CANDIOTTI K A,NHUCH F,KAMAT A,et al.Granisetron versus ondansetron treatment for breakthrough postoperative nausea and vomiting after prophylactic ondansetron failure:a pilot study[J].Anesth Analg,2007,104(6):1370-1373.
[7]HABIB A S,REUVENI J,TAGUCHI A,et al.A comparison of ondansetron with promethazine for treating postoperative nausea and vomiting in patients who received prophylaxis with ondansetron:a retrospective database analysis[J].Anesth Analg,2007,104(3):548-551.
[8]MARTIN C G,RUBENSTEIN E B,ELTING L S,et al.Measuring chemotherapy-induced nausea and emesis[J].Cancer,2003,98(3):645-655.
[10]KRANKE P.General multimodal or scheduled risk-adopted postoperative nausea and vomiting prevention:just splitting hairs[J].Br J Anaesth,2015,114(2):190-193.
[11]KOVAC A L,O′CONNOR T A,PEARMAN M H,et al.Efficacy of repeat intravenous dosing of ondansetron in controlling postoperative nausea and vomiting:a randomized,double-blind,placebo-controlled multicenter trial[J].J Clin Anesth,1999,11(6):453-459.
[12]KRANKE P,EBERHART L H.Possibilities and limitations in the pharmacological management of postoperative nausea and vomiting[J].Eur J Anaesthesiol,2011,28(11):758-765.
[13]JOKINEN J,SMITH A F,ROEWER N,et al.Management of postoperative nausea and vomiting:how to deal with refractory PONV[J].Anesthesiol Clin,2012,30(3):481-493.
