HP感染与IgA肾病临床指标的关系及其对IgA肾病患者预后的影响*
2018-06-07李海剑程根阳任东升陶雅非王建刚李玉东
李海剑,程根阳,刘 慧,任东升,陶雅非,王建刚,李玉东
(1.郑州大学附属南阳市中心医院肾病风湿免疫科,河南南阳 473009;2.郑州大学第一附属医院肾内科,郑州 450052;3.郑州大学附属南阳市中心医院心内科,河南南阳 473009)
IgA肾病是临床常见的一种肾小球疾病,多数患者以肉眼血尿反复发作并伴有不同程度的蛋白尿为主要临床表现[1]。关于IgA肾病的发病机制仍处在热议讨论中,可以明确的是以IgA为主的免疫球蛋白沉积而引起的炎症介质免疫反应疾病[2]。研究数据显示,我国的慢性肾病发病率为10.8%,其中有50%以上的患者属于IgA肾病[3]。在过去的几十年里,临床医师们一直认为IgA肾病的预后良好[4],然而随着肾病成为我国重大的卫生公共问题,肾活检的广泛开展,临床已经证实有20%~50%的IgA肾病患者最终发展成为慢性肾衰竭,仅有5%~10%的患者病情得到有效缓解[5]。同时研究还发现,高血压、高龄、家族遗传史及男性罹患IgA肾病的风险较大[6]。所以对于高危人群定期进行尿蛋白、尿红细胞等临床指标检查是必要的预防手段。关于IgA肾病的致病因素[7],医学界进行了深入研究,发现除了人体自身免疫功能低下时可引起IgA分子乘虚而入导致炎性反应形成疾病这一因素外,细菌和病毒感染也成为主要的发病原因[8],包括上呼吸道感染和肠胃炎等疾病,患者起初症状为咳嗽、胃肠功能紊乱,而在发热1~2 d后病毒或细菌感染扩散在肾脏组织,引发IgA肾病。近几年来,越来越多的研究证据显示,幽门螺杆菌(HP)感染是参与机体急慢性炎症介质免疫反应的重要病原体,而IgA肾病的发生和发展与HP感染存在密切的联系[9]。根据相关文献报道,在不同地域和不同时间里对IgA肾病患者进行胃部活检或其他检验手段发现有32%~78%患者属于HP感染[10]。目前,关于讨论HP感染与IgA肾病的危险因素研究很多。普遍认为HP定植在胃部后无法自愈而使机体出于感染状态,蔓延至其他器官组织中,引起慢性炎症和免疫反应。HP感染在一定程度是影响IgA肾病患者的临床指标变化和预后情况。
1 资料与方法
1.1一般资料 选取2013年1月至2016年12月于南阳市中心医院和郑州大学一附院肾内科接受诊治的IgA肾病患者237例。其中男134例,女103例;年龄小于60岁的患者102例,年龄大于或等于60岁的患者135例;疾病史:高血压65例,高脂血症48例,糖尿病26例,心脏疾病19例,急性肠胃炎47例,扁桃体炎32例;临床分型表现:单纯血尿者61例,肾炎综合征者93例,肾病综合征者46例,肾功能不全者37例;世界卫生组织病理Ⅰ级27例,Ⅱ级32例,Ⅲ级86例,Ⅳ级49例,Ⅴ级43例;有吸烟史的患者109例,无吸烟史的患者128例;有酗酒史的患者132例,无酗酒史的患者105例;本地户口158例,外地户口79例。病例参照中华医学会肾脏病学学分会制定的《IgA肾病的诊断、辨证分型(试行方案)》的标准[11]:(1)患者出现肉眼血尿或经尿常规检查可见镜下血尿;(2)患者伴有中、轻度蛋白尿;(3)患者光镜下可见肾脏毛细血管增生样改变、膜区嗜复红蛋白沉积,镜下弥漫性肾小球基底膜变薄;(4)免疫荧光下可见IgA为主的免疫球蛋白系膜区成团块状沉积。HP感染标准[12]:(1)患者出现发热、恶心、口臭等症状;(2)患者血液或尿液白细胞指数异常升高;(3)经14C尿素呼气时间结构为阳性。排除标准[13]:(1)过敏性紫癜肾炎患者;(2)慢性酒精肝硬化患者;(3)乙肝病毒感染或红斑狼疮患者;(4)链球菌感染的肾小球肾衰患者;(5)肿瘤患者。所有患者知情同意,并签署知情同意书,研究经医院伦理委员会批准通过。
1.2研究方法 经过14C尿素呼气试验结果,将237例IgA肾病患者分为感染组与非感染组,比较两组患者的临床指标变化,包括24 h尿蛋白定量(24 h-UP)、尿微量清蛋白(mAlb)、血清清蛋白(Alb)、血清IgA1、尿红细胞(BLD)、收缩压(SBP)、舒张压(DBP)、胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL-C)及低密度脂蛋白(LDL-C),同时分析HP感染对IgA 肾病患者的炎性细胞浸润、肾小管萎缩、肾小球增生硬化、肾间质纤维化、动脉壁肥厚和新月体形成等发生情况判断对预后的影响。
1.3检查方法 所有患者进行相关临床指标检测前需禁食水超过8 h,于清晨采集前臂外周静脉血5 mL,置于Allegra X-15R 型台式冷冻离心机内以10 200 r/min离心10 min,将分离血清取出放置冷冻环境下保存待检;患者从早晨8:00点至次日早晨8:00收集每次尿液中段装于检测试管中;其中Alb、24 h-UP及mAlb 采用双缩脲比色法,IgA1采用ELISA双抗体夹心法,BLD采用胶体金单克隆的抗体隐血法进行检测,TC、TG、HDL-C及LDL-C测定采用迈瑞BS-380全自动生化分析仪、人血脂ELISA试剂盒(采购于武汉盛世达医疗设备公司)进行检验,血压指标以YXY-60医用电子血压仪检测(采购于北京东华原医疗设备有限公司)。患者肾活检,对患者进行肾穿刺采集活检样本,于零下25 ℃环境中冷冻切片,厚度3 μm,然后进行HE染色,在光镜下观察有无肾小球及肾质间、肾小管是否发生病变,评估病理性质和程度。
1.4评价标准 根据患者肾活检结果,以Katafuchi IgA肾病积分标准判断患者预后情况[14],总分值为1~27分,肾小球细胞增殖程度1~4分,节段损害积分0~4分(包括新月体、粘连和节段硬化程度),球性硬化积分0~4分(包括球性硬化肾小球所占肾小球总数的百分比计算)其中0分无、1分小于10%;2分10%~25%、3分25%~50%、4分小于50%;肾小管间质积分(0~9分)(以病变所占皮质肾组织面积的百分比计算):间质炎细胞浸润(0~3分),间质纤维化,肾小管萎缩(0~3分);血管积分(0~6分)(以病变血管所占百分比计算)血管壁增厚(0~3分)(以横切面下血管内径/外径小于0.5 μm),透明样变性(0~3分)其中0分无、1分小于25%、2分25%~50%、3分小于50%。

2 结 果
2.1IgA肾病患者HP感染情况 经14C尿素呼吸试验发现237例IgA肾病患者中有102例患者为阳性,感染率为43.04%。
2.2患者临床基线与HP感染率分析 将感染患者与非感染患者的临床基础情况进行比较,结果发现IgA患者中年龄、高血压、急性肠胃炎、扁桃体炎、血尿及肾病综合征是HP感染的危险因素(P<0.05)。见表1。
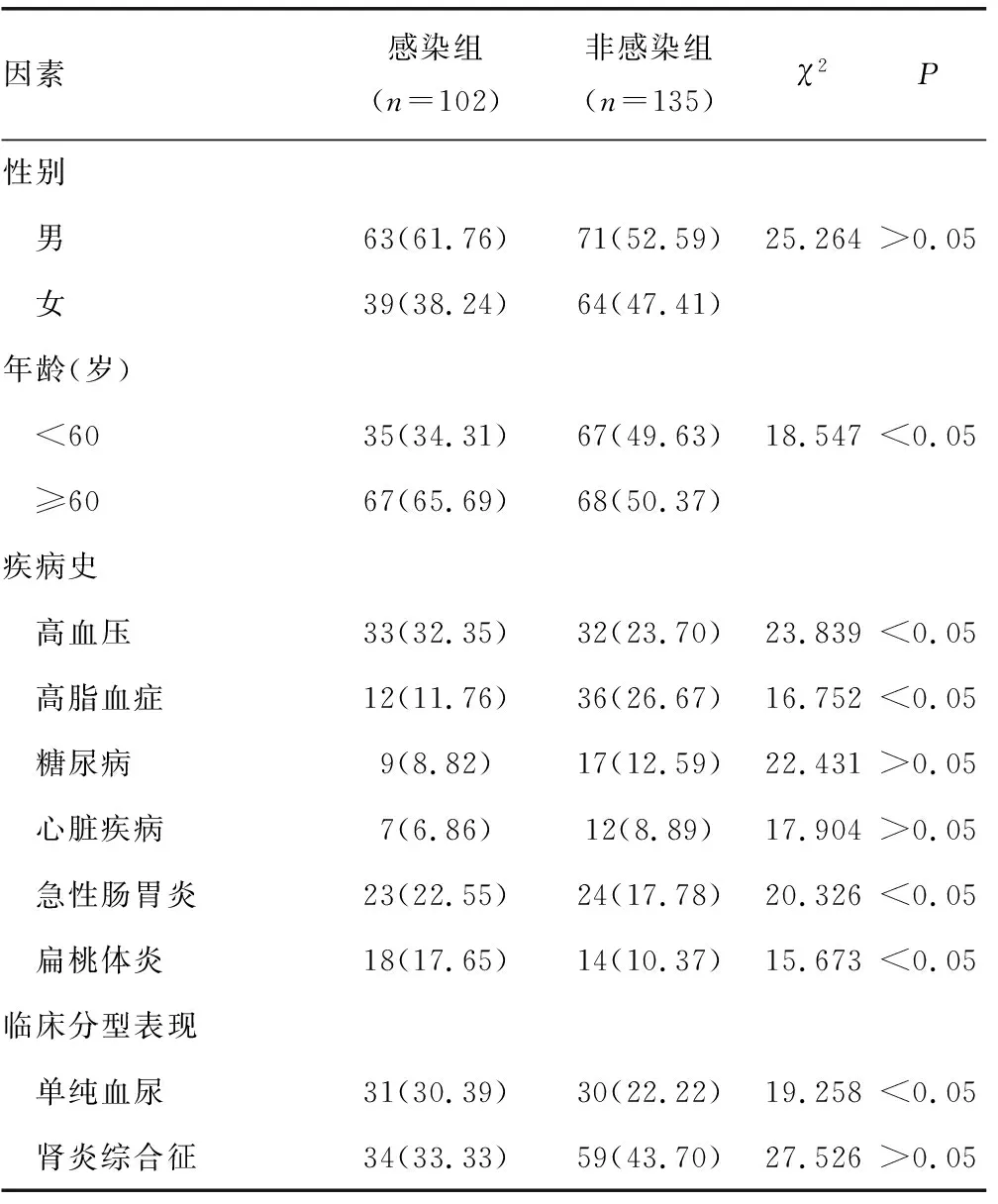
表1 患者临床基线与HP感染率比较[n(%)]

续表1 患者临床基线与HP感染率比较[n(%)]
2.2患者临床指标分析 感染组患者的24 h-UP、mAlb 、Alb、IgA1、BLD、SBP、DBP、TC、TG、HDL-C及LDL-C指标数值均比非感染组患者变化明显(P<0.05),见表2。

表2 患者的临床指标比较
2.3患者肾活检病理指标分析 IgA肾病患者进行肾活检测后,发现感染组患者发生炎性细胞浸润、肾小管萎缩、肾小球增生硬化、肾间质纤维化、动脉壁肥厚和新月体形成的情况明显高于非感染组患者(P<0.05),见表3。
2.4患者预后分析 根据Katafuchi积分标准,感染组患者的各项积分分值明显高于非感染组(P<0.05),见表4。
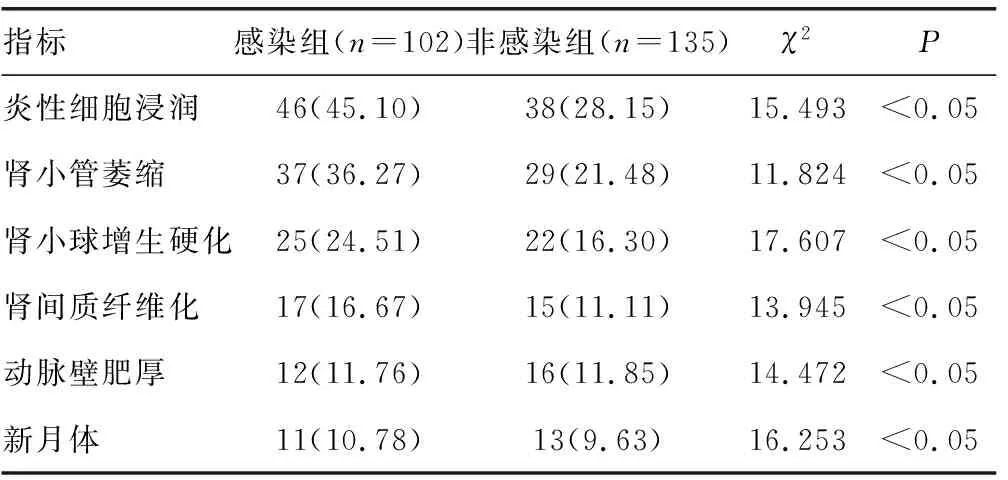
表3 患者的肾活检病理指标比较[n(%)]
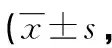
表4 患者的Katafuchi积分比较分)
3 讨 论
IgA肾病是肾小球肾炎的免疫反应疾病,由于其临床表现复杂多样,预后效果评估也存在差异[15]。据调查,不同国家地域和种族的IgA肾病发病率也有所不同,可能与遗传、疾病史和环境因素相关[16]。长久以来,临床早期认为IgA肾病的预后良好,然而有研究发现不同的临床表现和指标,患者的预后也各有不同,大量临床病例显示IgA肾病成慢性发展,最终成为终末期肾衰竭,IgA肾病患者5年内肾存活率为85%,10年为57%,可见病情的恶化程度比较严峻[17]。其中高龄、高血压及肾病综合征患者是IgA肾病的主要危险因素,有超过25%的患者临床表现为肉眼血尿、血脂、血压异常,同时出现不同程度的肾脏病理损害[18]。近年来,多项研究发现HP感染是IgA肾病的重要致病因素,关于围绕两者之间相关影响的研究逐渐增多。HP是一种螺旋状的革兰阴性杆菌,主要定植在胃部,引发萎缩性胃炎和消化道溃疡等疾病,并且与淋巴瘤、胃癌的发病有直接关系。HP的抗原机制可以诱使机体产生免疫反应,从而引起一系列的免疫系统疾病,包括心脏病、缺铁性贫血、肝硬化及糖尿病等[19]。根据相关研究报道,在大多数IgA肾病患者的血清中能够检识出抗HP抗体,有超过70%的IgA肾病患者的抗HP抗体在肾小球毛细血管壁呈颗粒样沉积阳性表达,并且在众多的IgA肾病患者中有超过85%的患者曾经患有肠胃炎或扁桃体炎[20]。这些临床数据已不能用偶然巧合来解释,越来越多的专家学者着重于研究HP感染对IgA肾病临床指标和预后是否存在严重影响,在众说纷纭的致病机制因素中,黏膜感染、IgA1分子的沉积和免疫功能异常得到了普遍的认可,正是这些因素的趋势导致患者出现血尿、大量蛋白尿及肾功能异常等。本次研究针对IgA肾病患者进行了HP测试,结果发现有43.04%的患者属于HP感染,其中HP感染者中以高龄、高血压、急性肠胃炎史、扁桃体炎史、血尿及肾病综合征的患者居多,与多数文献报道的危险因素基本一致。将两组患者的临床指标进行比较发现,感染组患者的24 h尿蛋白定量、尿微量清蛋白、血清清蛋白、血清IgA1、尿红细胞、血压及血脂指标均比非感染组患者变化严重,尿液中的蛋白定量和红细胞是判断肾脏病变的重要指标,其数值升高越明显说明肾脏功能改变越严重。有研究表示,IgA肾病患者的血清IgA1水平明显升高者可达55%,这应该是与发病时IgA1分子的结构异常改变有关[21-22]。研究中还发现感染组患者的血压和血脂都表现异常,可能是IgA肾病患者的病程较长且多为老年患者,患有高血压和高脂血症居多,又因为高龄患者合并多种疾病时免疫力低下,容易发生感染加重病情。目前,我国肾活检应用与临床诊断和判断肾病患者预后比较广泛,并且也具备科学的可信度,通过对研究中的患者进行肾活检,发现感染组患者发生炎性细胞浸润、肾小管萎缩、肾小球增生硬化、肾间质纤维化、动脉壁肥厚和新月体的病例明显多于非感染组;并且在Katafuchi积分比较中,感染组患者的分值也相对较高,肾小球增生硬化是肾脏疾病预后的重要指标。炎性细胞浸润和肾间质纤维化是多种肾脏炎性疾病的恶化发展趋势,肾小管萎缩、动脉壁肥厚和新月体的形成都说明肾脏发生病理性损害,显然HP感染的IgA肾病患者在肾损伤程度上较为严重,能够增加患者发展成肾脏衰竭的危险,对预后有严重的影响[23]。与此同时还发现,患者中发生炎性细胞浸润的情况最多,由于导致肾间质纤维化的主要因素是炎性细胞浸润,如果可以控制HP感染,降低炎性介质的释放,可以缓解炎性细胞发生浸润,应该能够降低患者慢性肾衰的发生风险。
综上所述,HP感染能够加重IgA肾病患者的血尿和尿蛋白增多,并且加速IgA1分子的沉积,影响患者的血压与血脂水平,能够造成患者肾脏严重损伤,产生不良预后。研究提示HP感染应该是导致IgA肾病的重要因素,然而目前对于这两者之间的发病机制尚未有明确的研究定论,仍需要大量样本进行深入研究,为临床因病施治、对因治疗提供更科学的依据。
[1]马欣,樊均明.幽门螺杆菌感染与IgA肾病的发生与发展[J/CD].中华肾病研究电子杂志,2014,3(2):73-74.
[2]JEGATHEESAN D,NATH K,REVALDEEN R,et al.Epidem iology of biopsy proven glom erulonephritis in Queensland adults[J].Nephmlogy,2016,21(1):28-34.
[3]李俊,沈颖.影响IgA肾病预后因素研究进展[J].中国社区医师,2017,33(1):8-9.
[4]FABIANO R C,PINHEIRO S V,DE ALMEIDA ARAUJO S,et al.Immunoglobulin A Nephropathy:pathological markers of renal survival in pediatric patients.[J]Nephrology(Carlton),2016,21(12):995-1002.
[5]ROBERT T,BERTHEIO T L,CAM B A,et al.Molecular insights into the pathogenesis of IgA nephropathy[J].Trends Mol Med,2015,21(12):762-775.
[6]KANG S H,CHOI S R,PARK H S,et al.The Oxford classification as a predictor of prognosis in patients with IgA nephropathy[J].Nephrol Dial Transplant,2012,27(1):252-258.
[7]邓武成,朱雪花,冉强,等.IgA肾病预后的相关影响因素分析[J].现代生物医学进展,2013,13(34):6703-6704.
[8]FABIANO R C,PINHEIRO S V,SIMOES E,et al.Immunoglobulin A neplmopathy:a pathophysiology view[J].Inflamm Res,2016,65(10):757-770.
[9]陈越,杨满,曹灵.幽门螺杆菌与IgA肾病[J].西部医学,2013,25(2):312-313.
[10]杨晓峰,王晓英,刘春忻.IgA肾病患者感染后肾小球肾炎的病理与临床预后研究[J].中华医院感染学杂志,2015,25(15):3485-3486.
[11]金波,梁少珊,陈浩,等.老年IgA肾病患者的临床病理特点和长期预后的相关危险因素分析[J].肾脏病与透析肾移植杂志,2014,23(5):412-417.
[12]蔡奇玲,王亚明.幽门螺杆菌感染与IgA肾病的相关性研究[J].解放军预防医学杂志,2016,34(4):48-49.
[13]张琦,吴杰,段姝伟,等.老年IgA肾病的临床病理相关研究及预后影响因素分析[J].中国中西医结合肾病杂志,2016,17(4):307-311.
[14]PIPILI C,MICHOPOULOS S,SOTIROPOULOU M,et al.Is there xny associx-lion between IgA ncphropxthy,Crohn′s disease and hclicobactcr py-lori infection[J].Renxl Failurc,2012,34(4):506-509.
[15]乐伟波,梁少珊,邓康平,等.1126例中国汉族成人IgA肾病患者的长期预后及危险因素分析[J].肾脏病与透析肾移植杂志,2011,20(2):101-108.
[16]DAHA M R,VAN K C.Role ofcom plem entin IgA nephmpathy[J].J Nephm,2015,13(21):16-18.
[17]王振伟,杨帅帅.幽门螺杆菌感染与IgA肾病关系的研究进展[J].中国当代医药,2013,20(18):23-24.
[18]刘中华,张黎,田政湘.IgA患者血清
IgA,C3的变化及临床意义研究[J].解放军预防医学杂志,2016,34(4):86-87.
[19]LIM B J,JOO D J,KIM M S,et al.Usefulness of oxford classification in assessing immunoglobulin a nephropaty after transplantation [J].Transplantation,2013,95(12):1491-1497.
[20]袁燕红,王琴,张敏芳,等.血清自蛋自对IgA肾病患者肾脏顶后的顶测价值[J].中华肾脏病杂志,2015,31(2):102-108.
[21]孙旗策,吴军,俞东荣.伴新月体形成的IgA肾病研究进展[J].中国中西医结合肾病杂志,2015,16(11):1029-1031.
[22]MORIYAMA T,TANAKA K,IWASAKI C,et al.Prognosis in IgA nephropathy:30-Year analysis of 1,012 patients at a single center in Japan[J].PLoS One,2014,9(3):e91756.
[23]ZENG C H,LE W B,NI Z H,et al.A multicenter application and evaluation of the Oxford classification of IgA nephropathy in adult Chinese patients[J].Am J Kidney Dis,2012,60(5):812-820.
