保喉食管切除治疗颈段食管癌有限切缘与全喉切除疗效比较
2018-06-07李志刚张晓彬郭旭峰孙益峰杨煜李斌顾海勇华荣茅腾
李志刚 张晓彬 郭旭峰 孙益峰 杨煜 李斌 顾海勇 华荣 茅腾
颈段食管癌占所有发病食管癌患者的5%左右[1]。但以往东西方对颈段食管癌的定义是有差别的,日本等国家定义颈段食管癌必须是肿瘤中点位于胸骨上窝以上,而美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第7版之前均定义肿瘤上缘在胸骨上窝以上,或者肿瘤上缘距离环状软骨(食管开口)5 cm以内,虽然第8版AJCC指南中又将肿瘤中心点位置作为食管癌位置定义的标准,但并没有对颈段食管癌做出确切定义。但对于外科治疗而言,肿瘤上缘其实是影响手术的最关键因素。
颈段食管癌的总体治疗效果并不理想,5年生存率不足50%[2-5]。美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南中推荐使用根治性放化疗,而且推荐高剂量放疗60 Gy以上,目的是避免可能的喉切除,最大限度地保证患者的生活质量。手术治疗只推荐在放化疗失败和有严重狭窄的患者中使用。此指南推出的重要依据是:在西方国家颈段食管鳞癌治疗效果极差[1],而语言又是西方人认为最为重要的社交功能。在最近关于颈段食管癌根治性放化疗研究中,李洪选等[6]报道3年总生存率((overall survival,OS)可以达到49%,但局部治疗失败仍是影响生存的最主要原因。在日本一项长达30年的回顾性分析[7]中显示,以全喉咽食管切除为主要术式可获得77.3%的5年OS,甚至好于胸段食管癌的治疗结果。由此可见,外科治疗有可能使颈段食管癌患者获得更佳的远期生存。
尽量保留喉功能的有限手术一直是颈段食管癌外科治疗探讨的关键点,但另外一项来自日本的长期研究结果显示,在谨慎的患者选择下,可以通过保喉的有限切除获得满意的远期生存[8]。上海市胸科医院自2015—2017年开始实施保喉的颈段食管癌外科治疗,本文拟回顾该期间采用的外科技术、术后并发症、术后复发模式和远期生存情况。
对象与方法
一、 临床资料
收集2015—2017年在上海市胸科医院所有行外科治疗的颈段食管鳞癌患者的临床资料,共计35例。颈段食管癌定义为肿瘤上缘位于胸骨上窝以上。其中7例行全喉咽食管切除(total larynx pharynx esophagectomy,TLPE),28例行保喉的颈段食管(larynx sparing esophagectomy,LPE)或次全食管切除。28例保喉手术中18例肿瘤中心位置位于胸骨上窝以上,10例仅肿瘤上缘位于胸骨上窝以上;另外选取88例上胸段食管癌(upper thoracic cancer esophagectomy,UTE)患者作为对照。患者分组流程见图1。LPE组手术指征:肿瘤未侵犯气管,T1~T2优先选择;没有双侧喉返神经麻痹;肿瘤口侧侵犯在环状软骨下缘之下。

图1 分组流程图。TLPE:全喉咽食管切除; LPE:保喉的颈段食管或次全食管切除;UTE:上胸段食管癌切除
二、 外科技术
1. LEP组:保喉手术近端食管/咽—胃/空肠/结肠重建方法包括手工吻合、器械吻合等方法。
(1) 手工吻合:①食管开口—代食管消化道端端吻合,此技术关键在于高位下咽、喉、食管环周游离,并牵引向右侧,充分显露食管开口及咽后壁;然后两者先吻合后壁,再吻合前壁。②高位咽后壁切除后重建,适用于肿瘤上缘较高并累及咽后壁的病变。此时切除范围涵盖漏斗样结构后壁,切除范围上至咽后壁病变上缘1 cm以上位置,两侧壁至梨状窝前壁,杓会厌皱襞,下至环后下方食道前壁黏膜。代食管胸胃上缘后壁需做成舌形瓣形状,最终胸胃要修整成汲水竹筒样,并间断或连续完成重建。
(2) 器械吻合:①圆形吻合器,多选择21号口径,直接将吻合器钉砧经食管开口放入下咽内。此前需在保护喉返神经的前提下做适当向上游离,使之脱离环状软骨后壁。保证最大限度的切缘距离;②直线吻合器:优点是可以保证较大的吻合口口径,于食管开口处横断食管,上提代食管胃至乳突水平,然后在对应高度做切口,将直线切割缝合器两臂分别插入咽内和胃内,完成击发吻合,前壁间断缝合完成全周重建。
2. TPLE组:做高位衣领切口,于舌骨上离断咽喉,于环状软骨下缘无肿瘤侵犯处离断气管,做颈部及上纵隔淋巴结清扫后,做腹腔镜游离胃并做管胃成形,然后经裂孔后纵隔上提至颈部,口底开口两侧适当缩减几针,使其口径与代食管器官匹配,最后与口底做间断端端吻合重建。
3. UTE组:常规行左颈、右胸、上腹部三切口手术进路,胸腔镜或开放行胸部食管游离和淋巴结清扫,腹腔镜或开腹游离胃并做管状胃成形,上提颈部做重建。
三、 统计学处理
结 果
一、 三组患者术前和手术资料比较
三组患者临床基本资料如表1所示。LPE组患者平均年龄61岁,男性占96.4%。LPE组的肿瘤上缘高度比TLPE组低,但肿瘤长度却较TPLE组长,三组间比较差异均有统计学意义(P<0.001)。LPE组中除1例空肠间置外,均选择胃代食管进行消化道重建(96.4%);后纵隔上提路径占64.3%;三切口手术占89.3%;其余3例患者手术经纵隔裂孔路径完成,其中2例患者使用胸骨部分劈开辅助显露。新辅助治疗在三组中使用率都很低,LPE组为7.1%,UTE组仅为5.6%。
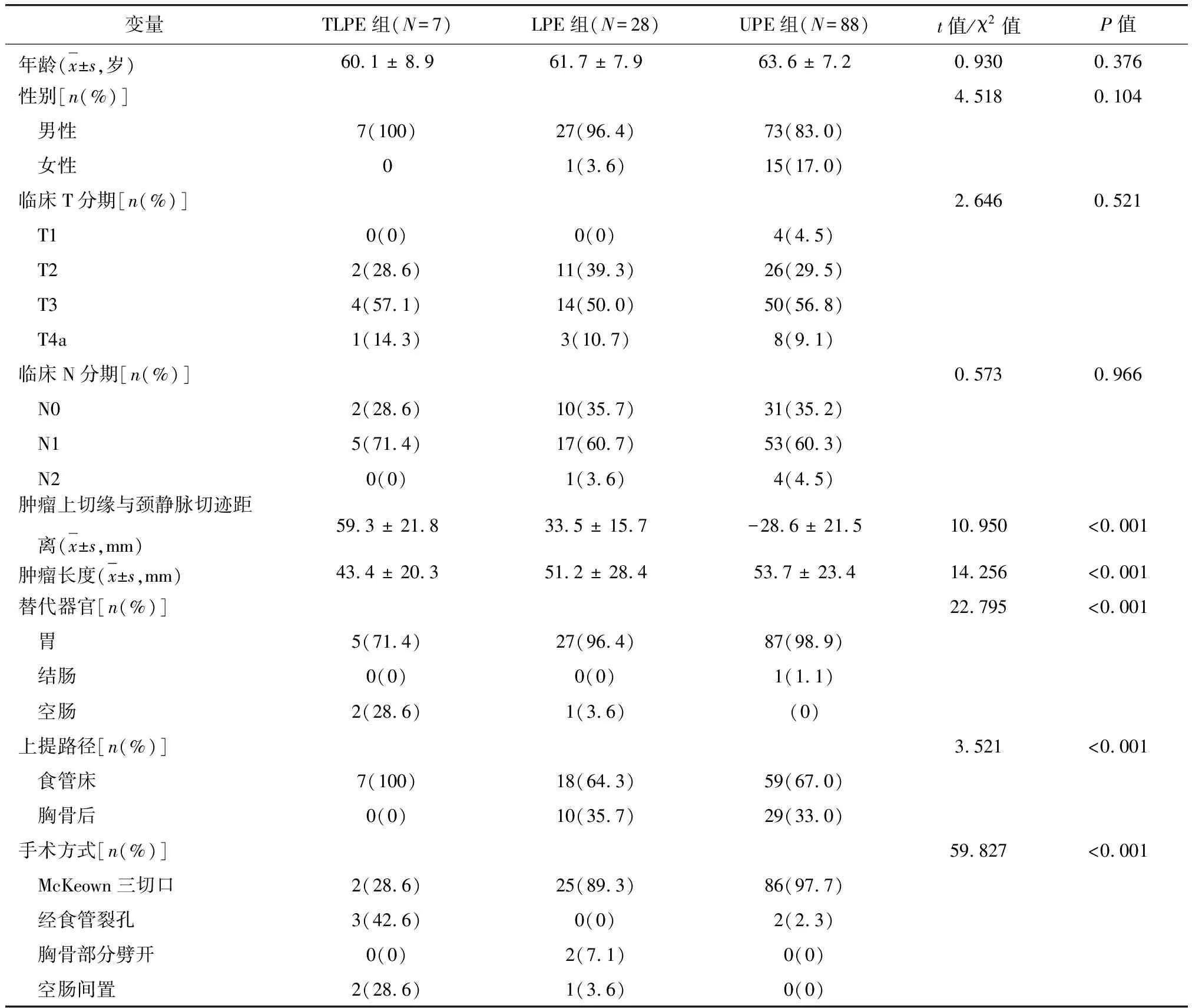
表1 三组患者临床基本资料比较
二、 三组患者术后病理和肿瘤切除率比较
三组患者术后病理和肿瘤切除情况见表2。术后病理分期LPE组T3期患者占57.1%,N分期种N0、N1、N2、N3期分别为46.4%、25.0%、25.0%和3.7%,三组间T分期和N分期比较差异均无统计学意义(P>0.05)。对TPLE、LPE、UTE三组患者的不同区域淋巴结转移分析可见,颈部、上纵隔转移率分别为14.3%、41.4%、14.8%和28.6%、31%、29.5%。LPE组肿瘤完整性切除结果为:R0切除率60.7%,R1切除(近端切缘镜下阳性)率13.1%,R2切除率26.2%(其中3例阳性淋巴结残留,3例肿瘤侵犯气管或主动脉弓);9例非R0切除的患者中,4例术后接受了辅助放化疗,截至2018年1月28日随访期,4例患者由于肿瘤进展死亡。
三、 三组患者术后转归比较
TPLE、LPE、UTE组患者术后并发症发生率分别为42.9%、25.0%和21.6%,其中吻合口瘘发生率分别为28.6%、14.3%、9.1%,喉返神经麻痹分别为0、7.1%和9.1%(表3)。
所有患者的中位随访期为14.3个月。行R0切除的88例患者中,TPLE、LPE、UTE组复发率分别为16.7%、11.8%和23.1%,其中LPE组有1例(5.8%)出现局部复发。随访期内三组患者病死率分别为病死率分别为14.3%、21.4%和17.0%。LPE组6例死亡患者中,4例为R2切除肿瘤进展,2例源于肿瘤复发。
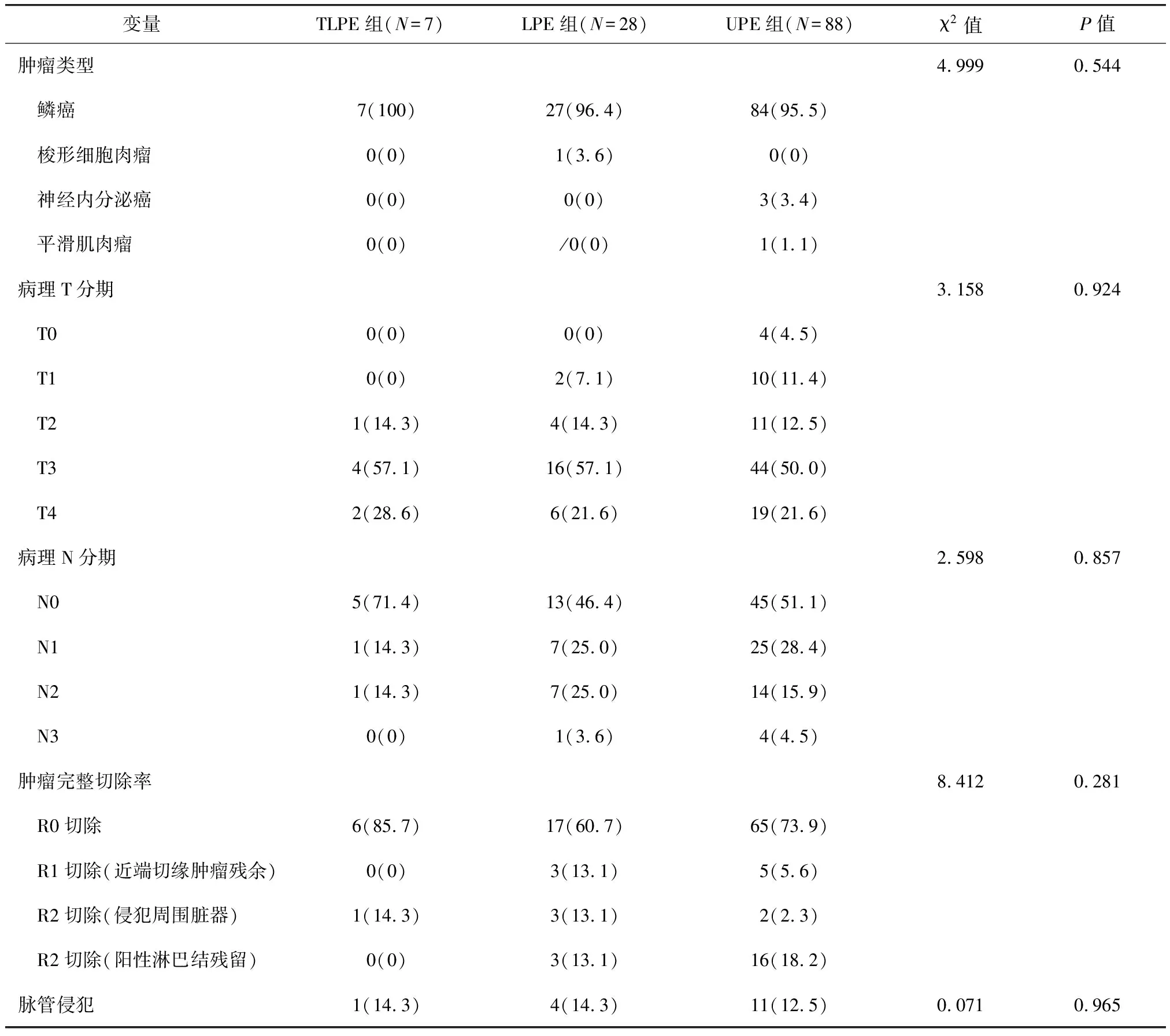
表2 三组患者术后病理和肿瘤切除情况比较[n(%)]

表3 术后并发症发生情况[n(%)]
讨 论
本研究是一组在3年内完成的保喉颈段食管癌外科治疗结果回顾,中位随访期14.3个月,OS达到79.1%;围术期并发症发生率低于其他报道,尤其是喉返神经麻痹发生率明显低于同类报道[9,10],并且没有出现院内死亡病例。由此可见,保喉颈段食管癌切除是一种比较好且安全的手术方式。
有限切缘是指肿瘤切缘没有达到食管癌外科治疗的传统要求,即小于5 cm。由于颈段食管只有5 cm左右,因此保喉的颈段食管癌切除必然无法达到传统意义的标准。尽可能地提高近端吻合的高度是获得满意局部控制效果的关键技术。通常吻合口应设置于食管开口处,甚至是下咽区。我们采用各种不同的技术去完成吻合,包括手工和器械。病理结果显示,经过以上方法处理后近端切缘的R0切除率达到了86.9%。有趣的是,即便近端切缘阳性,经过有针对性的术后辅助治疗后,近端食管或吻合口的真正复发患者仅1例(4.6%)。
由于颈段食管癌通常与喉返神经有密切关系,术中喉返神经保护显得尤为重要,我们通常在完成颈部切口后,首先暴露两侧喉返神经颈段,并完成颈部淋巴结清扫;而在进行颈部吻合时,尽量远离环甲关节,由此获得了仅为7.1%的喉返神经损伤率,这一结果明显低于Makino等报道的28.1%[8]。而器械吻合的使用使吻合口瘘发生率仅为全喉切除的一半。高位吻合是否会带来术后吞咽功能异常,本研究结果显示并没有出现此类生活质量问题。我们认为吻合口位于下咽食管开口附近都是安全的。但应注意吻合口狭窄的发生,这主要由环状软骨板挤压吻合口所致,应尽量避免在这一平面进行吻合。
对于颈段食管癌应进行多大范围的淋巴结清扫并无定论,单纯经颈、腹两切口和食管拔脱无法进行有效的纵隔淋巴结清扫。本组28例保喉患者中,25例采用三切口手术,2例辅助了胸骨部分劈开进行上纵隔淋巴结清扫,结果发现31.0%的患者有右喉返神经旁淋巴结转移,13.8%有左喉返神经旁淋巴结转移;而中下纵隔和腹部淋巴结转移仅为10.2%和6.7%。由此可见,有效的上纵隔淋巴结清扫非常必要,而胸骨部分劈开进路不仅可以避免体位变换,而且可以进行更好的肿瘤切除和上纵隔淋巴结清扫,值得推荐。
非R0切除、T分期较晚会明显影响患者的生存结果。本研究中,LPE组在随访期间死亡的患者多数为R2切除,尤其是肿瘤侵犯气管膜部后,或者术前即出现喉返神经麻痹症状。在Saeki 等[7]长达30年的病例回顾中,R0切除患者的5年OS超过70%,但多数患者均为全喉咽食管切除病例。而Makino等[8]的保喉病例分析中,其5年OS仅为36.3%,低于非保喉患者的51.2%,但在Ⅰ期患者中两组没有差异。因此,合理选择病例是获得满意远期效果的关键。
综上所述,保喉颈段食管癌切除在R0切除患者中可以获得安全的围术期恢复和可能的长期生存,单纯近端切缘阳性并不会影响生存结果。
参 考 文 献
1 Mendenhall WM, Sombeck MD, Parsons JT, et al. Management of cervical esophageal carcinoma[J]. Semin Radiat Oncol, 1994,4(3):179-191.
2 Triboulet JP, Mariette C, Chevalier D, et al. Surgical management of carcinoma of the hypopharynx and cervical esophagus: analysis of 209 cases[J]. Arch Surg, 2001,136(10):1164-1170.
3 Nishimaki T, Kanda T, Nakagawa S, et al. Outcomes and prognostic factors after surgical resection of hypopharyngeal and cervical esophageal carcinomas[J]. Int Surg, 2002,87(1):38-44.
4 Kakegawa T, Yamana H, Ando N. Analysis of surgical treatment for carcinoma situated in the cervical esophagus[J]. Surgery, 1985,97(2):150-157.
5 Tong DK, Law S, Kwong DL, et al. Current management of cervical esophageal cancer[J]. World J Surg, 2011,35(3):600-607.
6 Li HX, Liu J, Cheng Y, et al. Concurrent chemoradiotherapy for cervical esophageal squamous cell carcinoma: treatment results from a prospective observational study[J]. Dis Esophagus, 2018,31(5).
7 Saeki H, Tsutsumi S, Yukaya T, et al. Clinicopathological features of cervical esophageal cancer: retrospective analysis of 63 consecutive patients who underwent surgical resection[J]. Ann Surg,2017,265(1):130-136.
8 Makino T, Yamasaki M, Miyazaki Y, et al. Short- and long-term outcomes of larynx-preserving surgery for cervical esophageal cancer: analysis of 100 consecutive cases[J]. Ann Surg Oncol,2016,23(Suppl 5):858-865.
9 Kadota H, Sakuraba M, Kimata Y, et al. Larynx-preserving esophagectomy and jejunal transfer for cervical esophageal carcinoma[J]. Laryngoscope, 2009,119(7):1274-1280.
10 Miyata H, Yamasaki M, Takahashi T, et al. Larynx-preserving limited resection and free jejunal graft for carcinoma of the cervical esophagus[J]. World J Surg, 2013,37(3):551-557.
