14N-15N同位素交换技术及其在冶金动力学研究中的应用
2018-06-07平东平胡晓军张亚召周国治
平东平,胡晓军,张亚召,周国治
(北京科技大学 钢铁冶金新技术国家重点实验室,北京 100083)
氮在钢中有正反两面的作用,对钢材性能影响很大.大气中氮广泛存在,极易在冶炼过程中进入铁液和钢液中[1];钢渣具有隔离空气同时进行脱氮的作用,且氮在渣中的溶解度较低.这些因素导致钢中的氮易吸难除.
为了较为精确且高效地控制钢中的氮含量,对氮在钢液和熔渣表面的溶解动力学进行研究很有必要.传统的实验方法具有一定的局限性,不能排除液相和气相扩散的影响.运用新的同位素气体交换技术,氮在钢液和熔渣界面的吸附和脱附动力学可以在平衡状态下进行,从而消除液相传质影响.
目前,采用14N-15N同位素交换技术对氮溶解动力学进行研究的主要是美国和日本的研究人员.美国卡内基梅隆大学和宾夕法尼亚大学的研究人员Byrne、Glaws和Fruehan等最早将该技术引入冶金反应动力学的研究[2-4].随后,日本东京大学和大阪大学的研究人员Sano、Morita和Ono等运用该技术对元素对氮溶解速率的影响进行了重点研究,探讨了元素的影响机理[5-15].近来,韩国的研究人员Han和Min等也对此进行了一些跟进研究[16-17].在国内,胡晓年[18]等组成的课题组最早将同位素气体交换技术引入该领域,在利用碳和氧同位素气体交换技术对冶金反应动力学进行了大量研究的基础上[19-22],近期开始运用14N-15N同位素交换技术研究钢液和熔渣表面的吸、放氮反应动力学.文中即对14N-15N同位素交换技术的原理及其在冶金反应动力学研究中的应用进行了介绍.
1 14N-15N同位素交换技术的原理
1.1 14N-15N同位素交换反应
钢液表面氮溶解的总反应可以用式(1)表示:
N2(g)=2N,
(1)
氮的两种同位素14N与15N如图1所示.由图1可知,能够形成3种不同类型的氮分子28N2,29N2和30N2.相应地,体系中发生3种不同的溶解反应,并最终达到平衡,反应式如下:
28N2(g)=214N,
(2)
30N2(g)=215N,
(3)
14N+15N=29N2(g),
(4)
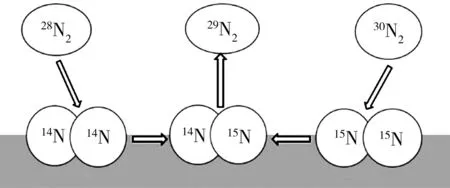
图1 14N-15N同位素交换反应
1.2 速率常数的计算
通过氮同位素交换反应的原理,可以得到界面反应速率常数的计算方法.美国和日本的研究人员分别从统计学和质量平衡的角度出发,推导出了两种不同的速率常数计算公式.
Byrne和Belton[3]的计算公式由统计学理论结合理想气体状态方程推导得出.用28F,29F和30F分别表示28N2,29N2和30N23种类型氮分子的分数,14f和15f分别表示体系中14N和15N两种氮原子的分数,有:
28F+29F+30F=1,
(5)
14f+15f=1.
(6)
结合氮分子在表面的分解和合成的速率为vmol·cm-2s-1,得到29N2形成概率为2·14f·15f,界面上29N2反应的概率为29F.那么,29N2型氮分子形成的速率为:
(7)
又同位素交换达到平衡态时,概率理论得到的2·14f·15f等于29N2此时的分数29Feq.结合理想气体状态方程,当反应为一级反应,v=kPN2,代入式(8)积分整理可得:
(8)

(9)
同理,若以30N2为研究对象,可以得到
(10)
式中,30Fi、30F和30Feq分别为同位素交换反应中30N2在初始状态、任意时刻和平衡状态下的分数.
Kobayashi[13]等从30N2质量平衡的角度出发,在氮的溶解是一级反应的条件下,也得到了相同的计算公式.Ono[8]等在假设氮的吸附不受脱附影响的情况下,根据被吸附氮中的30N2等于通入的氮气中的30N2,由质量平衡关系得:
(11)
由相似的推导过程得到:
(12)
式中,30Fi和30Ff分别为30N2在通入和排出时的分数,R为气体常数.
以上两个公式,式(12)给出的值相对于式(10)计算出的值较小.当30Fi和30Ff相差很小时,两个计算结果的相差可以忽略.
利用气相质谱仪可以测量气体中各组分的离子强度,得到目标组分的分数,代入式(12),即可计算出速率常数k,该速率常数仅为表观速率常数.
此外,Fruehan[2]等指出,虽然同位素交换反应中液传质的影响可以排除,但为了确定真实的界面反应速率常数,有必要对气相传质进行修正.氮的真实速率常数kc可以通过表观速率常数ka和气相传质系数kg来确定:
(13)
ka即是测量计算出的表观速率常数,kg也可由预先的计算得到,由此可以计算得到kc.
2 实验方法
实验所用气体为高纯的Ar,H2,N2气体,以及30N2富集气.通过调节Ar气配比改变氮气分压,在研究铁合金体系时用Ar- H2混合气体作为保护气,以保证热平衡前升温过程中密封反应室内的还原氛围,降低氧等表面活性元素的影响.实验过程中用较为精确的质量流量计来调节气体流速.
对铁合金体系进行实验时,将配好的试样放入坩埚,通入保护气后升温至设定温度,待试样完全熔化后,调整进气管使喷口距液面一定高度,通N2直到饱和,将普通N2迅速切换成30N2富集气.实验过程中,通过气相质谱仪在线检测同位素气体组分的离子强度变化,直至气体组成稳定.实验后,将坩埚取出并冷却,对得到的试样进行成分分析.研究熔渣体系时,为确保研究结果的准确性,多使用铂金坩埚.
通过改变反应气体的流速、温度、氮分压和试样成分,同时利用气相质谱仪在线分析得到的相应数据,可以计算出一系列的速率常数.分析不同条件下的速率常数,可以得到不同因素对反应速率的影响作用,进而对反应的机理进行深入阐释.
3 相关研究成果
20世纪80年代至今,经过美、日、韩国科研人员不断努力,14N-15N同位素交换技术在研究氮的溶解动力学方面取得了一定成果.研究范围主要为液态和固态铁合金体系,对熔渣体系也有少量涉及;主要研究内容涵盖速率限制环节的确定,气体流速、反应温度、氮分压、元素以及熔渣成分对反应速率的影响.
3.1 铁合金体系
目前,在液态铁合金体系中运用氮同位素交换技术进行的实验,反应的机理尚未得到充分阐释,已有的研究大量采用空位阻塞模型(Site-blockage Model)对反应机理进行解释.根据该模型,氮的溶解过程可以被划分为以下5个步骤:
(14)
(15)
Nad=N(l),
(16)
(17)
(18)

氮气溶解时,表面反应可以分为如式(14)和式(15)所示的吸附和分解两个基本环节:氮气分子占据一个空位成为被吸附的氮分子,被吸附的氮分子另外得到一个空位,分解成为两个被吸附的氮原子.通常认为,这两个环节是氮溶解过程中界面反应的速率限制环节,但仍存在争议.Byrne和Belton等认为第一个环节是速率限制环节,而Ono[6]等认为第二个步骤是速率限制环节,对此需要取得更多精准数据进行验证讨论.
已有研究表明,气体流速在达到临界值后将不再影响反应速率.对于纯铁液体系,Byrne[3]的实验中临界值是180 cm3/min,而Morita[8]的实验中临界值是900 cm3/min.不同实验装置与实验操作,动力学条件不同,流速的临界值也就不同.临界值以下,界面上参加反应的氮分子供应不足,使反应速率偏小.因此,实验前需要确定流速的临界值,采用高于临界值的流速进行同位素交换反应.
在1 473 K~2 023 K的温度范围内,纯铁液和固态纯铁反应界面上,温度对氮溶解速率常数的影响如图2所示.同一温度下不同研究者得到的氮溶解速率常数及其推导出的阿伦尼乌斯公式不同.但在大部分研究中,温度对速率的影响具有相同的趋势,温度越高,反应速率越大.在氮分压的影响方面,不同研究者看法趋向一致,认为铁合金体系中氮的溶解反应是与氮分压有关的一级反应.
在元素对氮溶解速率常数的影响方面,不同元素表现出不同程度的促进或抑制作用.Morita和Ono等对此进行了广泛的研究,这些元素包括S[6],Ti、Zr、V、Cr[8],Cu、Sn、W[9],O、Se、Te[10],Al、Si、B[12]等.合金元素对溶解速率的影响如图3所示[17].斜率为正表明元素促进氮溶解,反之抑制氮溶解,斜率大小表示影响程度的大小.对某些元素的影响作用,不同的研究结果还存在不一致之处.对比固态体系和液态体系,元素对氮溶解速率的影响趋势相同,但前者影响程度比后者小[14].此外,高S含量时仍然存在氮的残余吸附速率[4]等问题,仍然无法得到清晰解释.
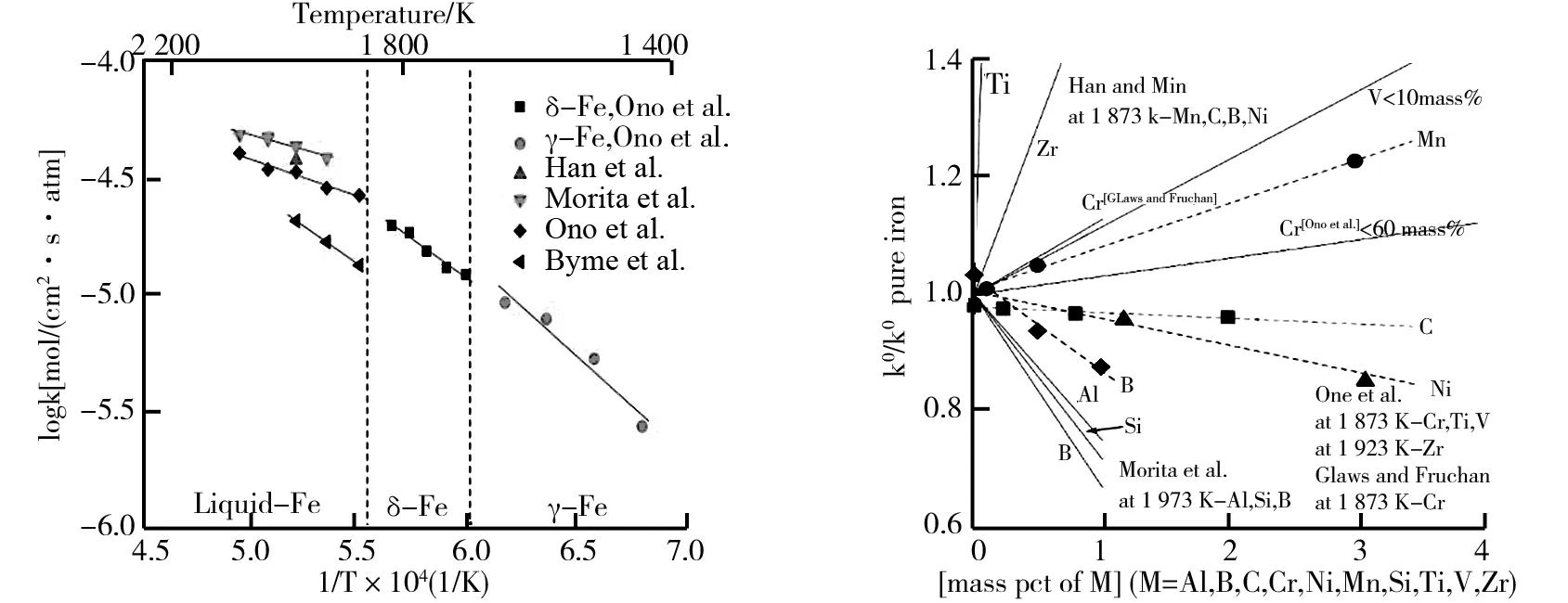
图2 温度对氮溶解速率常数的影响图3 Fe-M液态体系中合金元素对氮溶解的影响
Ono[8]等的研究表明,合金元素对氮溶解速率的影响主要取决于其与铁液中N的亲和力.合金元素与N间的亲和力越强于Fe与N间的亲和力,则越促进氮的分解;合金元素与N元素间的排斥力越强,则越阻碍氮的分解.这种亲和力可以用相互作用系数来表征,相应的表征关系可以用空位阻塞模型中空位活度的改变来解释.
Han[16]等在前人理论的基础上,结合空位阻塞模型和Langmuir理想吸附理论,对元素对氮溶解速率常数的影响进行了讨论.当氮分子的分解是速率限制环节,那么吸附环节可以认为是达到平衡的.理想情况下,θi为固体表面被元素i覆盖的分数,即覆盖率,则ai可以用空白面积的分数(1-Σθi)来表示.结合Langmuir理想吸附理论:
(19)
可得到添加元素对速率常数的影响公式:
(20)
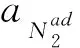
国内尚无氮同位素的相关研究,但胡晓军[18-22]等在运用碳同位素进行实验时,基于反应的电化学机制提出了电子竞争反应的新模型.他们认为气体元素在合金中以离子态存在,反应的过程中气体在界面获得电子,从而解离进入合金.各种因素通过改变合金中的电子数量从而改变其溶解速率.当合金中电子数量增加,气体溶解的速率增加.电子竞争反应模型较好解释了气体溶解反应的机理.将其运用到氮同位素交换技术中研究氮的溶解过程有重要作用.
3.2 熔渣体系
Iuchi[7]、Han[17]运用该技术对熔渣体系进行了研究.在CaO-Al2O3,CaO-SiO2和CaO-CaF2渣系中,氮的溶解反应是与氮分压有关的一级反应,其值比在液态铁合金体系中要小;对于CaO-Al2O3和CaO-SiO2渣系,熔渣成分对速率常数的影响与其对氮容量的影响具有相同的趋势.CaO-Al2O3-SiO2渣系中,氮溶解的活化能是纯铁液的1.5~3倍;保持其他两个组分等含量时,SiO2和Al2O3含量的增加都会引起速率常数的增大.CaO-Al2O3-TiOX渣系中,保持其他两个组分等含量时,速率常数随TiOX含量的增加而降低;而当固定CaO含量为20%时,速率常数随着TiOX含量增加略微升高.Han等通过测定渣结构的变化,分析了CaO-Al2O3-CaF2渣系中CaF2对溶解速率的影响机理,讨论了渣系中支配性影响离子的结构.运用氮同位素交换技术对熔渣体系中氮溶解过程的研究非常有限,各因素对氮溶解过程的影响机理也没有得到清楚阐释.
4 结语
相比传统方法,采用14N-15N同位素交换技术对氮在铁合金液、熔渣和固态铁合金表面的溶解动力学进行研究,可以得到较为准确的界面反应速率常数.已有的采用氮同位素交换技术的研究虽然在反应级数等方面取得共识,但测量数据有限,研究结果也存在差别.而且,被大量采用的空位阻塞模型不能统一解释反应过程中各因素对速率常数的影响,仍旧没有理论模型能够统一阐释氮在冶金反应中的动力学机理.等未来运用氮同位素交换技术获取大量准确的实验数据,对氮在冶金界面的反应机理将进行深入分析.
[1] 李勇.炼钢过程中钢水氮含量控制[J].山东冶金,2008,45(S1):52-56.
[2] P C GLAWS,R J FRUEHAN.The kinetics of the nitrogen reaction with liquid iron-chromium alloys[J].Metallurgical & Materials Transactions B,1986,17(2):317-322.
[3] M BYRNE,G R BELTON.Studies of the interfacial kinetics of the reaction of nitrogen with liquid iron by the15N-14N isotope exchange reaction[J].Metallurgical Transactions B,1983,14(3):441-449.
[4] P C GLAWS,R J FRUEHAN.The kinetics of the nitrogen reaction with liquid iron-Sulfur alloys[J].Metallurgical & Materials Transactions B,1985,16(3):551-559.
[5] K MORITA,H ONO,N SANO.Measurement of nitrogen dissolution rate into molten alloys by isotope exchange technique[J].Journal of the Mass Spectrometry Society of Japan,1999,47(1):27-31.
[6] J LEE,K MORITA.Interfacial kinetics of nitrogen with molten iron containing sulfur[J].The Iron and Steel Institute of Japan International,2003,43(1):14-19.
[7] K IUCHI,K MORITA,N SANO.Kinetics studies on the dissolution of nitrogen in the CaO-Al2O3-SiO2and CaO-Al2O3-TiOx melts[J].Metallurgical & Materials Transactions B,1998,29(6):1 235-1 240.
[8] H ONO,K MORITA,N SANO.Effects of Ti,Zr,V, and Cr on the rate of nitrogen dissolution into molten iron[J].Metallurgical & Materials Transactions B,1995,26(5):991-995.
[9] H ONO-NAKAZATO,Y DOHI,D YAMADA,et al.Effects of Cu,Sn and W on the rate of nitrogen dissociation on the surface of molten Iron[J].Transactions of the Iron & Steel Institute of Japan,2006,46(9):1 306-1 311.
[10] H ONO,K IUCHI,K MORITA,et al.Effects of oxygen and nitrogen on the rate of nitrogen dissolution in iron-chromium and iron-vanadium alloys[J].The Iron and Steel Institute of Japan International,1996,36(10):1 245-1 249.
[11] H ONO-NAKAZATO,T KOYAMA,T USUI.Effect of surface concentration of alloying elements on nitrogen dissolution rate in molten iron alloys[J].The Iron and Steel Institute of Japan International,2003,43(3):298-303.
[12] K MORITA,T HIROSUMI,N SANO.Effects of aluminum,silicon,and boron on the dissolution rate of nitrogen into molten iron[J].Metallurgical & Materials Transactions B,2000,31(5):899-904.
[13] A KOBAYASHI,F TSUKIHASHI,N SANO.Kinetic studies on the dissolution of nitrogen into molten iron by14N-15N isotope exchange reaction[J].The Iron and Steel Institute of Japan International,1993,33(11):1 131-1 135.
[14] H ONO-NAKAZATO,A MATSUI,T USUI,et al.Nitrogen dissociation rate at solid surface of ferrous alloys[J].The Iron and Steel Institute of Japan International,2002,42(3):134-229.
[15] H ONO,H FUKAGAWA,K MORITA,et al.Effects of O,Se,and Te on the rate of nitrogen dissolution in molten iron[J].Metallurgical & Materials Transactions B,1996,27(5):848-853.
[16] S M HAN,J H PARK,S M JUNG,et al.Kinetic study on surface dissolution of nitrogen on liquid steel by isotope exchange technique[J].The Iron and Steel Institute of Japan International,2009,49(4):487-494.
[17] S M HAN,D J MIN.A kinetic study on the control of nitrogen in molten slag and metal[J].Journal of Iron & Steel Research,2011,18(S3):301-309.
[18] 胡晓军.13CO2-CO同位素交换技术研究含铁氧化物熔渣表面CO2分解反应的动力学[C]// 2006年全国冶金物理化学学术会议论文集.济南:中国稀土学报编辑委员会,2006:151-153.
[19] X HU,T ZHANG,H YAN,et al.Interfacial rate of CO2-CO reaction with the solid iron and iron oxide by isotope exchange technique at 1273 K[J].The Iron and Steel Institute of Japan International,2012,52(9):1 529-1 534.
[20] X HU,T ZHANG,K CHOU,et al.Determination of the rate of CO2-CO reaction with magnetite by isotope exchange technique[J].Steel Research International,2012,83:886-891.
[21] T ZHANG,X HU,X HOU,et al.Using isotope exchange technique to study the reaction between CO2-CO and iron oxides system and methods analysis[J].Journal of Iron & Steel Research,2012,24(7):59-62.
[22] 严红燕, 胡晓军, 张昭亮,等. 气相质谱法研究Fe与CO2-CO氧化反应动力学[J].北京科技大学学报,2015,37(3):281-285.
